甘珀酸抑制eATP-P2X7R-NLRP3信号通路减轻慢性胰腺炎纤维化的实验研究
张桂贤,王曼雪,刘大卫,刘洪斌△,聂卫,石釧
慢性胰腺炎(chronic pancreatitis,CP)是基因突变、毒性代谢、自身免疫、胰管狭窄等多因素参与的病理性炎症综合征,也是一种以腺泡细胞破坏、进行性纤维化为主要特征的疾病[1]。临床上主要表现为反复发作的上腹部疼痛和胰腺内、外分泌功能不全。患者生活质量较低,且该病发病率有逐年上升的趋势。胰腺炎是全球因病死亡的主要原因之一,其中急性胰腺炎病死率为30%,CP病死率为50%[2]。目前,亟需认识CP进展的潜在机制,以确定基于新机制的治疗靶点。
抑制胰腺炎症和纤维化可有效缓解CP的临床症状,是防止CP恶变的有效手段。笔者前期研究发现,核苷酸结合寡聚化结构域样受体3(nucleotide binding oligomerization domain-like receptor 3,NLRP3)炎性体是多种慢性炎症反应的中心环节,不仅与肺纤维化[3]、肾间质纤维化[4]和肝纤维化[5]等相关,也与CP胰腺纤维化有着十分密切的关系。腺苷三磷酸(ATP)是最丰富的受体家族之一,参与细胞通讯与信号传递。嘌呤能2X7受体(purinergic 2X7 receptor,P2X7R)是ATP唯一的生理性、配体门控的离子通道受体,在胶质细胞上高表达[6]。当宿主细胞受到损伤而发生坏死时,细胞中的ATP等分子会释放到胞外,细胞外ATP(extracellular ATP,eATP)是重要的损伤相关分子模式(damage associated molecular patterns,DAMPs)分子,能够激活细胞表面P2X7R,打开其介导的离子通道,使K+外流,并能够通过胞外的缝隙连接蛋白1(pannexin-1,PAN-1)在细胞膜形成小孔[7],使一些NLRP3的配体通过小孔进入细胞内而启动NLRP3炎性体的装配[8]。本研究采用雨蛙素反复注射制备小鼠CP模型,以eATP抑制剂甘珀酸(carbenoxolone,CBX)通过抑制PAN-1影响ATP的释放对模型进行干预,观察能否通过eATP-P2X7R-NLRP3信号通路对胰腺炎症和纤维化的进程产生影响。
1 材料与方法
1.1材料
1.1.1主要试剂 雨蛙素、甘珀酸购自美国Sigma公司;ATPlite一步发光检测试剂盒购自美国Perkinelmer公司;半胱氨酸天冬氨酸蛋白酶1(Caspase-1)、P2X7R、NLRP3抗体购自美国Novus公司;PAN-1抗体购自美国Abcam公司;GAPDH抗体、荧光二抗(红、绿)购自美国CST公司;实时荧光定量逆转录聚合酶链反应(qPCR)所需一系列试剂盒均购自美国Thermo fisher公司。
1.1.2主要仪器 DM4000B型研究级显微镜、RM2235/2245型切片机、ASP300全自动组织脱水机及DM750P型偏振光显微镜均购自德国Leica公司。
1.2方法
1.2.1实验动物 6周龄SPF级健康雄性C57BL/6小鼠50只,体质量(21±1)g,购自北京维通利华实验动物技术有限公司(批号:11400700185632)。实验前动物进行适应性喂养1周,于动物中心屏障级动物室内饲养,每笼5只。实验过程中动物自由摄食、饮水,12 h交替照明,室温(23±2)℃,相对湿度(55±5)%。
1.2.2模型制作与分组 50只小鼠按随机数字表法分为正常组,模型组,CBX低、中、高剂量组,每组10只。除正常组外,其他组实验动物采用反复腹腔注射雨蛙素的方法制作小鼠CP模型,单次注射剂量为50 μg/kg,每小时给药1次,6次/d,每周一、三、五注射,连续6周。最后一次注射雨蛙素后,CBX各剂量组小鼠分别予以CBX(25、50、100 mg/kg)腹腔注射,连续2周。模型组腹腔注射与给药组等频次、等体积的生理盐水,2周。正常组在整个8周研究期间均腹腔注射与给药组等频次、等体积生理盐水。末次给药24 h后将小鼠脱颈处死。小心剪开腹腔后,分离胰腺组织。
1.2.3胰腺组织HE染色及炎症损伤程度评分 将10%中性福尔马林溶液固定的胰腺组织按标准方法进行石蜡包埋,4μm切片,染色。胰腺损伤的严重程度由病理医师采用盲法在未知分组的情况下,每只小鼠随机抽取任意部位的病理切片3张,每张组织切片读取10个不同视野,对胰腺组织炎症细胞浸润、腺泡萎缩及纤维化程度的病理改变进行评分。
1.2.4组织中eATP含量测定 将小鼠胰腺组织从液氮中取出,每只称取20 mg放至2 mL离心管中,剪碎。每管加入1mL组织培养液(其中含青霉素200 U、链霉素200 μg、庆大霉素10 μg),室温放置5 min。PBS洗涤3次后,加入10倍体积PBS,CO2培养箱中37 ℃ 1 h,离心6 000×g5 min取上清,备用。按ATP标准品标识加入960 μL蒸馏水配制为10 mmol/L储存液。10倍等比稀释储存液至1 μmol/L~1 pmol/L。将标准品等比稀释系列每孔50 μL添加至黑色96孔板,然后加入50 μL底物溶液。另取一列,每孔添加50 μL样品上清液,然后加入50 μL底物溶液。微量振荡器避光振荡30 s。将96孔板放置于荧光/化学发光检测仪读板。按照Wan等[9]的ATP化学发光法测定组织eATP。
1.2.5胰腺P2X7R、NLRP3和Caspase-1免疫荧光染色 将胰腺组织标本切片、脱蜡、微波抗原修复、山羊血清封闭以减少非特异性染色,一抗孵育过夜,PBS漂洗3次,每次5 min。加入二抗避光孵育1.5 h,PBS漂洗3次,每次5 min。DAPI复染及封片,荧光显微镜观察组织中P2X7R、NLRP3和Caspase-1表达,使用Leica LAS Extended Annotation模块的软件进行处理及定量分析。蛋白表达量以累积光密度(IOD)值表示。
1.2.6qPCR反应检测胰腺中P2X7R、NLRP3、Caspase-1和PAN-1的mRNA表达 以Trizol试剂,从冷冻的胰腺组织中提取总RNA。通过Nanodrop检测RNA纯度及浓度。用反转录试剂进行反转录合成cDNA,再进行PCR扩增,检测mRNA的表达水平。PCR反应体系为:预混SYBR Mix 10 μL,上、下游引物各 0.5 μL,cDNA 模板 2 μL,50×ROX Reference Dye 0.4 μL,ddH2O 6.6 μL,总体系共20 μL。扩增条件:95 ℃预变性15 min;95℃变性10 s,60℃退火20 s,72℃延伸30 s,40个循环。引物序列使用NCBI网站Primer-BLAST在线设计,具体序列如表1所示。阈值循环数测定采用iCycler软件1.0版本(Bio-Rad)。将各样品cDNA 10倍稀释后取2 μL作模板,分别用目的基因引物和内参基因(GAPDH)引物进行扩增,每组重复8次,在60~95℃通过熔解曲线对扩增产物进行验证。采用2-ΔΔCT方法对每个基因mRNA的相对丰度变化进行计算。
1.3统计学方法 采用SPSS 22.0软件进行统计学处理。符合正态分布的计量资料用均数±标准差(±s)表示。多组间比较采用单因素方差分析(ANOVA),组间多重比较采用LSD-t检验。P<0.05为差异有统计学意义。

Tab.1 Primer sequence for amplification reaction表1 扩增反应所需引物序列
2 结果
2.1 胰腺慢性炎症损伤组织学评分 光镜下,正常组小鼠胰腺细胞分布紧密、结构清晰、胞浆丰富、胰岛数目较多且胰管无组织学改变。与正常组相比,模型组可见明显的慢性炎症及纤维化,表现为胰腺结构异常、腺泡萎缩、炎症细胞浸润和纤维化,胰岛结构破坏且数量减少,胰管扩张;与模型组相比,CBX各剂量组炎症和纤维化程度均有不同程度减轻,高、中剂量组变化显著。且随着剂量的增加,细胞间隙减少、胰管扩张减轻、胶原纤维含量降低及炎症细胞浸润减少等变化越来越明显。见图1、表2。
Tab.2 Comparison of histopathological scores of the pancreas between five groups表2 各组小鼠胰腺病理组织学评分比较(n=10,分,±s)
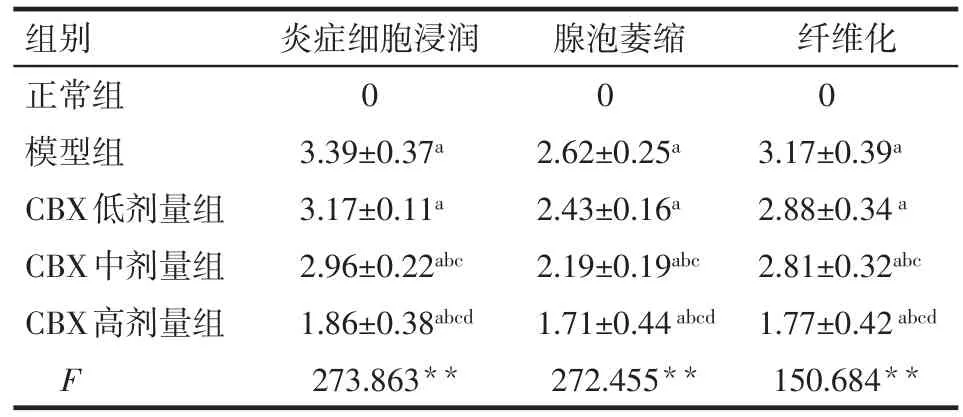
Tab.2 Comparison of histopathological scores of the pancreas between five groups表2 各组小鼠胰腺病理组织学评分比较(n=10,分,±s)
**P<0.01;a与正常组比较,b与模型组比较,c与CBX低剂量组比较,d与CBX中剂量组比较,P<0.05
组别正常组模型组CBX低剂量组CBX中剂量组CBX高剂量组F炎症细胞浸润0 3.39±0.37a 3.17±0.11a 2.96±0.22abc 1.86±0.38abcd 273.863**腺泡萎缩0 2.62±0.25a 2.43±0.16a 2.19±0.19abc 1.71±0.44abcd 272.455**纤维化0 3.17±0.39a 2.88±0.34a 2.81±0.32abc 1.77±0.42abcd 150.684**
2.2 CP小鼠胰腺组织eATP水平 与正常组相比,模型组eATP水平显著升高;与模型组相比,CBX中、高剂量组eATP水平有不同程度下降。见图2。
2.3 免疫荧光分析P2X7R、NLRP3、Caspase-1蛋白表达 与正常组相比,模型组P2X7R、NLRP3、Caspase-1平均光密度均显著升高(P<0.05);与模型组相比,CBX中、高剂量组P2X7R、NLRP3、Caspase-1平均光密度均有所下降(P<0.05),见表3、图3。
2.4 胰腺中P2X7R、NLRP3、Caspase-1和PAN-1mRNA表达 与正常组比较,模型组小鼠胰腺组织中P2X7R、NLRP3、Caspase-1、PAN-1 mRNA水平显著升高(P<0.05)。与模型组相比,CBX中、高剂量组P2X7R、NLRP3、Caspase-1、PAN-1 mRNA水平均下调,高剂量组低于中、低剂量组。见图4。
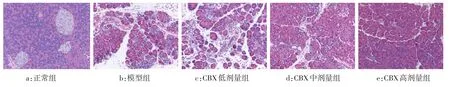
Fig.1 Pathological observation of chronic inflammatory injury and fibrosis of pancreas in five groups(HE,×200)图1 小鼠胰腺组织慢性炎性损伤及纤维化病理组织学观察(HE,×200)
Tab.3 Immunofluorescence quantitative analysis of P2X7R,NLRP3 and Caspase-1 in mouse pancreas表3 小鼠胰腺P2X7R、NLRP3、Caspase-1蛋白表达免疫荧光定量分析 (n=10,IOD,±s)
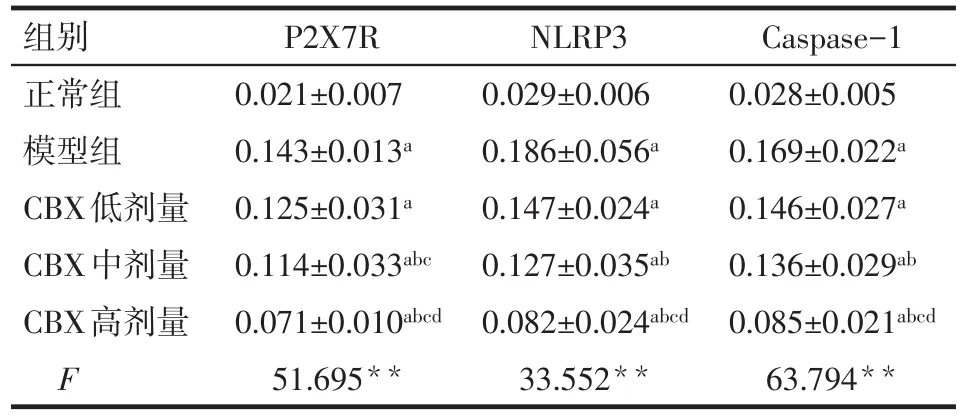
Tab.3 Immunofluorescence quantitative analysis of P2X7R,NLRP3 and Caspase-1 in mouse pancreas表3 小鼠胰腺P2X7R、NLRP3、Caspase-1蛋白表达免疫荧光定量分析 (n=10,IOD,±s)
**P<0.01;a与正常组比较,b与模型组比较,c与CBX低剂量组比较,d与CBX中剂量组比较,P<0.05
组别正常组模型组CBX低剂量CBX中剂量CBX高剂量F P2X7R 0.021±0.007 0.143±0.013a 0.125±0.031a 0.114±0.033abc 0.071±0.010abcd 51.695**NLRP3 0.029±0.006 0.186±0.056a 0.147±0.024a 0.127±0.035ab 0.082±0.024abcd 33.552**Caspase-1 0.028±0.005 0.169±0.022a 0.146±0.027a 0.136±0.029ab 0.085±0.021abcd 63.794**
3 讨论
3.1 eATP可作为DAMP分子在多种疾病中发挥重要作用 近年来,DAMP分子在炎症、组织修复中的作用备受关注。除了细胞内组分,如组蛋白、高迁移率族蛋白1外,细胞外组分eATP也已证明可作为DAMP分子通过旁分泌或自分泌途径介导细胞增殖、细胞毒性、炎症和细胞凋亡。
在正常生理条件下,eATP水平是各种细胞功能的基础,其稳态浓度为0~10 nmol/L。若其过度释放,则可引起大量的病理反应,对人类疾病产生影响,如eATP分子触发炎症级联信号传导及炎性小体的装配,在多种慢性炎症和纤维化疾病,如结肠炎、肺纤维化和肾纤维化发病机制中起重要作用[10]。有研究证实,当eATP浓度达到100 μmol/L或以上时,就会启动P2X7R的活化。P2X7R是由免疫细胞,特别是巨噬细胞特异性表达的,其活化可以诱导免疫细胞的生物活性,如增强吞噬作用、诱导炎症小体形成、提高促炎细胞因子的释放等。需要注意的是,eATP与P2X7R结合不仅可使非选择性阳离子通道开放,还可诱导质膜通透并形成半通道PAN-1,促进NLRP3炎性体装配。不仅如此,eATP也参与促进纤维化信号的传导。阻断eATP介导的嘌呤能信号传导,减少胶原合成,从而抑制或阻止纤维化进展。随着胰腺纤维化程度的加重及腺泡细胞的破坏,eATP水平迅速增加[11]。因此,eATP的动态监测可以作为评估胰腺纤维化程度的重要参考。
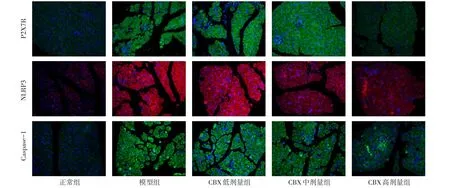
Fig.3 Immunofluorescence staining of P2X7R,NLRP3 and Caspase-1 in five groups(×200)图3 各组小鼠P2X7R、NLRP3、Caspase-1免疫荧光染色图(×200)
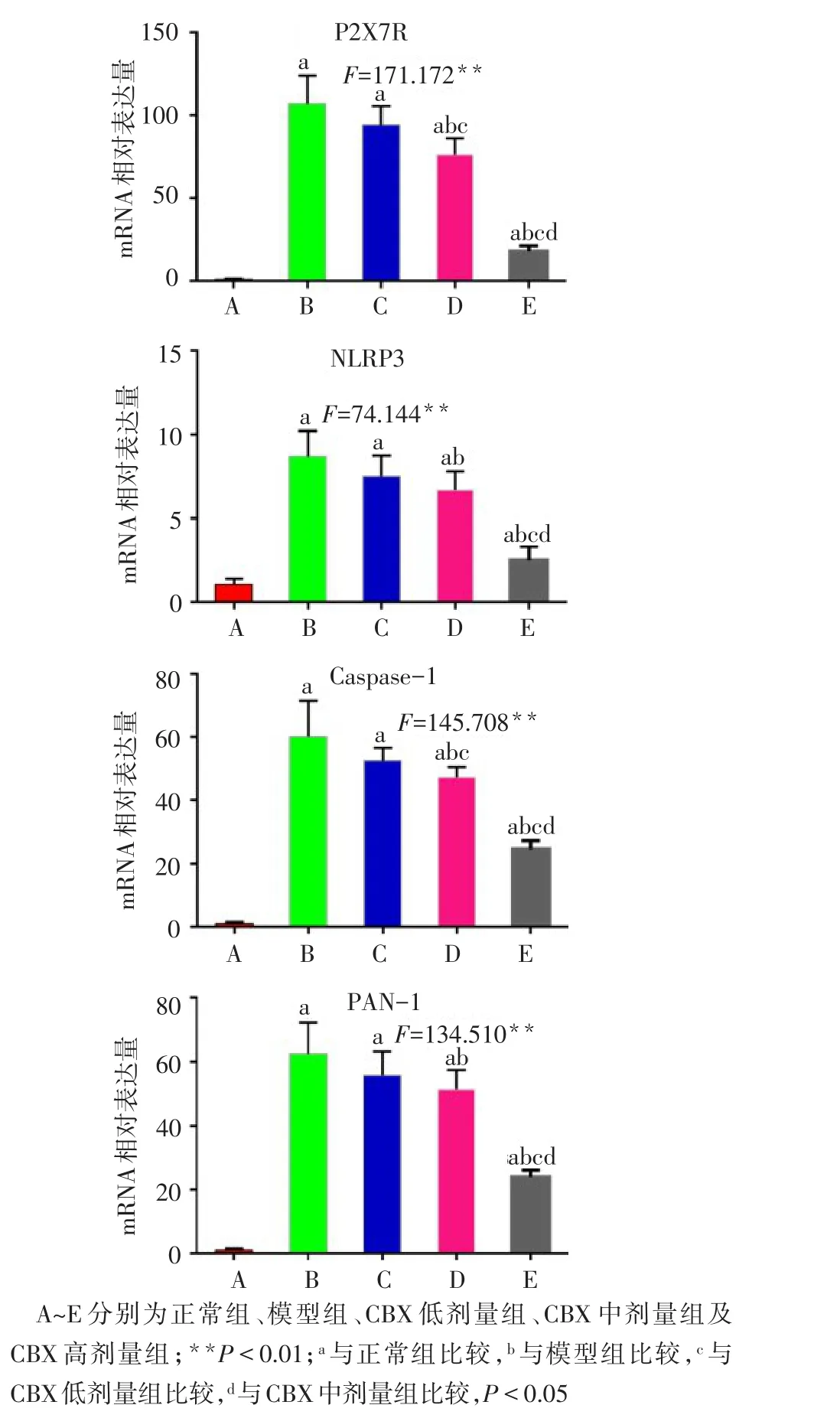
Fig.4 Comparison of the relative expressions of P2X7R,NLRP3,Caspase-1 and PAN-1 mRNA in pancreas between five groups of mice图4 各组小鼠胰腺组织中P2X7R、NLRP3、Caspase-1和PAN-1 mRNA相对表达量比较
3.2 CBX在炎症级联反应中的作用 PAN-1是缝隙连接蛋白家族的成员之一,可促进机械敏感性ATP和Ca2+信号释放。CBX是PAN-1的拮抗剂,中文别称为生胃酮,是一种传统的抗溃疡药。研究表明,CBX可通过刺激肾上腺或增加内源性皮质类固醇分泌而产生抗炎作用[12]。目前认为CBX是哺乳动物细胞系中最有效的PAN-1半通道抑制剂,可直接与缝隙连接通道结合,导致缝隙连接处的构象变化和半通道的闭合[13-14]。CBX可通过阻断eATP的释放,抑制eATP级联信号触发P2X7R反馈的K+外流,间接抑制NLRP3炎性体的组装。
3.3 NLRP3炎性体活化与CP纤维化的关系 NLRP3炎性体由NLRP3蛋白、凋亡相关斑点样蛋白(ASC)和Caspase-1前体组成。P2X7R介导NLRP3炎性体激活可活化Caspase-1,促进促炎因子白细胞介素(IL)-1β、IL-18的成熟和释放[15]。IL-1β、IL-18是重要的促炎细胞因子,它们参与驱动炎症反应及维持动态平衡。NLRP3也被认为是细胞失衡的传感器,其激活剂可造成广泛的组织损伤。
本研究中,采用雨蛙素反复注射刺激后,eATP浓度显著增加,而HE染色结果显示,模型组发生了明显的炎症及纤维化;免疫荧光染色结果证实P2X7R、NLRP3和Caspase-1的表达明显升高,表明小鼠纤维化变化与eATP-P2X7R-NLRP3信号途径中的eATP水平变化和PAN-1、P2X7R、NLRP3及Caspase-1蛋白表达变化趋势一致;在使用ATP拮抗剂CBX治疗后,各剂量组胰腺炎症和纤维化均减轻,表明拮抗剂CBX对NLRP3炎性体信号通路有抑制作用,提示eATP在CP及其纤维化进程中发挥了重要作用。
综上所述,CP是动态性、纤维性胰腺炎症疾病,胰腺纤维化是复发性胰腺损伤后重塑的结果,但CP纤维化在早期阶段是可逆的。eATP作为重要的DAMP分子,可通过促进NLRP3炎性体上游信号的激活,引起促炎因子的释放并参与CP胰腺纤维化进程,通过抑制PAN-1介导的ATP释放可显著抑制NLRP3炎性体的组装及胰腺纤维化,提示PAN-1抑制剂CBX可能在CP胰腺纤维化治疗中发挥作用。
(图1、3见插页)

