杜鹃兰种子快速萌发产生原球茎研究
王跃华, 陈 芳, 陈 燕, 高 妍, 杨 锋, 陈国豪
(1.成都大学药学与生物工程学院,四川 成都 610106; 2.成都列五中学,四川 成都 610007)
杜鹃兰(Cremastraappendiculata(D.Don)Makino)为兰科(Orchidaceae)多年生珍稀药用植物[1],主要分布于中国的贵州和四川。杜鹃兰植物以其假鳞茎入药,药材习称“山慈菇”;具有清热解毒、润肺止咳、活血止痛、消肿散结,内用可抗肝癌、乳腺癌、子宫癌等,外用治疮毒、蛇虫咬伤、皮肤烫伤等功效[2-4]。杜鹃兰自然贮存量极少,加之无计划的人为采挖,野生资源濒临枯竭。杜鹃兰作为兰科植物,其种子萌发首先是产生原球茎。但因杜鹃兰种胚发育不成熟、缺少胚乳和种皮透水透气性差等原因[5],从而造成其在自然条件下很难萌发;目前杜鹃兰在自然界主要依靠假鳞茎进行分株繁殖,但存在栽培成本高、效率低和难以开展大规模化推广种植等问题。为了解决杜鹃兰种苗严重短缺的瓶颈问题。本研究以杜鹃兰种子为材料,探讨了不同因素处理对其种子诱导原球茎的影响,成功获得了杜鹃兰植物原球茎诱导的最适条件,为实现杜鹃兰优质种苗的规模化生产奠定了基础。
1 材料与方法
1.1 材 料
杜鹃兰蒴果采于四川省雅安市天全县老场乡;经四川师范大学马丹炜教授鉴定为兰科(Orchidaceae)杜鹃兰属杜鹃兰(Cremastraappendiculata(D.Don.)Makino)植物的蒴果。
1.2 仪器与试剂
1.2.1仪器设备
SW-QJ-2 F超净工作台(苏州 安泰)、LDZX-75 KB高压蒸汽灭菌锅(上海 申安)、SMZ 161体式解剖镜(宁波 坤宁)等。
1.2.2实验试剂
B 5培养基、MS培养基、1/2 MS培养基、KC培养基、乙醇、无菌水、次氯酸钙(Ca(ClO)2)、0.1%氯化汞(升汞)、台盼兰染液。
1.3 方 法
1.3.1升汞消毒时间对杜鹃兰种子生长的影响
选取成熟未开裂的杜鹃兰蒴果,放在超净工作台上,先用70%乙醇擦拭蒴果表面3次后,用无菌手术刀纵向对半切开蒴果后取出种子置于无菌试剂瓶备用。
取杜鹃兰种子先用70%乙醇浸泡30 s后,再用0.1%升汞消毒不同时间,最后用无菌水清洗3次,按每瓶200粒左右的杜鹃兰种子数将其接入MS培养基中,轻轻摇晃培养基表面使杜鹃兰种子均匀散布在培养基上,培养7 d后观察杜鹃兰种子的染菌情况,并用台盼蓝染液对其培养的种子进行染色观察,计算出杜鹃兰种子的存活率。
1.3.2不同方式处理对杜鹃兰种子萌发产生原球茎的影响
采用L9(33)正交试验设计,以基本培养基类型(1/2 MS、B 5、KC)、Ca(ClO)2浸泡浓度(0、3.0%、5.0%)和浸泡温度(15、25、50 ℃)为3个因素,每个因素各设3个水平,研究基本培养基类型、Ca(ClO)2浸泡浓度和浸泡温度对杜鹃兰种子原球茎诱导的影响,具体试验设计见表1。
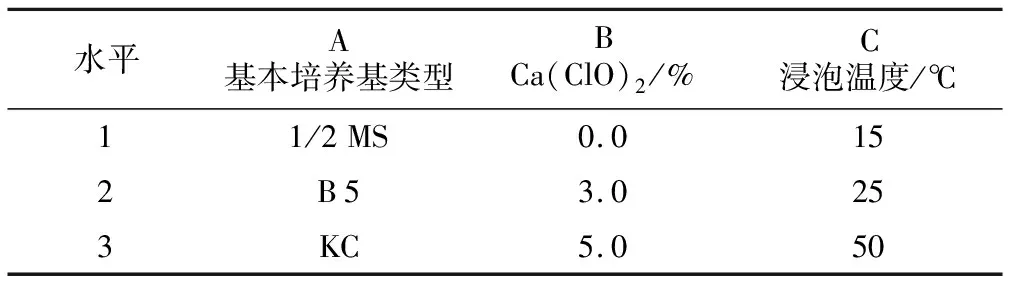
表1 L9(33)原球茎诱导因素水平
1.3.3不同激素配比对杜鹃兰原球茎诱导的影响
将消毒后的杜鹃兰种子放在50 ℃的3.0% Ca(ClO)2溶液中处理30 min后,接种到添加有不同激素配比的B 5培养基中,培养60 d后统计杜鹃兰种子产生原球茎诱导率。
1.3.4培养室条件
温度设置为20 ℃、光照强度为1 800 lx、每天光照12 h。
1.3.5数据处理
本试验设计与数据处理采用Excel 2010软件与正交助手Ⅱ软件完成。
存活率(%)=(未染色种子数/接种种子数)×100%;
染菌率(%)=(染菌种子瓶数/接种种子瓶数)×100%;
原球茎诱导率(%)=(诱导出原球茎种子数/接种种子数)×100%。
2 结果与分析
2.1 不同升汞消毒时间对杜鹃兰种子生长的影响
杜鹃兰种子采用0.1% 升汞消毒不同时间后,接入MS培养基中培养7 d,实验统计结果见表2。
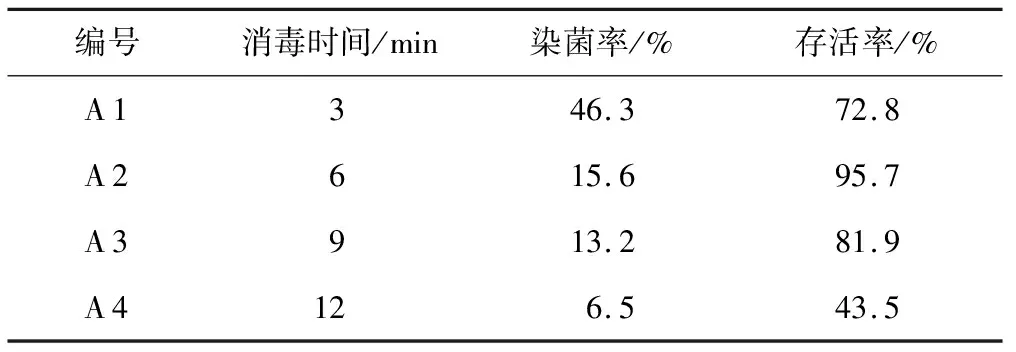
表2 不同消毒时间对杜鹃兰种子生长的影响
由表2可以看出,随着升汞消毒时间由A 1的3 min逐渐延长到A 4的12 min,杜鹃兰种子的染菌率呈逐渐下降的趋势;具体表现在当升汞消毒时间A 1采用3 min时,其杜鹃兰种子染菌率最高,为46.3%,而此时杜鹃兰种子的存活率为72.8 %,观察发现培养的部分种子因染菌而出现了死亡。当升汞消毒时间继续延长到12 min时,尽管此时杜鹃兰种子的染菌率最低(6.5%),但其种子的存活率也是最低(43.5%);通过台盼蓝染色观察发现,杜鹃兰种子长时间的用升汞消毒处理后,会造成其种子细胞因中毒而死亡。综合考虑升汞消毒时间与杜鹃兰种子的染菌率与存活率之间的关系可以得出,A 2当升汞消毒时间采用6 min时,其杜鹃兰种子的染菌率较低(15.6 %),而此时种子的存活率却是最高(95.7%);因此0.1%升汞消毒杜鹃兰种子的最佳时间是6 min。
2.2 不同因素处理对杜鹃兰种子萌发产生原球茎的影响
根据正交试验设计,将杜鹃兰种子用不同温度和浓度的Ca(ClO)2溶液浸泡30 min后,接入不同类型的基本培养基中,培养60 d后观察并记录原球茎诱导情况,实验结果见表3和表4。
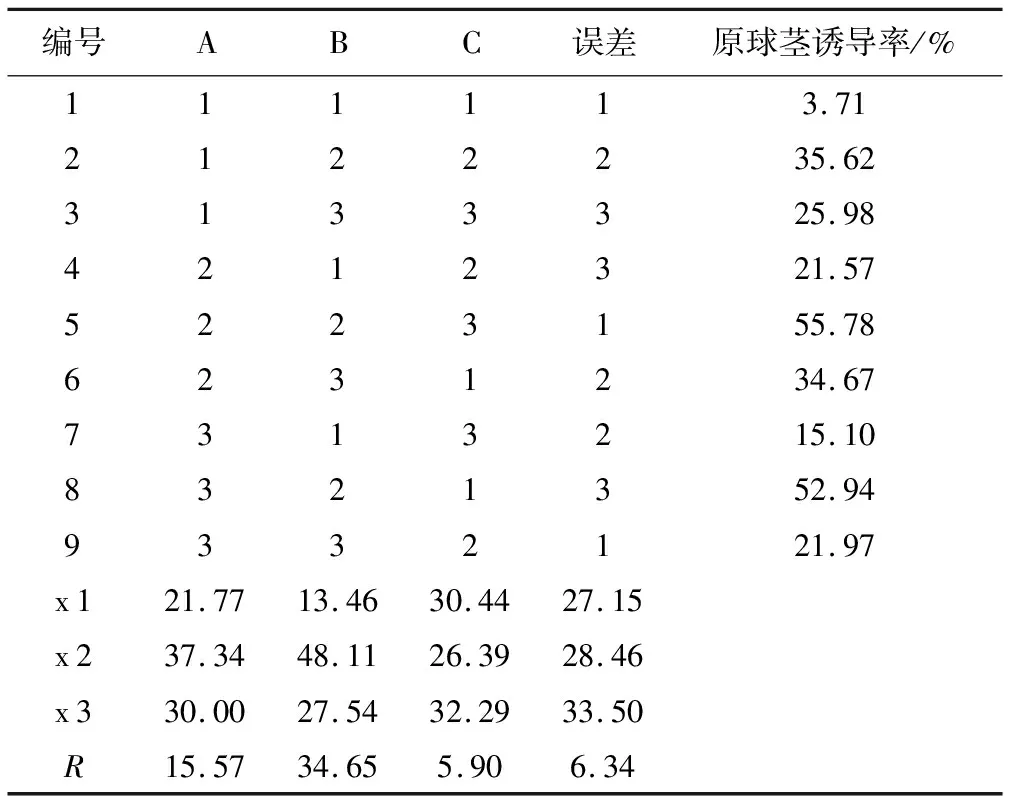
表3 L9(33)正交试验设计与结果统计
由表3可知,以杜鹃兰种子为材料,原球茎诱导率最高的是5号组合A 2 B 2 C 3,即种子在50 ℃的3.0% Ca(ClO)2溶液中浸泡30 min后转接入B 5基本培养基中,培养60 d后原球茎诱导率可达55.78%。通过极差分析可知,3个因素对杜鹃兰种子原球茎诱导的影响程度依次为B>A>C,即Ca(ClO)2溶液浓度影响最大,基本培养基次之,影响最小的是浸泡温度。
通过实验发现,将种子用50 ℃、3.0%Ca(ClO)2预处理30 min后,接入B 5培养基中进行培养30 d,在解剖镜下观察,种皮已变得透明,种胚体积也明显增大并开始突破种皮,形成半透明椭圆形原球茎;在培养50 d后,观察发现形成的原球茎体积进一步增大,颜色也变为白色或黄白色、质地紧密。研究中还发现有大量未经Ca(ClO)2预处理的种子种胚膨大后无法突破种皮,颜色逐渐变为褐色后死亡。
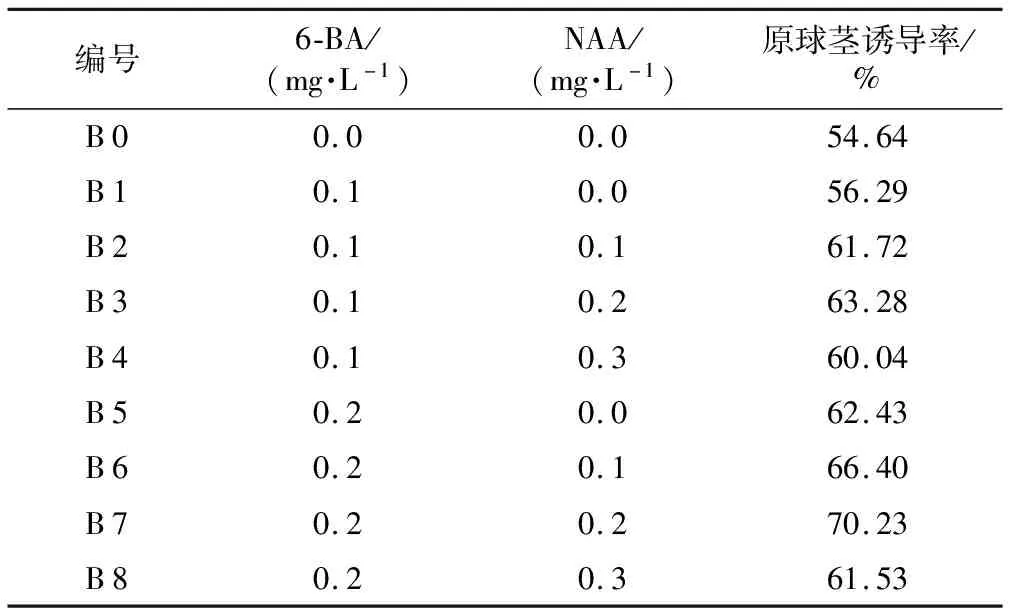
由表4可知,3个因素中仅因素B达到显著水平,因素Ca(ClO)2浓度检验值F=27.08,F0.05= 19.00,F0.01= 99.00,检验值F0.05 表4 方差分析 将消毒后的杜鹃兰种子,接入以B 5为基本培养基,并附加6-BA与NAA不同激素配比的表5培养基中,培养60 d后统计杜鹃兰种子原球茎的诱导率。 从表5实验结果可以看出,B 0编号的杜鹃兰种子在没有添加任何激素的B 5基本培养基上生长,其杜鹃兰种子的原球茎诱导率最低(54.64%),由此说明一定种类的激素配比有利于杜鹃兰种子萌发产生原球茎。第1组(编号B 1~B 4)在6-BA保持0.1 mg·L-1不变的情况下,随着NAA浓度由0到0.3 mg·L-1逐渐升高,其原球茎的诱导率呈出先升高后降低的变化过程,其中以编号B 3的原球茎诱导率为最高(63.28%);第2组(编号B 5~B 8)在6-BA保持0.2 mg·L-1不变的情况下,随着NAA浓度由0到0.3mg·L-1逐渐升高,其原球茎的诱导率也呈先升高后降低的变化过程,其中以编号B 7的原球茎诱导率为最高(70.23%);进一步分析第1组编号B 3和第2组编号B 7又可以发现,在NAA 0.2 mg·L-1保持不变的情况下,随着培养基中6-BA浓度由 0.1 mg·L-1上升到0.2 mg·L-1,其杜鹃兰种子的原球茎诱导率也呈现出升高的趋势,即由63.28%上升提高到70.23%。 表5 不同6-BA和NAA浓度配比对杜鹃兰种子萌发产生原球茎的影响 本试验从多个方面研究了影响杜鹃兰种子萌发产生原球茎的因素,成功获得了诱导杜鹃兰种子萌发产生原球茎的最佳培养条件。杜鹃兰种子具有休眠特性,在种子萌发过程中,多数停滞于不吸胀或者吸胀后胚增大却未能突破种皮阶段;杜鹃兰种子很难突破种皮的原因主要与外种皮的机械阻力和内种皮透气透水性差有关[6];大量研究表明,杜鹃兰种子种皮厚,不亲水和不利于种子吸收养分,是造成其种子休眠的主要原因[7-8]。段金玉等研究发现,剪破种皮和氢氧化钠处理可促进兰属植物种子的萌发[9];田梅生等在四季兰种子萌发的研究中发现,将四季兰种皮剪破后,种子萌发率高于未剪破种皮的实验组的3倍左右[10];由此说明在兰科植物种子萌发过程中,适当处理其种皮对种子萌发有至关重要的作用。 本研究针对性地采用一定浓度的次氯酸钙试剂处理杜鹃兰种子,起到了软化种皮,使得水分能顺利渗透入种子细胞中,确保了细胞内的物质代谢进行[11-12],从而很好地实现种子的快速萌发。 不同植物激素配比对其细胞的分裂和分化都起到非常重要的作用。田莉等研究发现,添加适宜浓度的NAA可以促进杜鹃兰种子形成早期胚轴,发育速度也可加快[13]。本研究采用一定浓度的6-BA和NAA组合,显著地促进了杜鹃兰种子萌发产生原球茎,为进一步大规模快速生产杜鹃兰种苗提供了一条新途径。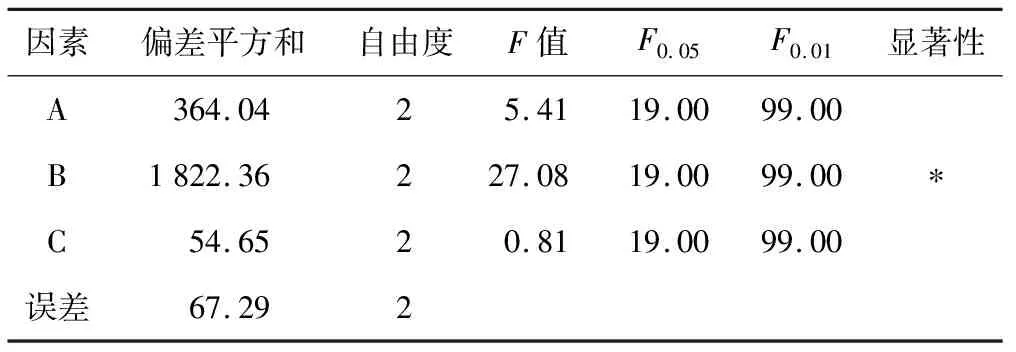
2.3 不同激素配比对杜鹃兰种子萌发产生原球茎的影响
3 结果与讨论

