基于核酸碱基猝灭荧光团的核酸适配体传感器检测赭曲霉毒素A
曲 瑶 张亚旗 肖 光 杨 成
(大连理工大学化工学院化学系, 精细化工国家重点实验室, 大连 116024)
1 引 言
赭曲霉毒素A(OTA)是由青霉菌属和曲霉菌属次级代谢产生的一种霉菌毒素,广泛存在于谷物、咖啡、可可、葡萄酒及果汁等食品中。OTA具有肾毒性、肝毒性、可导致DNA损伤以及抑制RNA和蛋白质合成等危害,具有致畸、致癌、致突变作用[1]。国际癌症研究机构(IARC)将OTA列为2B类致癌物质,已有100多个国家对食品和动物饲料中OTA作出了限量规定,我国国标GB2761-2017[2]规定,谷物及其研磨加工品、豆类及其制品、坚果及籽类、烘焙咖啡豆中不得超过5 μg/kg,速溶咖啡中不超过10 μg/kg, 而葡萄酒中不超过2 μg/kg。由于OTA毒性高、分布广、危害大,因此建立简单、快速、低成本、高灵敏的检测方法是实现OTA监管的有效手段。在OTA的检测方法中,高效液相色谱-荧光/质谱检测方法,具有灵敏度高、重现性好的特点,是国家标准建议的方法,但对实验人员的操作技能和仪器设备要求较高,且检测成本较高,无法满足现场快速检测的要求[3,4]。酶联免疫方法[5]因其检测通量高、检测速度快,被广泛应用于OTA的检测,但在实际操作过程中,需要使用有毒标准样品,对检测人员及环境存在潜在危害。免疫试纸条也被广泛应用于现场快速检测[6],但由于OTA是有毒小分子(MW=403.8),免疫原性低、抗体研制难度大,限制了免疫试纸条的发展。
近年出现的核酸适配体传感方法为OTA快速检测提供了新的解决方案。核酸适配体是通过指数富集配体系统进化技术(SELEX)在体外筛选出来的能够特异性结合目标配体的寡聚核苷酸片段[7]。核酸适配体有可化学合成、稳定性好、易修饰、靶分子范围广等优点,基于核酸适配体的生物传感器成为近年来的研究热点[8,9]。基于核酸适配体用于OTA检测的传感器有比色型[10]、荧光型[11]、电化学型[12]和化学发光型[13,14]等。相较于免疫型传感器,核酸适配体传感器具有以下优点:首先,核酸适配体与OTA结合前后,核酸适配体的空间结构发生了显著的变化,这为以空间结构变化为传感响应的传感器设计提供了可能; 其次,核酸适配体的互补寡聚核酸探针短链是靶标分子的天然竞争物,可避免使用有毒OTA标记物为竞争物,环境友好。
荧光生物传感器依赖于荧光信号的变化,如荧光增强、荧光猝灭、荧光偏振等实现目标物的检测。SYBR Green I (SGI)是常见的非标记荧光染料,与双链DNA结合后,荧光信号可增强800~1000倍,且与双链DNA的量正相关。由于SGI没有选择性,与双链DNA结合使得检测背景信号较高[15]。偏振荧光的强弱程度与荧光团所连接的分子大小呈正相关,与其受激发时转动的速度呈负相关, 所以荧光偏振技术也常用于检测小分子的核酸适配体生物传感器[16,17]。偏振荧光的检测对于仪器设备的要求比较高,更适用于实验室的科学研究。荧光猝灭是常用的荧光传感模式,从猝灭机理上可分为静态猝灭和动态猝灭。静态猝灭是猝灭剂与基态荧光团形成配合物,导致的荧光猝灭。动态猝灭是猝灭剂影响荧光团的激发态,包括共振能量转移和光诱导电子转移(PET)。基于核酸的共振能量转移,需共价连接有机荧光猝灭团,常见的荧光淬灭基团如BHQ(Black hole quencher),其猝灭效率高,但是修饰成本较高。最近的研究发现,纳米金球[18]、碳纳米管[19]、石墨烯[20]和MoS2[21]等纳米材料可通过非特异性吸附,基于PET机理猝灭标记在核酸上的荧光团。以纳米材料为猝灭剂可大大降低使用成本,但由于是非特异性吸附,所以选择性较差。
鸟嘌呤是具有多个给电子基团的稠杂环化合物,电子密度较大,可作为电子供体。研究表明,鸟嘌呤在核酸的5种碱基中氧化电位最低[22],具有较高的HOMO (Highest occupied molecular orbital, 最高占据分子轨道)能级,最易被氧化。当荧光团被激发,荧光团的电子被激发到LUMO (Lowest unoccupied molecular orbital,最低未占分子轨道) 能级,鸟嘌呤的电子可通过电子转移到荧光团的HOMO轨道上,使处于激发态的荧光基团电子无法恢复到基态,导致荧光猝灭,即鸟嘌呤通过PET机理实现对荧光基团的猝灭[23-25]。荧光基团可修饰在寡聚核酸探针短链上,因此可以提高系统的选择性。Xiang[26]等报道了一种基于鸟嘌呤可猝灭FAM和TAMRA(5-羧基四甲基罗丹明)的荧光方法,通过同步荧光法,实现两组单核苷酸多态性(SNP)同时分析。基于碱基猝灭荧光策略构建传感器,避免了标记猝灭基团,检测过程简单,选择性好,检测成本低。
OTA的核酸适配体富含鸟嘌呤,是理想的FAM猝灭序列。基于鸟嘌呤可通过PET过程猝灭FAM的荧光,本研究构建了OTA的核酸适配体传感器。当体系中不存在OTA时,修饰有FAM的寡聚核酸探针短链与OTA核酸适配体杂交,FAM靠近鸟嘌呤,发生PET过程使得荧光被猝灭。而当OTA存在时,OTA与核酸适配体结合,且诱导其形成刚性的反平行G-四链体结构[27],抑制了FAM修饰探针DNA与OTA核酸适配体杂交,因此FAM得以发射荧光。通过测定体系荧光强度恢复率,实现对OTA的检测。
2 实验部分
2.1 仪器与试剂
PTC-150 PCR扩增仪(美国 MJ. Research. INC); XH-C漩涡混合器(金坛市白塔新宝仪器厂); XK96-3微量振荡器(江苏新康医疗器械有限公司); D1008E低速小型离心机(江苏新康医疗器械有限公司)、ReadMax 1900光吸收型全波长酶标仪(上海闪谱生物科技有限公司); Infinite 200Pro 多功能酶标仪(瑞士Tecan 公司); FE-20 pH计(梅特勒-托利多仪器(上海)有限公司); Mili-Q超纯水系统(美国 Milipore公司); WHB-96-02 96孔全黑微孔板(上海卧宏生物科技有限公司)。
NaCl、MgCl2、CaCl2和NaOH(分析纯,国药集团化学试剂有限公司); 三羟甲基氨基甲烷(Tris,纯度>99.0%,BBI Life Sciences); OTA、赭曲霉素B(OTB)、Warfarin(分析纯 Sigma-Aldrich公司)。实验用水为超纯水。红葡萄酒购于本地超市。核酸适配体和荧光标记寡聚核酸探针序列(FAM-DNA)购自生工生物工程(上海)股份有限公司,序列见表1,用超纯水配制成100 μmol/L母液。
2.2 Ga2+浓度优化
检测液为10 mmol/L Tris-HCl缓冲溶液(pH 8.4),含20 nmol/L 核酸适配体、120 mmol/L NaCl。将检测液分为不加OTA和加入100 nmol/L OTA两组。 将两组溶液分别加入到96孔全黑微孔板中,在微孔中分别加入不同浓度的CaCl2孵育15 min; 各孔中加入10 μL 200 nmol/L FAM-DNA溶液,混合均匀,常温孵育5 min。使用Infinite 200Pro多功能酶标仪记录荧光响应值,激发波长488 nm,发射波长525 nm。
2.3 OTA的定量检测
基于鸟嘌呤猝灭单标记FAM的OTA荧光检测过程如下:核酸适配体用超纯水配制成100 μmol/L母液,母液加热到95℃,保持5 min,然后快速降温到4℃,保持2.5 min,备用。用100 mmol/L Tris-HCl缓冲溶液(pH 8.4)配制含有200 nmol/L 核酸适配体、1.2 mol/L NaCl、100 mmol/L CaCl2的检测液。将待测样品80 μL加入到96孔全黑微孔板中的孔中,再加入10 μL检测液,混匀,反应15 min; 各孔中加入10 μL 200 nmol/L FAM-DNA溶液,定温孵育5 min。使用Infinite 200Pro多功能酶标仪(激发波长488 nm,发射波长525 nm)记录荧光响应值。定义荧光恢复率R(%)=(Fx-F0)/F0×100%,其中,Fx是样品的荧光强度,F0是空白样品的荧光强度。本研究中所有实验均平行测试5次。
2.4 实际红葡萄酒样品分析
根据OTA的物理化学性质,采用文献[28]中双液液萃取方案并稍作改进进行红葡萄酒的前处理。取10 mL红酒样品,加入等体积的甲苯,混合均匀,离心分层。取顶层有机相,加入等体积的Tris-HCl缓冲溶液(pH 8.4),混合均匀,离心分层。抽取底层水相,调至pH 3.0,加入等体积的二氯甲烷,均匀混合,离心分层。抽取底层有机相,加入等体积的Tris-HCl缓冲溶液(pH 8.4),混合均匀,离心分层。从顶层水相中抽取萃取后不含有红酒基质的待测液,用于后续的分析检测。
标准添加实验中,分别取10 mL红酒样品,加入甲醇稀释的10mol/L OTA标准溶液 1、2、4和8L(OTA终浓度分别为1、2、4和8 nmol/L),混匀,按照上述样品处理方法制备待测样品,并进行检测,计算回收率。
3 结果与讨论
3.1 实验原理
本研究构建了一种基于鸟嘌呤猝灭FAM单标记的荧光核酸适配体传感器,用于检测OTA,检测原理如图1所示。根据PET机理,鸟嘌呤可猝灭FAM的荧光,OTA的核酸适配体富含鸟嘌呤,是比较理想的FAM猝灭序列。体系中没有OTA时,FAM-DNA探针与核酸适配体杂交,FAM由于靠近鸟嘌呤发生PET,荧光被猝灭。随着OTA的加入,OTA与核酸适配体特异性结合,OTA诱导核酸适配体形成刚性的反平行G四链体结构[27],抑制了FAM-DNA与核酸适配体的杂交,FAM远离鸟嘌呤,抑制PET过程,所以FAM的荧光强度逐渐恢复,通过FAM荧光强度的恢复率实现对OTA的测定。
3.2 Ca2+浓度的选择
二价阳离子,如Ca2+或Mg2+,对于核酸适配体识别OTA具有至关重要的作用[17],特别是Ca2+的影响较大。不同浓度Ca2+对检测结果的影响如图2A所示。OTA不存在时,由于核酸的磷酸骨架带有大量的负电荷,溶液中的核酸链互相排斥。阳离子有屏蔽电荷的作用,特别是二价阳离子的屏蔽作用更强,因此,随着Ca2+浓度增加,核酸适配体与FAM-DNA的杂交效率提高,FAM靠近互补链上的鸟嘌呤,发生PET,FAM的荧光被鸟嘌呤猝灭。OTA存在时,由于Ca2+促进OTA诱导核酸适配体形成反平行G-四链体结构,抑制核酸适配体与FAM-DNA探针的杂交。而不存在Ca2+时,核酸适配体不能识别OTA。当Ca2+浓度低于5 mmol/L时,随着Ca2+浓度增加,荧光信号增强,也进一步证明Ca2+对于核酸适配体识别OTA的作用。加入不同浓度Ca2+时的荧光恢复率如图2B所示,Ca2+浓度在6.0~25 mmol/L范围内的荧光恢复率较高。在后续实验中加入10 mmol/L Ca2+。
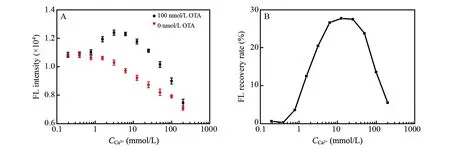
图2 (A)不同浓度Ca2+存在时检测的荧光响应值; (B)不同浓度Ca2+存在时的荧光恢复率Fig.2 (A) Fluorescence intensity with different concentrations of Ca2+ in the absence and presence of OTA; (B) FL recovery rates with different concentrations of Ca2+
3.3 单标记荧光核酸探针的优化
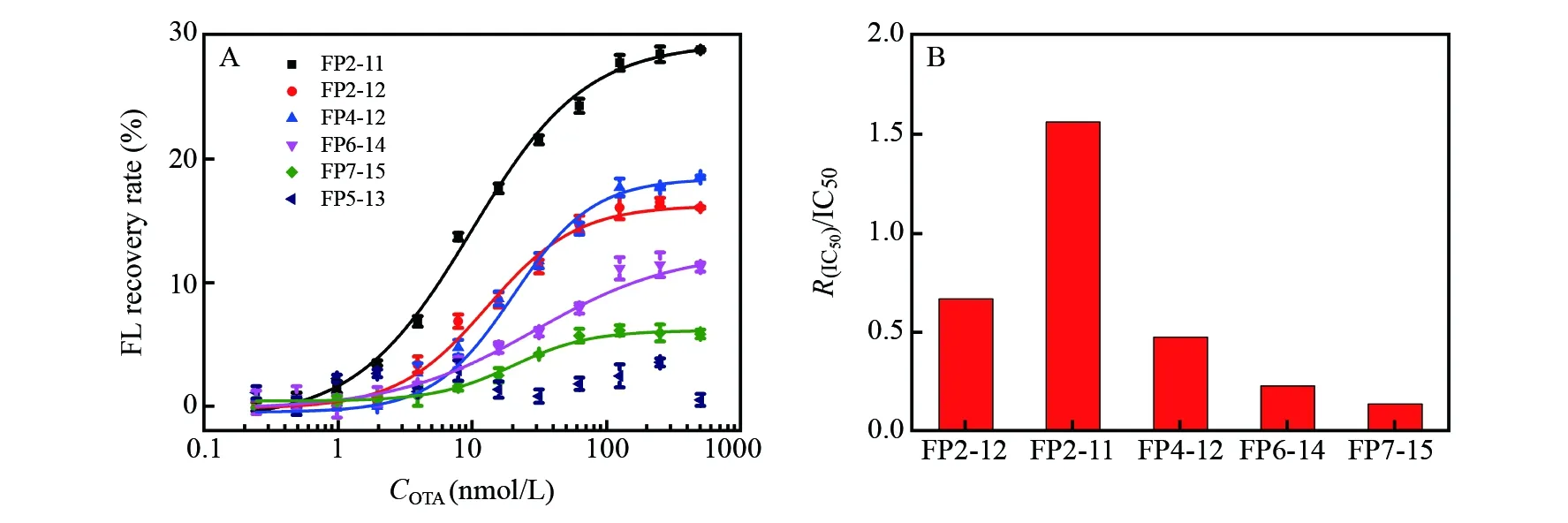
图3 (A)OTA适配体加入不同FAM-DNA链时,在不同OTA浓度下的荧光强度恢复率; (B)OTA适配体加入不同FAM-DNA链时的R(IC50)/IC50值Fig.3 (A) Recovery rate with different concentrations of OTA under the condition of aptamer of OTA binding with 6 different FAM-DNA sequences; (B) Value of R(IC50)/IC50 with different FAM-DNA sequences
本传感器中,FAM-DNA和OTA竞争与核酸适配体进行杂交,其中鸟嘌呤碱基和荧光团之间的相对位置、FAM-DNA的碱基数会影响两者之间的亲和性及猝灭效率,进而影响OTA的检测。考察了鸟嘌呤和FAM的相对位置对传感器的影响,共设计了6条FAM-DNA探针,如表1所示。其中FP4-12、FP5-13、FP6-14、FP7-15与核酸适配体有9个互补的碱基。FP5-13与适配体结合后,FAM与T-14碱基靠近,并未出现荧光猝灭,表明仅有核酸链杂交,FAM并未靠近未杂交鸟嘌呤,不发生荧光猝灭; 而其它3条FAM-DNA均表现出不同程度的荧光猝灭现象,其中FP4-12的响应效果最好。进一步考察了FAM-DNA碱基数对传感器的影响, FP2-12与核酸适配体有11个互补碱基, FP2-11与核酸适配体有10个互补碱基。不同OTA浓度下使用不同FAM-DNA获得的荧光强度恢复率如图3A所示。为评价传感器的综合性能,以R(IC50)/IC50为传感器的灵敏度,其中,IC50为OTA的半抑制浓度,R(IC50)为IC50时的荧光强度恢复率。图3B为采用不同FAM-DNA传感器的灵敏度R(IC50)/IC50,其中以FP2-11为FAM-DNA传感器灵敏度最高,而FP2-12与FP4-12的灵敏度相近,但远低于FP2-11。
3.4 选择性
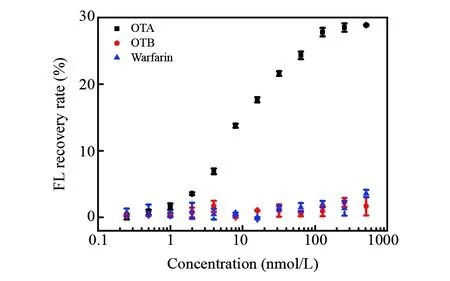
图4 荧光强度恢复率随OTA、OTB、Warfarin浓度变化曲线Fig.4 FL recovery rate of different concentrations of OTA, OTB and Warfarin
考察了OTB和Warfarin对检测OTA的干扰情况。OTB在分子结构上仅比OTA少一个氯原子,单克隆抗体对OTA的响应仅是OTB的3倍,多克隆抗体对于OTA、OTB的识别差别仅为20%[29]; Warfarin的分子结构与OTA的相似,在免疫传感器中常被用作干扰分子。如图4所示,OTA的荧光强度恢复率明显高于OTB和Warfarin,表明本方法选择性良好。
3.5 核酸适配体传感器检测OTA
在最佳条件下(10 mmol/L Ca2+、20 nmol/L Ap-OTA、20 nmol/L FP2-11、10 mmol/L Tris-HCl缓冲溶液、pH=8.4)考察了OTA浓度与荧光强度恢复率之间的关系。如图5所示,OTA浓度在0.67~7.80 nmol/L范围内与荧光强度恢复率呈良好线性关系,校正曲线方程为R(%)=-0.02+1.76COTA(nmol/L)(R2=0.9996,n=5),检出限为0.67 nmol/L (S/N=3)。按照2.4节中前处理方法处理红葡萄酒样品,利用本方法检测红葡萄酒中OTA, 检出限为0.27 μg/kg。

图5 (A) 荧光强度恢复率随OTA浓度变化曲线; (B) OTA浓度与荧光强度恢复率之间线性曲线Fig.5 (A) FL recovery rate versus different concentrations of OTA; (B) Linear curve of concentration of OTA and FL recovery rate
与基于不同猝灭剂检测OTA的分析方法相比(表2),以纳米金、单壁碳纳米管、氧化石墨烯、MoS2等纳米材料为猝灭剂比鸟嘌呤的猝灭效率更高,但是由于纳米材料与核酸适配体是非特异性的相互作用,导致这些方法的检出限较高。而本方法以鸟嘌呤为FAM猝灭剂,荧光标记的寡聚核酸探针与核酸适配体特异性识别,FAM被选择性猝灭。因此,本方法选择性更好,检出限更低。
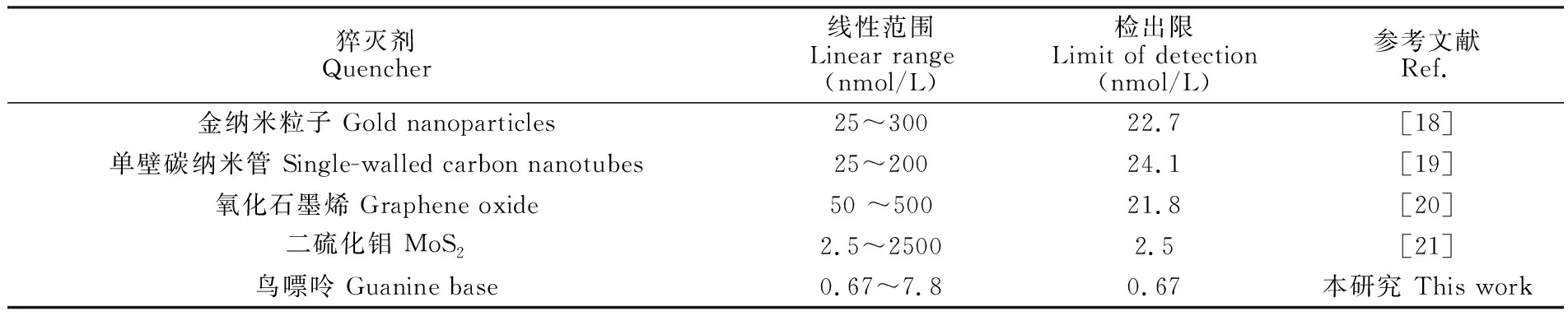
表2 基于不同猝灭剂的分析方法检测OTA的性能比较
3.6 红葡萄酒酒样品中OTA的检测
将市售红葡萄酒按照2.4节的方法进行前处理,采用本方法进行测定(见表3), 红葡萄酒中未检出OTA,4个加标水平下OTA的加标回收率为92.4%~100.9%,表明本方法准确性良好,可用于红葡萄酒中OTA的检测。
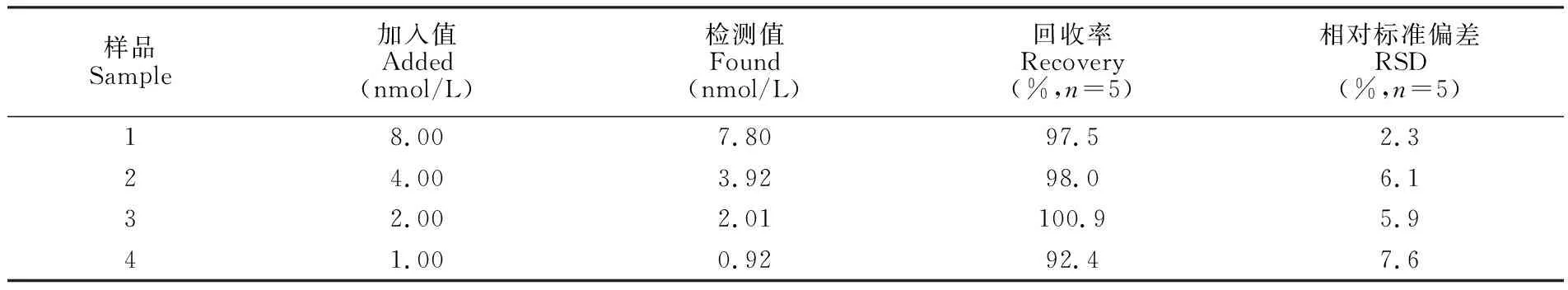
表3 红葡萄酒中OTA加标回收实验结果 (n=5)
4 结 论
以鸟嘌呤为猝灭剂,基于PET机理猝灭荧光素的荧光, 构建了基于鸟嘌呤猝灭单标记荧光的OTA核酸适配体传感器。本传感器的线性检测范围为0.67~7.80 nmol/L,检出限为0.67 nmol/L (S/N=3),对应于红葡萄酒中的检出限为0.27 μg/kg,可以满足国标对红葡萄酒中OTA的最高限量(2 μg/kg)的检测要求。相较于以纳米材料为猝灭剂的传感方法,本方法的检出限更低,并具有操作简单快速、灵敏度高、选择性好、成本低等优点。

