基于聚集诱导发光分子的免标记癌胚抗原生物传感新方法研究
李海银 常加富 吕文欣 李 峰
(青岛农业大学化学与药学院, 青岛 266109)
1 引 言
近年来,大量研究表明,癌胚抗原(CEA)的表达与肺癌、乳腺癌、结直肠癌等众多疾病相关,被认为是具有临床诊断价值的肿瘤标志物之一[1,2]。灵敏与准确检测生物体内CEA的表达对相关疾病的早期诊断与有效治疗具有重要的研究价值与现实意义。但是,生物体内CEA的检测存在表达水平低、干扰物质多等难点,对发展新型高性能的CEA传感器提出了更严格的要求。目前,比色法[3,4]、化学发光法[5,6]、荧光法[7,8]、电化学方法[9,10]、拉曼光谱法[11,12]等技术均已被用于构建CEA传感器,其中,荧光法因具有简单、快速、灵敏等优点而备受关注,被认为是实现生物体内CEA灵敏与准确检测的理想手段。然而,目前报道的CEA荧光生物传感器面临很多因素限制:(1)信号单元多为罗丹明、荧光素、青色素、金属簇等[13~15],稳定性不佳、发光效率低、抗光学漂白性不强,存在严重的聚集诱导淬灭效应; (2)大多数信号分子均需标记[16,17],该过程需要严格控制实验条件,耗时、费力、复杂、繁琐,导致探针的构建成本高; (3)碳点与量子点虽可作为信号源实现CEA的免标记荧光检测[18,19],但碳点的低发光效率与弱稳定性、量子点的高毒性严重限制了其在CEA免标记检测中的广泛应用。因此,设计高性能的新型信号分子、发展新型免标记的分析策略,对构建用于检测生物体内CEA的传感平台具有重要意义。
聚集诱导发光(AIE)材料,稀溶液时不发光,聚集态下强烈发光,易于化学修饰剪裁,具有较强的抗光学漂白能力和较高的荧光量子产率,广泛应用于有机电致化学发光[20]、细胞成像[21]、肿瘤治疗[22]、分析传感检测[23]等方面,并取得了一系列重要的研究成果。发展以AIE材料作为信号分子的生物传感平台有望解决传统荧光信号分子性能低的关键技术难题,极大地提高检测灵敏度、选择性与准确性,受到了研究者的广泛关注。Lu等[24]以AIE材料作为信号源制备了用于检测K+的荧光探针,并进一步将其用于细胞内K+的原位成像; Zhuang等[25]设计并合成了阳离子AIE染料TPE-Py,基于目标物延长端粒的特性,实现了端粒酶的灵敏、特异性检测与细胞内原位成像。文献报道的设计策略主要有两种:AIE分子与核酸链的化学标记、阳离子AIE染料与核酸链的静电吸附。利用静电吸附策略虽可解决标记的难题,但阳离子AIE染料稳定性差,易受到生物体内阴离子的干扰,降低检测的准确度。目前,基于AIE材料构建用于CEA分析检测的传感平台未见有文献报道。
本研究以弱发光的马来酰亚胺功能化的四苯乙烯(TPE-M)作为信号源,基于酶辅助的循环放大反应,在L-半胱氨酸(L-Cys)存在下,实现了CEA的免标记、高灵敏荧光检测。L-Cys与TPE-M反应,促使其荧光增强。目标物CEA识别发夹HP,改变其构型,进一步引发聚合酶与内切酶辅助的循环放大反应,生成大量Hemin/G-四链体,可催化氧化L-Cys变成胱氨酸(Cys-cys),而Cys-cys无法与TPE-M反应点亮其荧光。利用CEA加入前后,溶液中不同浓度的L-Cys与TPE-M反应导致的荧光强度的变化,实现体系中目标物的免标记、高灵敏检测。本研究将AIE材料集成于免标记检测CEA的生物传感平台中,方法简单、快速、灵敏,具有重要的实际应用价值。
2 实验部分
2.1 仪器与试剂
F-4600荧光光谱仪(日本日立公司); Gel Doc XR + 凝胶成像系统(美国伯乐公司)。
Klenow fragment聚合酶(KF聚合酶)、单核苷酸(dNTPs)、RNase抑制剂与三(羟甲基)甲基氨基甲烷(Tris)均购自生工生物工程(上海)股份有限公司。癌胚抗原(CEA)及其干扰物(上海领潮生物科技有限公司); 核酸切割酶Nt.BbvCl(美国新英格兰生物实验室); 其它试剂购自上海安耐吉化学公司。Tris-HCl缓冲溶液(pH 8.0,含有10 mmol/L Tris、50 mmol/L NaCl、10 mmol/L MgCl2)与1.0 mmol/L二硫苏糖醇,用于本实验中DNA溶液的配制。信号分子TPE-M参考文献[26,27]报道的方法合成,溶于乙腈,制备成浓度为400 μmol/L 的溶液。实验中所用的核酸片段由生工生物工程(上海)股份有限公司合成,序列见表1。

表1 本实验所用核酸序列
2.2 CEA的免标记荧光检测
将HP溶液在95℃孵育5 min,自然冷却至室温,备用。50 μL含有400 nmol/L HP、400 nmol/L P1、1.2 U/μL KF聚合酶、0.8 U/μL Nt.BbvCl、2000 μmol/L dNTPs和不同浓度CEA的溶液在25℃下反应120 min,随后升温至90℃反应10 min。冷却后,向其中加入含有8.0 μmol/L Hemin的50 μL Tris-HCl缓冲溶液,并继续反应45 min; 接着向其中加入含有200 μmol/L Cys的20 μL Tris-HCl缓冲溶液,反应30 min后,将10 μL TPE-M(400 μmol/L)溶液、70 μL Tris-HCl缓冲溶液与上述反应溶液混合,继续孵育20 min,进行荧光分析检测。荧光测量电压为700 V,激发波长为365 nm,狭缝为5.0 nm,光谱采集范围为400~650 nm。
3 结果与讨论
3.1 TPE-M/L-Cys荧光传感体系的构建与表征
对制备的TPE-M的荧光性能及TPE-M对L-Cys的荧光响应特性进行了考察。如图1A所示,受限于马来酰亚胺结构的强吸电子能力,TPE-M发光较弱,其荧光强度仅为57.60 a.u.。向其中加入L-Cys后,荧光强度大大增加,达到517.3 a.u.。从荧光照片中可更直接地观察到荧光强度的增加:TPE-M溶液几乎无荧光,而TPE-M+L-Cys溶液则发射出强烈的天蓝色荧光。上述结果均表明,TPE-M对L-Cys有优异的响应性。基于加入L-Cys后TPE-M的荧光强度显著增加的特性,并参考文献[28],推测TPE-M与L-Cys作用机理如图1B所示:L-Cys分子上的巯基与TPE-M上马来酰亚胺的双键发生迈克尔加成反应,生成稳定的加成物TPE-M-L,双键被破坏,抑制了分子内的光诱导电荷转移(PET),促使荧光增强。
Hemin/G-四链体具有类辣根过氧化物酶活性[29,30],可催化体系中的溶解氧氧化L-Cys为Cys-cys。Cys-cys相对L-Cys而言不含巯基,因此无法破坏TPE-M上马来酰亚胺的双键增强体系中的荧光信号(图1C)。基于Hemin/G-四链体对L-Cys的催化氧化作用、TPE-M对L-Cys响应以及L-Cys与Cys-cys的分子结构差异,推测TPE-M/L-Cys体系对G-四链体DNA有特异的响应性。为验证此推测,将G-四链体DNA(G1)与非G-四链体DNA(N1)分别与L-Cys进行预孵育,然后再与TPE-M进行反应,结果如图1D所示。当G1与N1均不存在时,体系荧光信号较高,且其强度随预孵育时间变化很小; 当G1存在时,随着孵育时间延长,荧光强度逐渐降低,在30 min时达到最低值; 当N1存在时,随着时间延长,检测体系荧光强度保持稳定,没有发生变化。实验结果表明,TPE-M/L-Cys体系可特异性地识别G-四链体DNA。
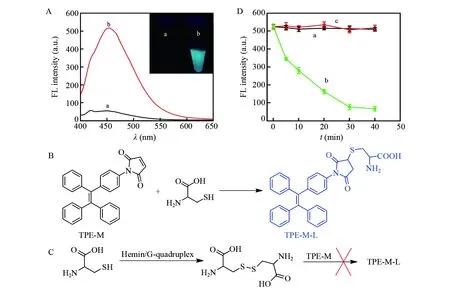
图1 (A)不同体系的荧光光谱(插图为相应的荧光照片):(a)TPE-M,(b)TPE-M + L-Cys; (B)L-Cys与TPE-M的反应路线; (C)Hemin/G-四链体对TPE-M/L-Cys作用的示意图; (D)L-Cys与空白样品(a)、 G1(b)、 N1(c)预孵育后与TPE-M反应体系荧光强度随预孵育时间的变化Fig.1 (A) Fluorescent spectra of different systems: (a) maleimide-functionalized tetraphenylethene (TPE-M), (b) TPE-M +L-Cys, and inset is images of (a) and (b) under excitation of 365 nm light; (B) Reaction route of L-Cys and TPE-M; (C) Interaction illustration of TPE-M + L-Cys with hemin/G-quadruplex; (D) FL intensity of the sensing system in the presence of TPE-M versus pre-reaction time between: (a) L-Cys+ blank, (b) L-Cys + G1, and (c) L-Cys + N1
3.2 实验原理
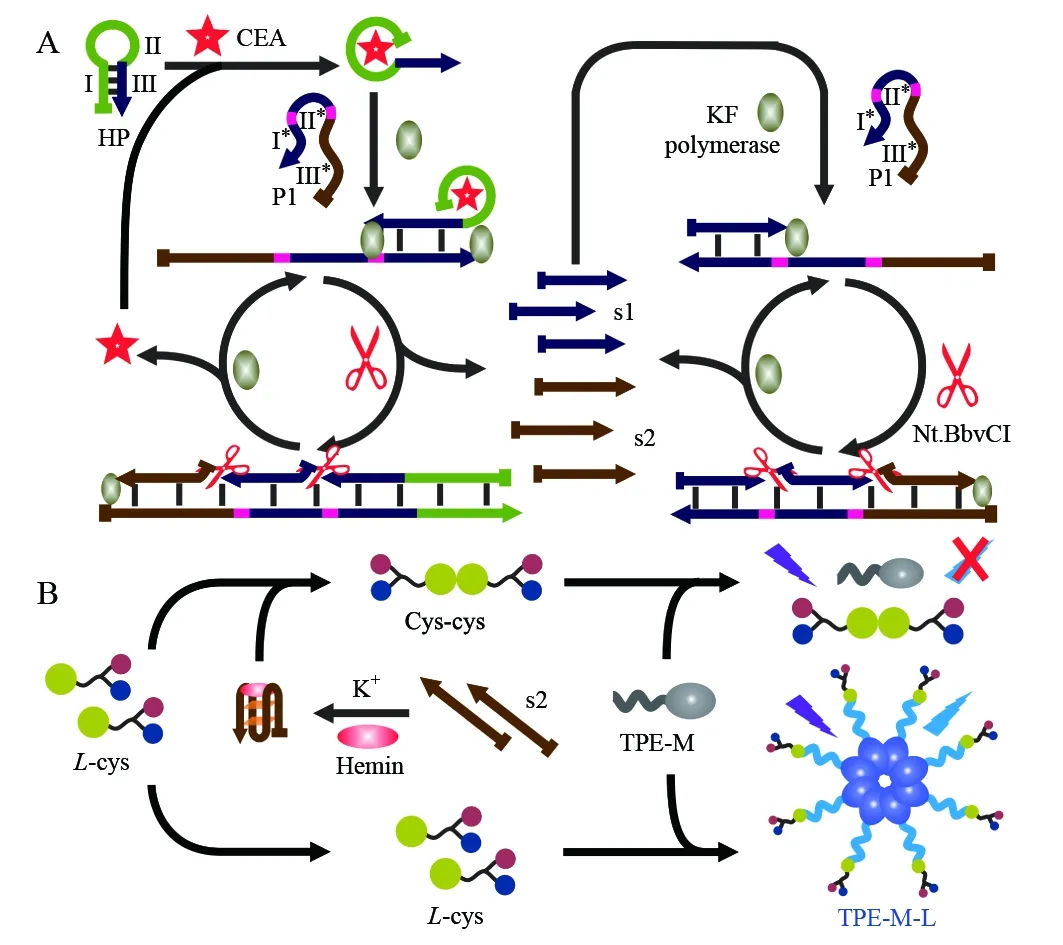
图2 基于TPE-M/L-Cys体系免标记、高灵敏检测 CEA的原理图Fig.2 Principle of TPE-M/L-Cys based biosensor for carcinoembryonic antigen (CEA) analysis based on target-initiated cyclic amplification reaction
基于上述实验结果,借助酶辅助的循环放大反应,将TPE-M/L-Cys体系用于检测CEA,其实验原理如图2所示。首先,设计发卡探针HP与模板探针P1序列,以保证目标物存在条件下指数扩增反应的顺利进行。HP分为3个部分:Ⅰ、Ⅱ与Ⅲ,其中,Ⅰ与Ⅱ为CEA的适配体序列,可特异性识别结合CEA; Ⅲ与P1中的Ⅰ*或Ⅱ*互补; Ⅰ与Ⅲ为发卡HP的茎,Ⅱ为发卡HP的环。P1被Nt.BbvCI内切酶识别位点(5′-GCTGAGG-3′)分为3个部分:Ⅰ*、Ⅱ*与Ⅲ*,其中Ⅰ*与Ⅱ*相同,Ⅲ*与G1互补。当目标物不存在时,HP保持发卡构象,与P1 不发生反应(图3A-a, b, c),因此无法引发指数扩增反应生成大量Hemin/G-四链体,也无法阻止L-Cys与TPE-M反应,故检测体系发出强烈的荧光信号。当CEA存在时,CEA与HP中Ⅰ与Ⅱ特异性结合形成CEA@HP络合物,引发HP构象变化,暴露出片段Ⅲ(图3A-d)。暴露出的片段Ⅲ与模板P1杂交生成新的络合物,因此,CEA@HP络合物对应的条带消失,同时在其后出现一个新的条带(图3A-e)。加入KF聚合酶和Nt.BbvCI内切酶后,引发指数扩增反应,合成出大量s1与s2核酸片段,同时释放出CEA。其中,生成的s1与未反应的P1继续杂交,释放的CEA继续识别未反应的HP,新引发若干个指数扩增反应,生成大量核酸片段s2。因此,在泳道f最前方出现一个新的条带,与G1条带的位置相当,进一步证实了富含G碱基的s2核酸片段的生成。在K+与Hemin存在下,s2形成大量Hemin/G-四链体,催化氧化L-Cys变成Cys-cys,阻止L-Cys与TPE-M的反应,致使荧光信号降低。
3.3 可行性分析
为验证所设计的传感器用于CEA免标记分析检测的可行性,测定了不同体系的荧光响应(图3B)。当CEA不存在时,L-Cys与TPE-M反应,产生较强的荧光信号(516.9 a.u.),其与TPE-M/L-Cys体系的荧光强度相当,表明溶液中存在的DNA片段、生物酶、核苷酸、Hemin等对TPE-M/L-Cys体系的影响非常小。加入10 fmol/L CEA后,体系的荧光强度降低至271.8 a.u.,这主要归因于CEA引发指数扩增反应生成大量Hemin/G-四链体,进而催化氧化L-Cys,阻止其与TPE-M的反应,降低荧光强度。继续增加CEA浓度至200 fmol/L,荧光强度继续降低,表现出明显的负相关关系,进一步证实了实验原理的可行性:越多的L-Cys引发指数扩增反应生成越多的s2,催化消耗越多的L-Cys,进而大幅度降低荧光信号。上述实验结果表明,基于TPE-M/L-Cys体系构建免标记传感平台用于CEA的荧光分析检测是可行的。
HP与P1不仅具有识别CEA的功能,同时也有保证指数扩增反应顺利进行的作用。因此,利用HP′和P1′分别取代HP和P1构建传感体系,考察传感体系对CEA的荧光响应行为(图3C)。HP′不含有CEA适配体序列,P1′不含有与G1互补的序列。当HP′取代HP后,检测体系呈现较强的荧光信号,远大于HP构建的 传感器检测到的荧光强度。这主要是因为HP′无法识别CEA,因此构象不发生变化,无法引发循环放大反应产生G-四链体,也不能阻止L-Cys与TPE-M的反应。当用P1′代替P1后,检测体系的荧光信号依然很高,大于P1存在时体系的荧光强度。这主要是因为HP虽可识别CEA引发循环放大反应产生大量核酸片段,但产生的核酸片段不是G-四链体DNA,因此无法形成Hemin/G-四链体进而阻止L-Cys与TPE-M的反应。因此,合理、巧妙地设计HP和P1的核酸序列才能保证CEA免标记检测的顺利进行。
3.4 实验条件优化
Hemin/G-四链体的产生与CEA的传感性能相关,因此对影响Hemin/G-四链体产生的因素包括HP的浓度、P1的浓度及反应时间进行了优化(图4A)。随着发卡探针HP浓度增大,检测体系荧光强度逐渐减小,在100 nmol/L时达到最低值,因此,最适的HP浓度为100 nmol/L。按照同样方法进行考察,发现P1的最适浓度为100 nmol/L(图4B)。如图4C所示,随着酶反应时间延长(30~120 min),荧光强度逐渐降低; 继续延长酶反应时间(120~180 min),放大效果增加不明显。基于此,选择最佳的酶辅助反应时间为120 min。
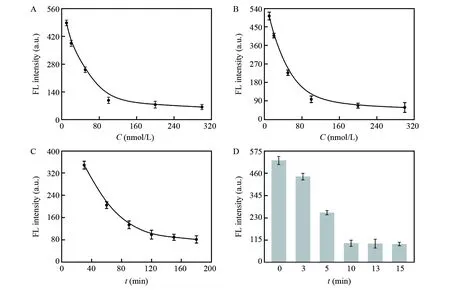
图4 HP用量(A)、 P1用量(B)、 反应时间(C)和不同热处理(90℃)时间(D)对AIE传感体系荧光响应的影响, CEA浓度为200 fmol/LFig.4 Effect of HP dosage (A), P1 dosage (B), incubation time (C) and heat-treatment time at 90℃ (D) on fluorescence signal of TPE-M/L-Cys system toward 200 fmol/L CEA
在反应过程中,为了提高酶的活性、减少核酸片段的降解,加入DTT作为强效还原剂。但是,DTT含有自由的巯基,可与TPE-M反应,点亮其荧光,干扰CEA的分析检测。为消除DTT对传感体系的干扰,对扩增后的溶液进行90℃热处理,考察了作用时间对荧光强度的影响(图4D)。未进行热处理的体系在CEA存在时仍表现出较强的荧光信号,这主要是因为CEA虽可引发指数扩增反应生成大量Hemin/G-四链体,进而消耗L-Cys,阻止其与TPE-M反应,但体系中存在的大量DTT可与TPE-M反应。随着热处理时间延长,体系荧光强度逐渐降低,在10 min达到最低值。这表明90℃热处理10 min,可高效消除检测体系中存在的巯基化合物,提高检测的准确度。
3.5 传感性能分析
在最佳条件下,考察了本传感器对CEA的检测性能。如图5A所示,在0.1~200 fmol/L范围内,随着CEA浓度的增加,体系荧光强度逐渐降低。以453 nm处的荧光强度(F453)为纵坐标、CEA浓度的对数(lgCCEA)为横坐标,绘制工作曲线(图5B),结果表明,F453与lgCCEA呈良好的线性关系,线性方程为F453=-128.46 lgCCEA+ 400.69,(R2=0.9965),检出限为0.033 fmol/L (S/N=3)。与文献报道的检测CEA的方法相比(表2),本方法灵敏度和检出限与之相当或更优。

图5 (A)不同浓度CEA存在下TPE-M/L-Cys体系的荧光光谱; (B)TPE-M/L-Cys体系的荧光强度与CEA浓度的线性曲线Fig.5 (A) Fluorescent curves of TPE-M/L-Cys system in the presence of different concentrations of CEA; (B) Linear relationship of FL signal versus logarithm of CEA concentration

表2 不同CEA检测方法性能比较
考察了本传感器对CEA检测的选择性。在同样条件下,采用200 fmol/L的AFP、CA125与CA199进行了验证。如图6A所示,当且仅当CEA存在时,检测体系的荧光信号才大幅度降低,而AFP、CA125与CA199并不能引起体系的荧光强度降低, 这表明HP适配体具有特异性识别CEA的能力。将AFP、CA125、CA199与CEA混合后再进行检测,检测体系的荧光信号仍很低,其数值与CEA单独存在时相当,表明AFP、CA125与CA199的存在并不会对CEA的检测造成干扰,进一步证实本传感器具有优异的选择性与抗干扰能力。
为了验证构建的AIE传感器的稳定性,采用同样方法,在20 μmol/L KNO3、Ca(NO3)2、葡萄糖(Glucose)、甘氨酸(Glycine)、谷氨酸(Glutamic acid)和谷胱甘肽(GSH)存在条件下,检测200 fmol/L CEA(图6B)。加入这些干扰物并未对检测体系的荧光信号产生影响,其原因为90℃热处理可有效去除巯基化合物,表明本研究构建的AIE传感器具有优异的稳定性。
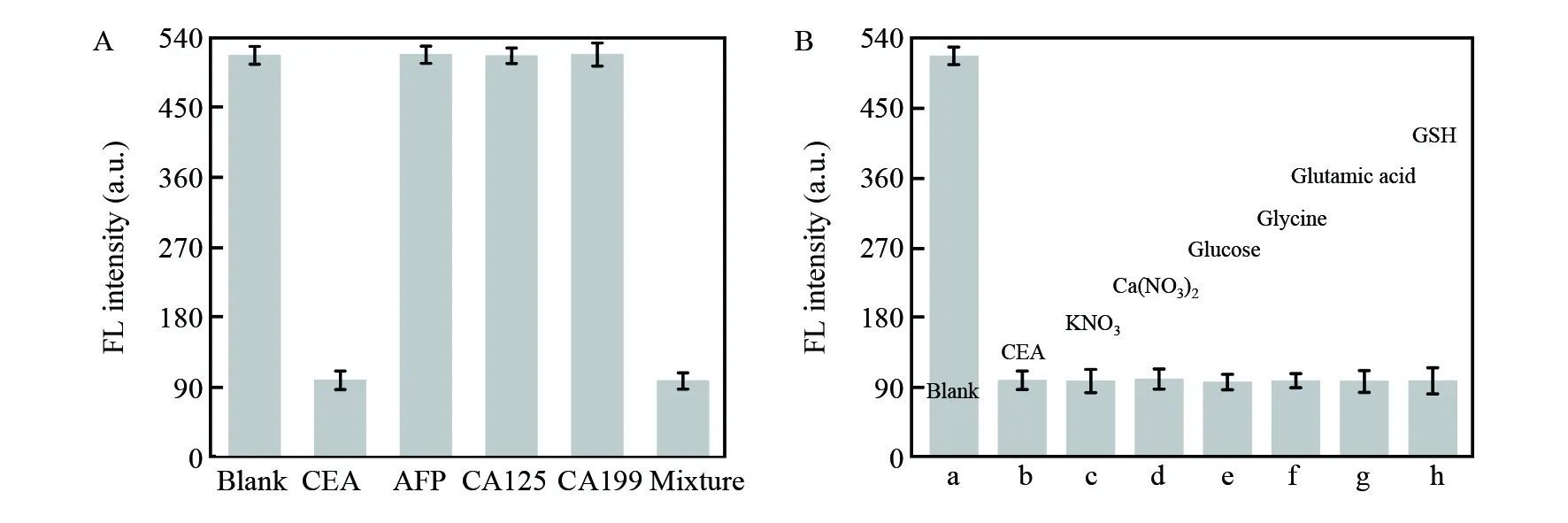
图6 (A)不同分析物(200 fmol/L)存在下TPE-M/L-Cys体系的荧光强度; (B)干扰物对TPE-M/L-Cys体系检测200 fmol/L CEA强度的影响Fig.6 (A) FL intensity of TPE-M/L-Cys system upon the addition of CEA, α-fetoprotein (AFP), CA125, and CA129, and the mixture of these substances, respectively; (B) FL intensity of TPE-M/L-Cys system toward 200 fmol/L CEA in the presence of 200 μmol/L different substances
3.6 实际样品分析
利用构建的AIE传感平台进行了血清样品中CEA的检测,结果见表3。在30%稀释的血清中,5个加标水平下的回收率分别为97%、 103%、 96%、 104%和105%,相对标准偏差<5%,表明本方法可用于实际样品中CEA的检测。

表3 血清样品中CEA的检测结果
4 结 论
基于Hemin/G-四链体对L-Cys的催化氧化作用、TPE-M对L-Cys响应以及L-Cys与Cys-cys的分子结构差异,结合目标物引发的酶辅助循环放大反应,构建了AIE材料介导的荧光生物传感器,实现了CEA的免标记、高灵敏检测。目标分子CEA引发指数扩增反应, 产生大量Hemin/G-四链体,催化氧化L-Cys, 阻止L-Cys与TPE-M的反应,进而引起检测体系的荧光强度变化,实现对CEA的免标记、高灵敏检测,检出限低至0.033 fmol/L。同时,此传感器具有优异的选择性、稳定性与抗干扰能力,可用于血清中CEA的分析检测。本研究为建立免标记、灵敏的高性能荧光传感器提供了参考,拓宽了AIE材料的应用范围,在临床医学诊断领域具有较好的应用前景。

