益生元降血脂功效研究进展
袁 超,张林军,师景双,刁梦奇,葛 萍,刘 飞*,张金华*
(1.山东省药学科学院 山东省生物药物重点实验室 山东省多糖类药物工程实验室 多糖类药物发酵与精制国家地方联合工程实验室 博士后科研工作站,山东 济南 250101;2.山东省食品药品检验研究院,山东 济南250101;3.江苏斯卡露生物科技有限公司,江苏 泰州 214500)
心脑血管疾病因“发病率高、死亡率高、复发率高、致残率高、并发症多”的特点,在疾病死因中高居首位,约占总死亡人数的40 %以上[1]。高脂血症(hyperlipoidemia)主要是以血浆或血清中总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)升高,高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)降低为主要特征的一种血脂代谢紊乱疾病,是心脑血管疾病的主要诱因[2]。研究表明,血清TC每升高0.6 mmol/L,冠心病(CHD)发病风险就会升高34 %左右;血清TG每升高1 mmol/L,男性和女性CHD发病风险则分别升高12 %和37 %[3]。因此,降低血脂水平是预防心血管疾病发生的重要策略。
目前降血脂的药物主要有他汀类、烟酸类、贝特类及一些中成药类药物,以上药物普遍存在一些副作用,如加重肝脏负担、造成横纹肌溶解、引起消化道反应,导致胆结石、心律失常等。尤其是本身就有上述并发症的高脂血症患者,以上常规药物的副作用对患者健康造成的危害更为严重。因此,开发和研究一种无副作用的新型降血脂药物或降血脂方案,具有十分重要的意义。
在此背景下,益生元在调节血脂代谢方面的研究近年已成为热点。本文对益生元降血脂功效及作用机制的研究进展进行回顾,并对益生元降血脂功效的研究前景进行展望。
1 益生元的概念
益生元(prebiotics)的概念最早由Gibson等[4]提出,是指“不易消化的食物成分,它可以通过选择性地刺激结肠中的一种或少数几种细菌的生长或活性而对宿主产生有益影响,从而增进宿主健康”。在上述基础上,国际益生菌和益生元科学协会(ISAPP)于2017年将益生元的定义更新为:“一类可被宿主体内微生物选择性利用并对宿主产生健康效应的物质”[5],新定义扩大了益生元的物质范围和作用部位,将非碳水化合物及非食物成分等也包括在内,并将作用部位扩大到了胃肠道以外。
益生元能促进双歧杆菌(Bifidobacterium),乳酸杆菌(Lactobacillus)等有益菌的生长,同时能抑制有害菌,其对人体健康的有益影响包括:通过选择性刺激特定菌群恢复肠道菌群平衡;降低急性肠道综合症的发生率;缓解便秘;增强免疫力;预防癌症;改善血脂水平等[6-11]。
益生元的种类包括功能性低聚糖、微藻类、蛋白质水解物及天然植物中的蔬菜、中草药、野生植物等,其中功能性低聚糖是最常见的益生元。
2 益生元降血脂功效的研究进展
大量动物实验研究证明益生元对减少肥胖发病率和控制体重有积极作用,同时在一定条件下有利于血脂异常的恢复。但在人体实验中,却出现了不同的结果,部分学者的研究结果表明,摄入益生元对调节人体血脂代谢有积极作用,但另一些学者则认为,摄入益生元对人体血脂水平如TC、TG、LDL-C、HDL-C等并没有显著的影响。本文将对近年关于益生元降血脂功效的动物实验和人体实验研究进行回顾和总结。
2.1 动物实验
益生元的降血脂功效在动物模型中研究较多,研究内容包括益生元的种类、益生元的分子量、不同种类益生元的搭配使用等对动物模型血脂的影响。动物实验通常使用高脂大鼠作为模型,其中菊粉型果聚糖研究最多,效果也最显著(见表1)。
Han等[12]研究了不同聚合度的长链菊粉(inulin)对高脂血大鼠脂类代谢的影响。实验分为2期,第1期实验组大鼠喂食高脂饲料搭配5 %的Raftiline高聚合度菊粉(HP菊粉,平均聚合度24),对照组喂食高脂饲料搭配5 %纤维素。结果显示,与对照组相比,实验组大鼠的血清TC、TG及肝脏TG水平均有明显降低(P<0.05)。第2期实验中,研究人员对实验组大鼠喂食高脂饲料并分别搭配5 % Raftiline标准菊粉(GR菊粉,平均聚合度10)、5 % Tokachi菊粉(平均聚合度15)及5 % HP菊粉,对照组大鼠喂食高脂饲料搭配5 %纤维素。实验结果显示,相比对照组,Tokachi菊粉组及HP菊粉组的盲肠重量、盲肠胆固醇、胆汁酸(bile acid,BA)、粪甾醇(coprostanol)及盲肠丙酸酯(propionate)浓度均有升高(P<0.05)。与对照组相比,Tokachi菊粉组及HP菊粉组血清TC、TG含量和肝内TG浓度显著降低(P<0.05);与其他各组相比,Tokachi菊粉组的盲肠血流量也得到显著提升。以上结果表明,平均聚合度为15的Tokachi菊粉和平均聚合度为24的HP菊粉对高脂血模型大鼠的降血脂效果要明显优于平均聚合度为10的GR菊粉。
Hoving等[13]通过对照实验研究了甘露聚糖(mannan oligosaccharide,MOS)对小鼠动脉粥样硬化的影响:雌性E3L.CETP小鼠分为对照组和MOS干预组,分别喂食高脂饲料、高脂饲料+1 %MOS,实验周期14周。数据显示,与对照组相比,MOS干预组的血浆TC降低21 %(TG含量没有明显变化),盲肠拟杆菌(Bacteroides)丰度增加,盲肠丁酸盐水平上升,粪便BA排泄量增加,主动脉根部的动脉粥样硬化病变面积平均减少了54 %。研究人员认为,MOS可通过降低血浆TC来降低动脉粥样硬化的风险,而血浆TC的降低与盲肠丁酸盐水平上升、粪便BA排泄量增加和肠道菌群的变化有关。
Aminlari等[14]通过平行对照实验研究了菊粉和MOS对高胆固醇血症大鼠的治疗功效,他们将大鼠分为对照组、高脂饲料组(HC组)、高脂饲料加MOS组(HC+M组)、高脂饲料加菊粉组(HC+I组),分别喂食标准饲料、高脂饲料、高脂饲料+5 %MOS、高脂饲料+5 %菊粉,喂食50 d后测量大鼠的血清血脂、血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、肝脏TC、TG及体重。结果显示,HC+M组和HC+I组的TC、TG、LDL-C、血清AST均明显低于HC组,表明MOS和菊粉可用于高胆固醇血症的替代或补充疗法。
程梦婕等[15]研究了魔芋甘露聚糖(konjac mannan oligosaccharides,KMOS)对高脂血症大鼠的治疗作用:SD大鼠随机分为阴性对照组、模型组、KMOS低剂量实验组(KMOS-L组)、KMOS中剂量实验组(KMOS-M组)、KMOS高剂量实验组(KMOS-H组),除阴性对照组外,其余4组喂食高脂饲料5周。造模成功后,按设定剂量进行KMOS灌胃。实验结果显示,灌胃5周后,与模型组相比,KMOS-M和KMOS-H组的血清TC含量显著降低(P<0.05),KMOS 3个剂量组血清TG含量显著降低(P<0.05),表明KMOS对高脂血症具有一定的治疗作用。
Hashmi等[16]以菊粉为阳性对照,研究了低聚半乳糖(galactooligosaccharide,GOS)对高脂血大鼠的降血脂效果,他们将实验大鼠分为对照组(G0)、阴性对照组(G1)、干预组(G2,G3,G4)和阳性对照组(G5),分别喂食高脂饲料、基础饲料、高脂饲料+110 mg/250 g体重GOS、高脂饲料+154 mg/250 g体重GOS、高脂饲料+198.4 mg/250 g体重GOS、高脂饲料+154 mg/250 g体重菊粉,实验周期60 d。研究结果显示,与G0相比,GOS干预组G2、G3、G4的血清TG、TC、LDL-C指标均显著降低,且下降幅度大于阳性对照组G5,各组之中,GOS干预组G4的TC、TG、LDL-C水平降低最明显,体现了GOS降血脂效果与剂量正相关。
Parnell和ReiMer[17]通过一组随机对照实验,研究了益生元组合物[菊粉与低聚果糖(fructo oligosaccharide,FOS)1:1的混合物]对消瘦和肥胖高血脂模型大鼠的影响。对这些大鼠分别喂食含0 %,10 %和20 %益生元组合物的饲料10周后,与喂食不含益生元组合物饲料的肥胖组大鼠相比:(1)喂食含10 %益生元组合物饲料的肥胖组大鼠和喂食含20 %益生元组合物饲料的肥胖组大鼠,血清TC含量均降低了24 %;(2)喂食含20 %益生元组合物饲料的肥胖组大鼠的血清LDL-C含量降低(P<0.05);(3)喂食含10 %益生元组合物饲料的肥胖组大鼠和喂食含20 %益生元组合物饲料的肥胖组大鼠的血清HDL-C含量降低(P<0.05)。而消瘦组大鼠喂食不同益生元组合物含量的饲料后各项指标并没有明显的变化。以上结果表明,菊粉的降血脂作用似乎只对肥胖模型有效。
周中凯等[18]通过随机对照平行实验研究了壳寡糖(chitosan oligosaccharide,COS)、抗性淀粉(resistant starch)及二者交联复合物对高脂血大鼠的降脂作用。实验结果表明,喂养6周后,COS-抗性淀粉交联复合物干预组的血清TC、TG及LDL-C水平均恢复到正常水平,COS干预组和抗性淀粉干预组的血清TC、TG及LDL-C水平虽有所下降,但下降幅度不如COS-抗性淀粉交联复合物干预组,这说明COS和抗性淀粉交联后取得更好的降血脂效果。
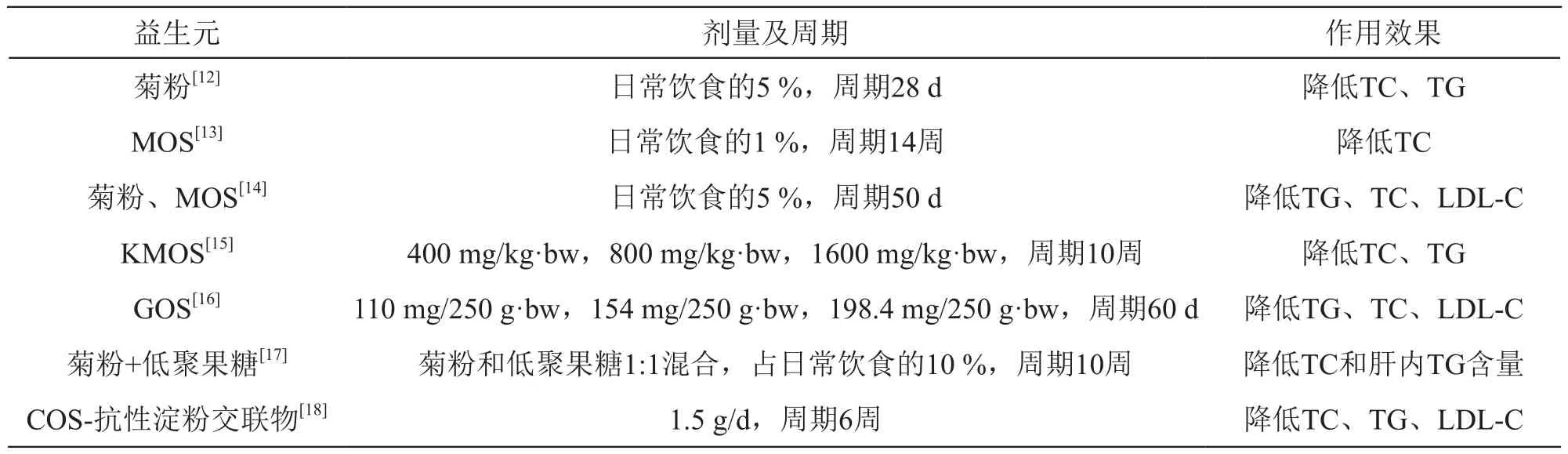
表1 益生元降血脂功效的动物实验
2.2 人体实验
尽管动物实验已经充分证明了多种益生元在降血脂方面的功效,但在人体实验方面,这一结论仍面临许多争议(见表2)。
Vulevicet等[19]通过随机安慰剂对照实验,评估了GOS对肥胖、血脂异常的成年人的降血脂功效。12周的干预期和4周的洗脱期后,研究人员发现,与对照组相比,GOS干预组的血清TG、TC均有明显降低,且其血清HDL-C的含量也明显升高。
与之类似,Russo等[20]通过一项以男性志愿者为对象的随机双盲交叉实验评估了富含菊粉的面食对22名健康年轻人的血脂水平的影响。实验周期包括5周的干预期和8周的洗脱期,志愿者分为两组,分别食用含11 %菊粉或不含菊粉的面食。研究人员发现,在实验结束后,与对照组相比,食用菊粉面食的试验组,其血清HDL-C提高了35.9 %,且血清TC:HDL-C降低了22.2 %,血清TG含量降低了23.4 %。
李玲等[21]通过空白对照实验研究了贻贝多糖胶囊(200 mg/粒)对人体的降血脂功效。102名成年志愿者被分为试食组(52名,正常饮食,同时服用贻贝多糖胶囊,每日两次,每次2粒)和空白对照组(50名,正常饮食,不服用贻贝多糖胶囊),实验周期30 d。实验结果显示:与试食前相比,试食组成员试食结束后的血清TC和TG水平分别降低了19.22 %和16.91 %;与空白对照组相比,试食结束后,试食组的血清TC、TG水平均显著降低(P<0.01);试食组的TC下降有效率为67.3 %、TG下降有效率为50 %,总有效率48.1 %,表明贻贝多糖具有显著的降血脂功效。
许多研究表明,使用不同益生元进行配伍也具有降低血脂的功效。Vogt等[22]报道,每天食用25 g乳果糖(lactulose)和L-鼠李糖(L-rhamnose),能明显降低血清TG的含量并减缓生成速率。
也有研究表明,益生元作为膳食策略的一部分,与大豆食品合用时,降低血清TC功效可得到明显增强。Wong等[23]进行了一项为期4周的随机实验,实验分为3个阶段和4种饮食方案:(1)仅食用益生元——每天10 g富含FOS的菊粉,(2)仅食用大豆食品,(3)安慰剂,(4)大豆食品外加10 g/d的益生元。他们表示,FOS搭配大豆食品的方案在降低血脂、LDL-C和升高HDL-C方面具有显著的协同作用。
尽管有多项研究表明益生元对人类血脂代谢具有有益的调节作用,但也有多项研究得出了不同的结论。
Giacco等[24]对中度高血脂的成年人进行了一项随机交叉实验。每天食用10 g短链FOS 2个月后,短链FOS干预组与对照组的血浆TC和TG的水平并无明显不同。
Sandra等[25]以30名成年志愿者(13名男性,17名女性)为研究对象,通过一项双盲安慰剂对照随机交叉实验研究了β2-1果聚糖对人体免疫和代谢水平的影响,实验包括28 d的干预期和14 d的洗脱期,干预期内对干预组成员给予3×5 g/d的β2-1果聚糖,实验结束后,研究人员表示,β2-1果聚糖对血脂水平、血浆TC浓度等并没有产生影响。
罗月梅[26]通过一项随机双盲安慰剂对照实验,研究了摄入两种不同聚合度的菊粉类果聚糖对中国人肠道菌群、血糖、血脂等代谢指标的影响。实验征集了153名健康志愿者,在干预4周后,研究人员发现,与对照组相比,菊粉干预组的肠道微生态发生了明显变化,但他们的血脂代谢指标和血糖代谢指标并没有发生显著变化,且两个不同聚合度的菊粉类果聚糖干预组之间也没有明显差异。

表2 益生元降血脂功效的人体实验
如此截然相反的结论是多种因素导致,如所选用的益生元的类型不同、剂量不同、实验周期之前的差异、样本量不足、缺乏合适的管理、参与者肠道环境的差异等。
3 益生元降血脂的作用机制
在评估益生元的降血脂功效的同时,许多研究人员也对其降血脂的功效机制进行了研究。这些研究结果大体可将益生元的降血脂机制归纳为3种假说。
3.1 通过吸附作用降低血脂水平
益生元纤维同时具有可溶性和可发酵性的特性,但不同于膳食纤维的是,它们不能在肠道内形成胶状或改变黏性[27],而是与脂肪形成稳定的乳胶状复合物,从而阻止脂肪被相关酶水解[28]或被肠道吸收。
刘国红等[29]通过体外实验证实FOS对高脂血动物模型血清TC的吸附率达46.87 %;并通过模拟人体胃、肠道环境评估了FOS对猪油、花生油和蛋黄的吸附能力,实验结果表明,FOS在模拟的胃、肠道环境中,对猪油有较强的吸附能力,在模拟的肠道环境中,对花生油和胆固醇有较强的吸附能力。
张婷婷等[30]通过体外实验证明COS对油脂、脱氧胆酸钠和牛黄胆酸钠、胆固醇的吸附率分别为46.4 %,90.0 %,71.1 %和87.5 %,表明FOS对不同脂质均有较强的吸附能力。
3.2 通过影响脂类合成酶活性降低血脂水平
Delzenne等[31]报道,FOS饲养的大鼠,在其极低密度脂蛋白-甘油三酯(VLDL-TG)分泌减少的同时,其所有脂类合成酶的活性也相应降低:乙酰辅酶A羧化酶(acetyl-CoA carboxylase)、脂肪酸合成酶(fatty acid synthase)、苹果酸脱氢酶(malic enzyme)、ATP柠檬酸裂解酶(triphosphate citrate lyase)和葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate 1-dehydrogenase)的酶活力均降低了约50 %。由以上结果可形成一种假设,FOS似乎可调控脂类合成酶基因编码的表达。
王慧铭等[32]研究了昆布多糖(TLP)对肥胖大鼠模型的降血脂作用及其机制。实验结果表明,TLP可使肥胖大鼠模型的血脂水平显著降低,且其卵磷脂胆固醇酰基转移酶(LCAT)、脂蛋白脂酶(LPL)和胰脂肪酶(PL)酶活性也明显升高(P<0.05),这表明TLP的降血脂机制可能与LCAT、LPL、PL酶活性增强有关。
3.3 通过改变肠道菌群降低血脂水平
肠道菌群的构成与肥胖、高脂血症之间密切相关。Turnbaugh等[33]通过动物模型发现,与正常小鼠相比,肥胖小鼠肠道中的厚壁菌门(Phylum Firmicutes)丰度增加而拟杆菌门(Bacteroidetes)则相对减少。人体实验结果表明,肥胖个体的肠道菌落组成多样性较低,且拟杆菌门(Bacteroidetes)数量显著低于非肥胖个体[34-35]。
研究证实,膳食补充抗性淀粉可增加双歧杆菌(Bifidobacterium)数量,同时减少厚壁菌门(Phylum Firmicutes)而增加拟杆菌门(Bacteroidetes)数量[36]。Dewulf等[37]通过一项双盲干预实验研究了菊粉类果聚糖对肥胖女性肠道微生物组成的影响。结果表明,菊粉类果聚糖能使肥胖女性肠道中的双歧杆菌属(Bifidobacterium)和普氏粪杆菌属(Prevotella)数量增加,这两种细菌可通过调控血清脂肪酶(LPS)水平而对体重产生影响[38]。以上结果表明益生元可通过调节肠道菌群的多样性起到减体重、降血脂的作用。
4 结论及展望
研究人员已经通过动物模型实验和人体实验对益生元的降血脂功效进行了大量研究,研究内容涵盖了益生元的种类、聚合度、搭配及益生元改性等多个方面。动物实验的研究结果基本一致,表明益生元可有效降低血脂水平;但在人体实验方面,实验结果并不一致:有些报道中益生元能有效降低人体血脂水平,另一些报道中益生元对人体的血脂水平并没有产生明显的影响。
笔者认为之所以会产生以上结论,主要是由于个体之间的差异性造成的,即动物实验统一造模,集中管理更容易产生一致的实验结果;而人体实验由于人种、生活环境、饮食习惯、作息规律、代谢水平、健康状况等的不同,会使得实验结果出现不一致的情况。同时我们也注意到,在人体实验中,针对肥胖或者高血脂人群的试食实验,多数会得出益生元有益于降血脂的结论;而针对健康人群的实验,其结果多数认为,益生元对人体血脂水平没有明显的影响。但益生元的降血脂效果是否仅对肥胖或高血脂人群有效,仍需研究人员通过更为科学严谨的研究方法来验证。
研究人员对益生元的降血脂机制提出了若干种假说,如吸附油脂、影响脂肪代谢相关酶的酶活力和影响肠道菌群多样性等。笔者认为脂肪代谢是一个十分复杂的体系,益生元影响血脂代谢应是多种机制共同起作用的过程,但具体以哪种机制为主,是否还存在其他机制,这些问题仍需研究人员通过实验论证来解答。
《中国心血管病报告2016》数据显示,我国现有心血管病(cardiovascular disease,CVD)患者人数约2.9亿[39],而脑血管疾病也已成为影响我国居民平均寿命的重要原因之一[40]。高脂血症是诱发心脑血管疾病的主要诱因,益生元因其安全有效且无毒副作用的特点,在降血脂等方面越来越受到关注,以益生元为基础,阐明其降血脂机制,开发出切实有效的降血脂药物或制定有效的降血脂方案,具有重要的现实意义。

