LncRNA MALAT1通过miR-34c/SATB2轴对脂肪间充质干细胞成骨分化的促进作用
郭玮玮,秦悦,杨海波,米占虎
(宁夏医科大学总医院创伤骨科,宁夏 银川 750001)
脂肪间充质干细胞(adipose-derived stem cells,ADSCs)具有自我更新和多向分化潜能,可用于再生或修复骨组织[1]。与骨髓来源的间充质干细胞比较,ADSCs 组织来源更丰富,细胞增殖速度更快[2]。然而,尽管有大量研究ADSCs 可分化为多种谱系,但ADSCs 分化的分子机制仍不明了。长链非编码RNA(long non-coding RNA,LncRNA)和微小RNA(miRNA)在成骨细胞分化中起关键作用[3-4]。研究[5]表明:LncRNAKCNQ1OT1 通过激活Wnt/β-catenin 通路促进成骨分化以减弱骨溶解。LncRNA H19 的异常表达与成骨分化有关[6]。细胞实验[7]表明:LncRNA 肺癌转移相关转录本1(metastasis-associated lung ademocarcinoma transcript 1,MALAT1)通过抑制miR-204 的表达,促进成骨细胞特异性标志物碱性磷酸酶(ALP)、骨钙蛋白(OCN)和矿化的骨基质形成。研究[8]表明:miRNA 参与调节成骨细胞和破骨细胞分化过程。miR-34c 通过调节成骨细胞中特异AT 序列结合蛋白2(special AT-rich sequence binding protein 2,SATB2)和Runt 相关转录因子2(Runx2)等多个靶点,影响成骨细胞和破骨细胞在体内的骨稳态[9]。过表达SATB2可以促进乙醇诱导的骨坏死患者骨髓间充质干细胞(bone marrow mesenchyml stem cells,BMSCs)的成骨分化[10]。目前,LncRNA MALAT1 在ADSCs 成骨分化中的作用尚不清楚。本研究旨在探讨LncRNA MALAT1 通过miR-34c/SATB2 轴在ADSCs 成骨分化中的作用,以期为明确LncRNA MALAT1 调控ADSCs 成骨分化的机制和骨损伤的治疗提供科学指导。
1 材料与方法
1.1 细胞、主要试剂和仪器原代人ADSCs 购自美国ScienCell 公司,HEK-293T 细胞购自中国典型培养物保藏中心。DMEM培养基购自美国Hyclone公司,胎牛血清(FBS)购自美国Gibco 公司,青链霉素混合液(100×)购自北京索莱宝科技有限公司,Lipofectamine 3000 转染试剂购自美国Invitrogen 公司,SYBRPremix Ex TaqTMⅡ试剂盒购自日本TaKaTa 公司,BCA 蛋白定量试剂盒购自北京全式金公司,lentiviral-pEF-1a/Puro-NC(Lenti-NC)、lentiviral-pEF-1a/Puro-MALAT1(Lenti-MALAT1)、lentiviral-pEF-1a/Puro-SATB2(Lenti-SATB2)、lentiviralpGLVU6/Puro-sh-NC(sh-NC)、lentiviralpGLVU6/Puro-sh-MALAT1(sh-MALAT1)、miR-NC 和miR-34c mimic(miR-34c)均购自上海GenePharma 公司,油红O 和茜素红购自美国Sigma 公司,FITC-CD44 抗体、FITCCD29 抗体、PE-CD90 抗体、PE-CD105 抗体和PE-vWF 抗体购自美国BD 公司,Runx2 抗体、OPN 抗体和OCN 抗体购自英国Abcam 公司。倒置相差显微镜购自日本Nikon 公司,实时荧光定量PCR 仪购自瑞士Roche 公司,微量分光光度计购自美国Thermo Scientific 公司。
1.2 细胞培养ADSCs 和HEK-293T 细胞用含10% FBS、100 IU·mL-1青霉素和100 mg·L-1链霉素的DMEM 培养基中,于37℃、5% CO2条件下培养。
1.3 成骨细胞分化诱导诱导ADSCs 成骨分化:当ADSCs 长至80%~90%密度时,将培养基替换为成骨细胞特异性诱导培养基(含10%FBS,10 mmol·L-1β-甘油磷酸钠,0.1μmol·L-1地塞米松和0.2 mmol·L-1抗坏血酸磷酸的低糖DMEM),每2 d 更换1 次培养基,于37℃、5%CO2条件下培养0、3、7、14 和21 d。诱导ADSCs成脂分化:当ADSCs 长至80%~90%密度时,将培养基替换为成脂细胞特异性诱导培养基(含10%FBS,10 mmol·L-1β-甘油磷酸钠,1 μmol·L-1地塞米松,0.5 mmol·L-13-异丁基-1-甲基黄嘌呤,10 μmol·L-1胰岛素和200 μmol·L-1吲哚美辛的低糖DMEM),每2d更换1 次培养基,于37℃、5%CO2条件下培养14 d。
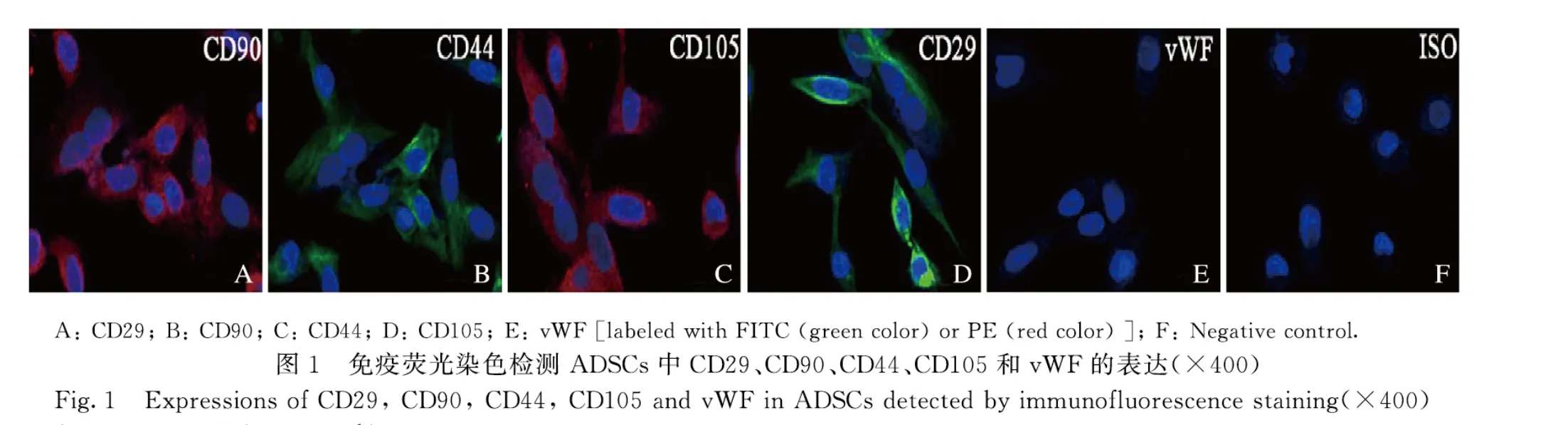
1.4 免疫荧光染色检测ADSCs 中CD44、CD29、CD90、CD105 和vWF表达ADSCs 成骨诱导培养基培养21d后,弃去细胞培养基,PBS 缓冲液清洗后,4%多聚甲醛固定,0.1% Triton X-100 穿透,10%脱脂奶粉封闭,FITC-CD44 抗体(1∶200)、FITC-CD29 抗体(1 ∶200)、PE-CD90 抗体(1 ∶200)、PE-CD105抗体(1∶200)和PE-vWF 抗体(1∶200)避光孵育2h,DAPI染色,荧光显微镜下观察细胞发光情况。
1.5 油红O 染色法检测细胞脂滴形成ADSCs 弃去成脂诱导培养基,PBS 缓冲液清洗后,4%多聚甲醛固定。PBS 缓冲液清洗细胞后,0.3%油红O室温染色20 min。弃去染液,蒸馏水洗涤后,显微镜观察并拍照。
1.6 ADSCs 中ALP 水平检测ADSCs 弃去成骨诱导培养基,根据BCIP/NBT 碱性磷酸酯酶显色试剂盒说明书检测细胞中ALP 水平,酶标仪405 nm 处检测各组细胞吸光度(A)值,对ALP水平进行定量。计算公式:ALP 水平=[(样品组A 值-空白组A 值)-(对照组A 值-空白组A值)]/(对照组A 值-空白组A 值)。
1.7 RT-PCR 法检测ADSCs 中miR-34c 表达和LncRNA MALAT1、SATB2、Runx2、OPN 及OCN mRNA 表达水平收集转染后的ADSCs,TRIzol法提取样品中的总RNA,分光光度计测定RNA 浓度,逆转录合成cDNA。按照SYBRPremix Ex TaqTMⅡ试剂盒说明书进行RT-PCR 法检测。反应条件:95℃、30 s;95℃、5 s,58℃、30 s,40 个循环;95℃、15 s,58℃、30 s,95℃、15 s。以U6和GAPDH 为内参,采用2-ΔΔCt法计算miR-34c 表达水平和LncRNA MALAT1、SATB2、Runx2、OPN及OCN mRNA表达水平。引物序列见表1。

表1 RT-PCR 法引物序列Tab.1 Primer sequences of RT-PCR method
1.8 细胞转染成骨诱导后的ADSCs 或293T 细胞接种于6 孔细胞培养板,每孔4×105个细胞,待细胞密度达到60%~70% 时,按照Lipofectamine 3000 说明书进行miR-34c 和miR-NC 的转染,终浓度均为60 nmol·L-1。37℃、5%CO2条件下培养48 h。ADSCs 转染慢病毒时,将细胞培养液更换为含6 mg·L-1聚凝胺和感染复数(MOI)=20 的lentiviral-pEF-1a/Puro-NC(Lenti-NC)、lentiviralpEF-1a/Puro-MALAT1(Lenti-MALAT1)、lentiviral-pEF-1a/Puro-SATB2(Lenti-SATB2)、lentiviralpGLVU6/Puro-sh-NC(sh-NC)和lentiviralpGLVU6/Puro-sh-MALAT1(sh-MALAT1)慢病毒的新鲜培养基,37℃、5%CO2条件下培养48 h。
1.9 荧光素酶报告实验检测LncRNA MALAT1与miR-34c 和miR-34c 与SATB2 之间的靶向结合作用miRcode(http://www.miRcode.org/)预测MALAT1 与 miR-34c 的靶向结合位点,TargetScan 7.1(http://www.TargetScan.org/vert_/)预测miR-34c 和SATB2 之间的靶向结合位点。针对LncRNA MALAT1 3'-UTR 端和SATB2 3'-UTR 端序列构建野生型(WT)和突变型(MUT)报告基因质粒。参照“1.8”步骤,将MALAT1-WT 和MALAT1-MUT(或SATB2-WT 和SATB2-MUT)分别与miR-NC 和miR-34c共同转染至HEK-293T 细胞中,48 h 后检测荧光素酶活性。
1.10 茜素红S(ARS)染色检测细胞钙盐沉积弃去ADSCs 成骨诱导培养基,PBS 缓冲液清洗后,4% 多聚甲醛固定。PBS 缓冲液清洗细胞后,0.1%ARS 染色液室温孵育20 min。弃去染液,蒸馏水洗涤。为了定量钙盐沉积,向细胞中加入含有10 mmol·L-1磷酸钠的10%氯化十六烷基吡啶,并用酶标仪检测各样品在562 nm 处的A 值。ARS 水平=[(样品组A 值-空白组A 值)-(对照组A 值-空白组A 值)]/(对照组值-空白组A 值)。
1.11 Western blotting 法检测细胞中Runx2、OPN 和OCN 蛋白表达水平收集转染后的ADSCs 或293T 细胞,BCA 法测定蛋白浓度,取30 μg 蛋白进行SDS-PAGE 凝胶电泳分离蛋白,并将其转至PVDF 膜上。10%脱脂奶粉室温封闭3 h,加入Runx2(1∶1 500)、OPN(1∶1 000)、OCN(1 ∶2 000)和GAPDH(1 ∶2 000),4℃孵育过夜。HRP 标记二抗(1∶2 500)室温孵育1 h 后,ECL 发光、曝光。Image J 分析条带灰度值,以目的蛋白条带灰度值与GAPDH 条带灰度值比值表示目的蛋白表达水平。
1.12 统计学分析采用SPSS 21.0 统计软件进行统计学分析。各组细胞中荧光素酶活性,LncRNA MALAT1、miR-34、SATB2、Runx2、OPN 和OCN 表达水平,ALP 和ARS 水平均以表示,2 组间样本均数比较采用两独立样本t检验,多组间样本均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
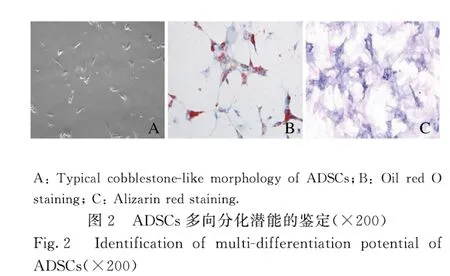
2.1 ADSCs 的特征和多能分化潜能的鉴定ADSCs 中间充质干细胞标记物CD29、CD90、CD44 和CD105 呈阳性表达,而内皮细胞标记物vWF 呈阴性表达(图1A~F);同时细胞具有长丝状结构(图2A),表明该细胞是ADSCs。油红O 染色法和ALP 染色检测结果显示:在成脂或成骨诱导条件下,ADSCs 中有红色脂滴形成(图2B)和橘红色钙盐沉积(图2C)。
2.2 ADSCs 成骨分化过程中LncRNA MALAT1、miR-34c、SATB2、Runx2、OPN 及OCN mRNA 表达水平与第0 天比较,ADSCs 成骨诱导第3、7、14 和21 天后细胞中LncRNA MALAT1 和SATB2及成骨标记物Runx2、OPN 和OCN mRNA 表达水平均明显升高(P<0.05),miR-34c mRNA 表达水平明显降低(P<0.05)。见图3。
2.3 各组细胞中LncRNA MALAT1、Runx2、OPN 和OCN蛋白表达水平及ALP 和ARS 水平与Lenti-NC 组比较,Lenti-MALAT1 组ADSCs 中Runx2、OPN 和OCN 蛋白表达水平明显升高(P<0.01),见图4A,LncRNA MALAT1 蛋白表达水平明显升高(P<0.01),见图4B,ALP 和ARS 活水平明显升高(P<0.01),见图5和图6;与sh-NC 组比较,sh-MALAT1 组ADSCs 中Runx2、OPN 和OCN 蛋白表达水平明显降低(P<0.01),见图4A,MALAT1 蛋白表达水平明显降低(P<0.01),见图4B,ALP 和ARS 水平明显降低(P<0.01),见图5和图6。
2.4 荧光素酶报告实验中各组 ADSCs 中miR-34c、Runx2、OPN 和OCN 表达水平及ALP 和ARS 水平LncrRNA MALAT1 与miR-34c 结合位点见图7A。荧光素酶报告实验结果显示:与miRNC 组比较,miR-34c 转染后MALAT1-WT 组荧光素酶活性明显降低(P<0.01),MALAT1-MUT组荧光素酶活性差异无统计学意义(P>0.05,见图7B)。与miR-NC+Lenti-NC 组比较,miR-34c+Lenti-NC 组ADSCs 中miR-34c 表达水平明显升高(P<0.01,见图7C),LncRNA MALAT1 表达水平明显降低(P<0.05,见图7C),Runx2、OPN和OCN 蛋白表达水平明显降低(P<0.01),见图8,ALP 和ARS 水平明显降低(P<0.01,见图9和图10,miR-34c+Lenti-MALAT1 组ADSCs 中miR-34c、MALAT1 表达水平及Runx2、OPN 和OCN 表达水平,ALP 和ARS 水平差异无统计学意义(P>0.05)。
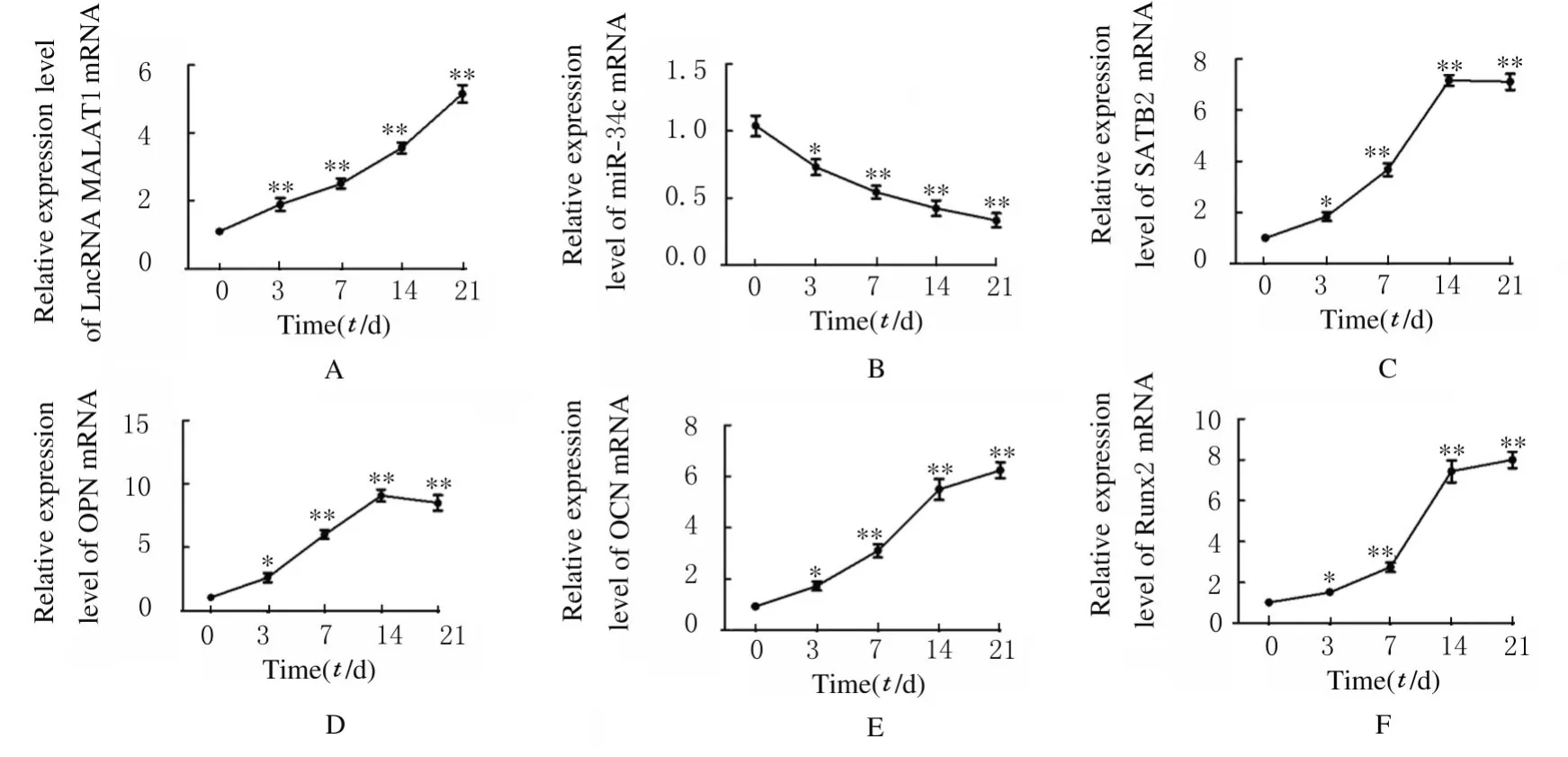
图3 成骨分化过程中ADSCs 中LncRNA MALAT1(A)、miR-34c(B)、SATB2(C)、OPN(D)、OCN(E)和Runx2(F)mRNA表达水平Fig.3 Expression levels of LncRNA MALAT1(A),miR-34c(B),SATB2(C),OPN(D),OCN(E),and Runx2(F)mRNA in ADSCs during osteogenie differentiation
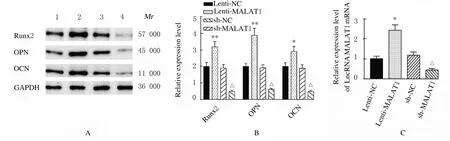
图4 各组ADSCs 中LncRNA MALAT1、Runx2、OPN 和OCN 蛋白表达电泳图(A)和直条图(B,C)Fig.4 Electrophoregram(A)and histogram(B,C)of expressions of MALAT1,Runx2,OPN and OCN proteins in ADSCs in various groups
2.5 miR-34c 与SATB2 结合位点和靶向结合及LncRNA MALAT1、miR-34c 和SATB2 表达水平miR-34c 与SATB2 结合位点见图11A。荧光素酶报告实验结果显示:与miR-NC 组比较,miR-34c 转染后SATB2-WT 组荧光素酶活性明显降低(P<0.01),SATB2-MUT 组荧光素酶活性差异无统计学意义(P>0.05),见图11B;与miR-NC+Lenti-NC 组比较,miR-NC+Lenti-SATB2 组ADSCs 中SATB2 mRNA 表达水平明显升高(P<0.01),见图11C;Runx2、OPN 和OCN 蛋白表达水平明显升高(P<0.01),见图12;ALP 和ARS水平明显升高(P<0.01),见图13和图14;miR-34c+Lenti-SATB2组LncRNAMALAT1表达水平明显降低(P<0.05),miR-34c 表达水平明显升高(P<0.01),见图 11C;SATB2、Runx2、OPN 和OCN 蛋白表达水平及ALP 和ARS水平差异无统计学意义(P>0.05)。
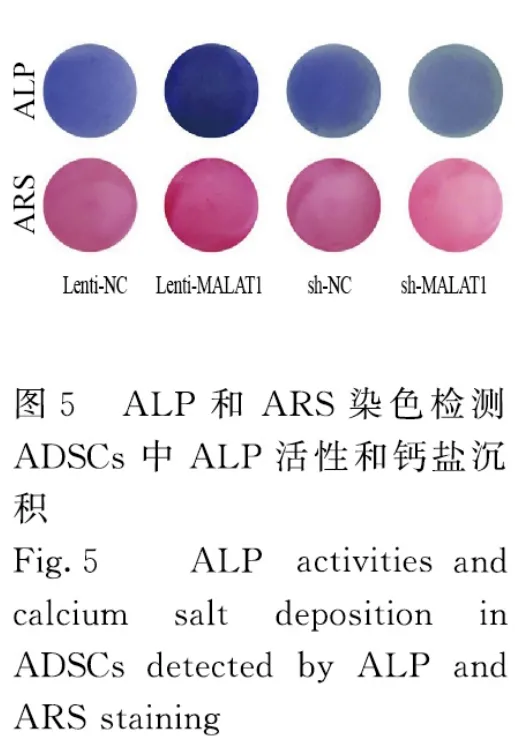
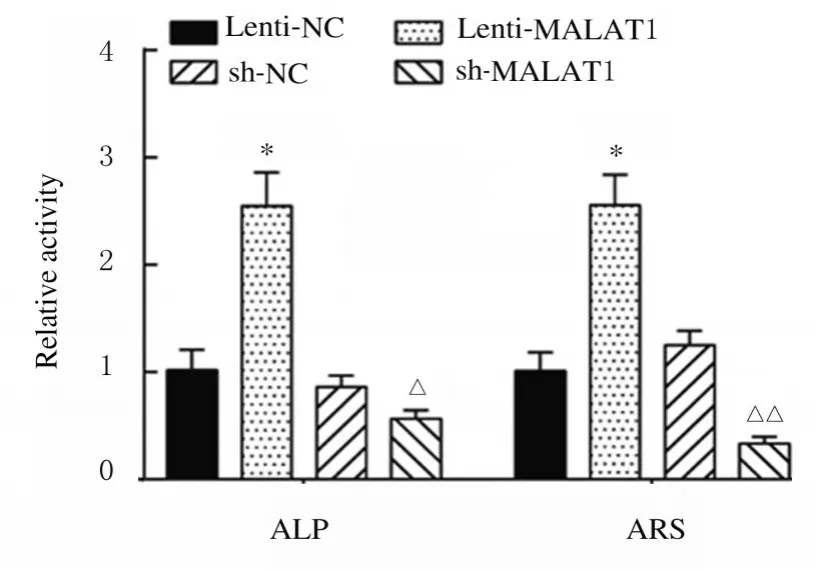
图6 各组ADSCs 中ALP 和ARS 水平Fig.6 Levels of ALP and ARS in ADSCs in various groups
3 讨论
ADSCs 是位于脂肪组织中的再生细胞,具有多向分化潜能[11]。ADSCs 可通过脂肪细胞置换促进组织新陈代谢和血管生成[12]。BMSCs 是骨再生的细胞来源,最近研究[13]表明: BMSCs 的增殖能力和成骨分化能力随年龄和骨质疏松程度的增加而降低,而ADSCs 在老年和骨质疏松情况下成骨分化能力不变。因此,ADSCs 成骨分化机制受到越来越多的关注。LncRNAs 是一种转录本长度超过200nt 的非编码RNA,参与多种生物学过程,包括表观遗传调控、RNA衰变、细胞分化和转录[14]。研究[15]表明:LncRNA 在调节骨骼系统相关的生物学活性方面(骨质疏松症和骨关节炎)具有重要作用。LncRNA MALAT1 通过调节miR-214/ATF4 轴促进成骨分化[16]。
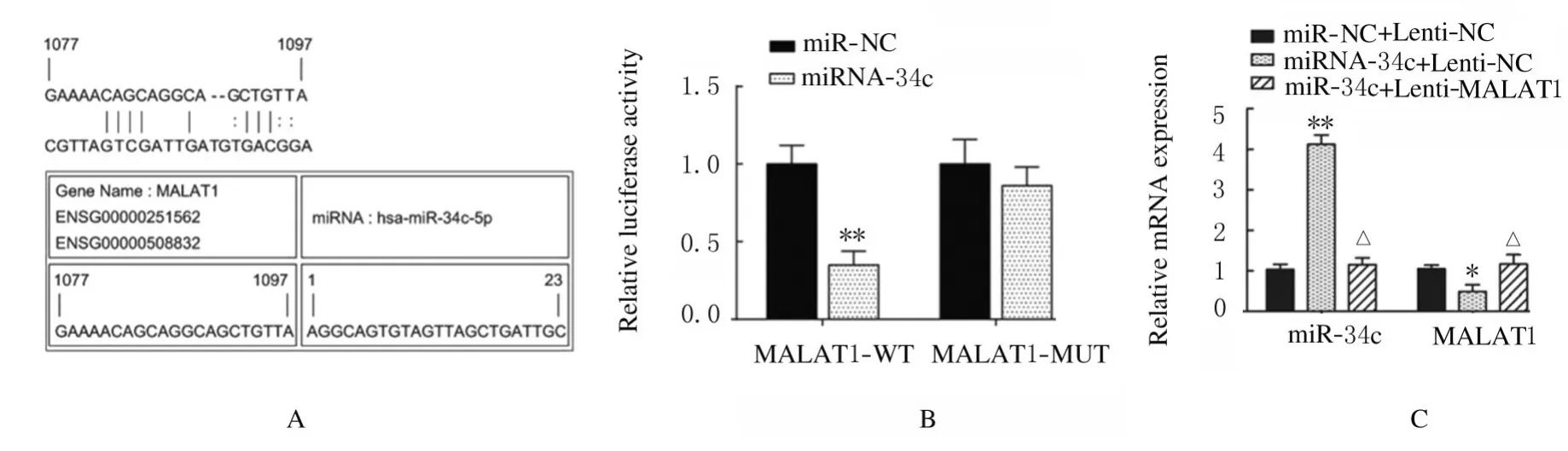
图7 miRcode、荧光素酶报告实验和RT-PCR 法检测各组细胞中miR-34c 和LncRNA MALAT1 的靶向结合(A)及各组细胞中荧光素酶活性、miR-34c 和MALAT1 mRNA 表达水平(B,C)Fig.7 Targeted binding of miR-34c and MALAT1(A)and activities of luciferase expression levels of miR-34c and LncRNA MALAT1 in cells in various groups(B,C)detected by miRcode,luciferase report experiment and RT-PCR methods

图8 Western blotting 法检测共转染组ADSCs 中Runx2、OPN 和OCN 蛋白表达电泳图(A)和直条图(B)Fig.8 Electrophoregram(A)and histogram(B)of expressions of Runx2,OPN and OCN proteins in ADSCs in co-transfection groups detected by Western blotting method


图10 共转染组ADSCs 中ALP 和ARS 水平Fig.10 Levels of ALP and ARS in ADSCs in cotransfection groups
研究[17]表明:LncRNA 在成骨-成脂谱系中起表观遗传调控作用。LncRNA MIAT1 促进ADSCs的成骨分化并逆转炎症的不良反应[18]。本研究结果显示:在ADSCs 成骨分化过程中,MALAT1 的表达水平升高,MALAT1 正向调控ADSCs 成骨分化,这与之前的研究结果一致。研究[19]表明:miRNA 参与调节成骨细胞和破骨细胞分化过程,如miR-221-5p 通过靶向smad3 抑制BMSCs 成骨分化;miRNA-429 通过靶向SCD-1 抑制氧化应激下人BMSCs的成骨分化[20]。lncRNA 和miRNA 间 的相互作用参与成骨分化过程,GAO等[21]研究表明:骨质疏松患者的BMSCs 中MALAT1 表达水平明显降低,成骨诱导BMSCs 后MALAT1 表达水平升高。敲除MALAT1 则抑制BMSCs 的成骨分化,MALAT1 通过靶向miR-143 促进BMSCs 的成骨分化;lncRNA TUG1 通过使miR-204-5p 海绵化而促进成骨细胞的分化,从而导致Runx2 表达上调[22]。LncRNA MEG3 通过靶向miR-133a-3p 抑制BMSCs 的成骨分化[23]。本研究结果显示:在ADSCs 成骨分化过程中,miR-34c 与MALAT1 间存在相互调控作用,MALAT1 通过靶向抑制miR-34c 的表达促进ADSCs 成骨分化。
SATB2 是成骨细胞分化的特异性免疫组织化学生物标记物,对骨和软组织肿瘤发挥重要作用[24]。研究[25]表明:许多特异性miRNAs 通过转化生长因子β(TGF-β)/骨形态发生蛋白(BMP)信号途径参与SATB2 诱导的早期成骨分化。miR-34b/c 靶向调控SATB2[26-27]。miR-383 通过靶向SATB2 负调控大鼠BMSCs 的成骨细胞分化[28]。本研究结果显示:SATB2 可促进ADSCs 成骨分化,miR-34c 通过靶向SATB2 负调控ADSCs 成骨分化。
综上所述,LncRNA MALAT1 通过microRNA-34c/SATB2 轴促进ADSCs 的成骨分化。本研究结果为探究lncRNA 调控ADSCs 成骨分化的机制和骨损伤的治疗提供了新的科学依据。
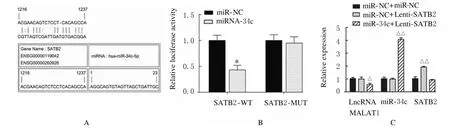
图11 miR-34c 与SATB2 结合位点和靶向结合(A)及各组细胞中LncRNA MALAT1、miR-34c和SATB2 mRNA表达水平(B,C)Fig.11 Binding sites of miR-34c and SATB2 and targeted binding(A)and expression levels of LncRNA MALAT1,miR-34c and SATB2 mRNA in cells in various groups(B,C)
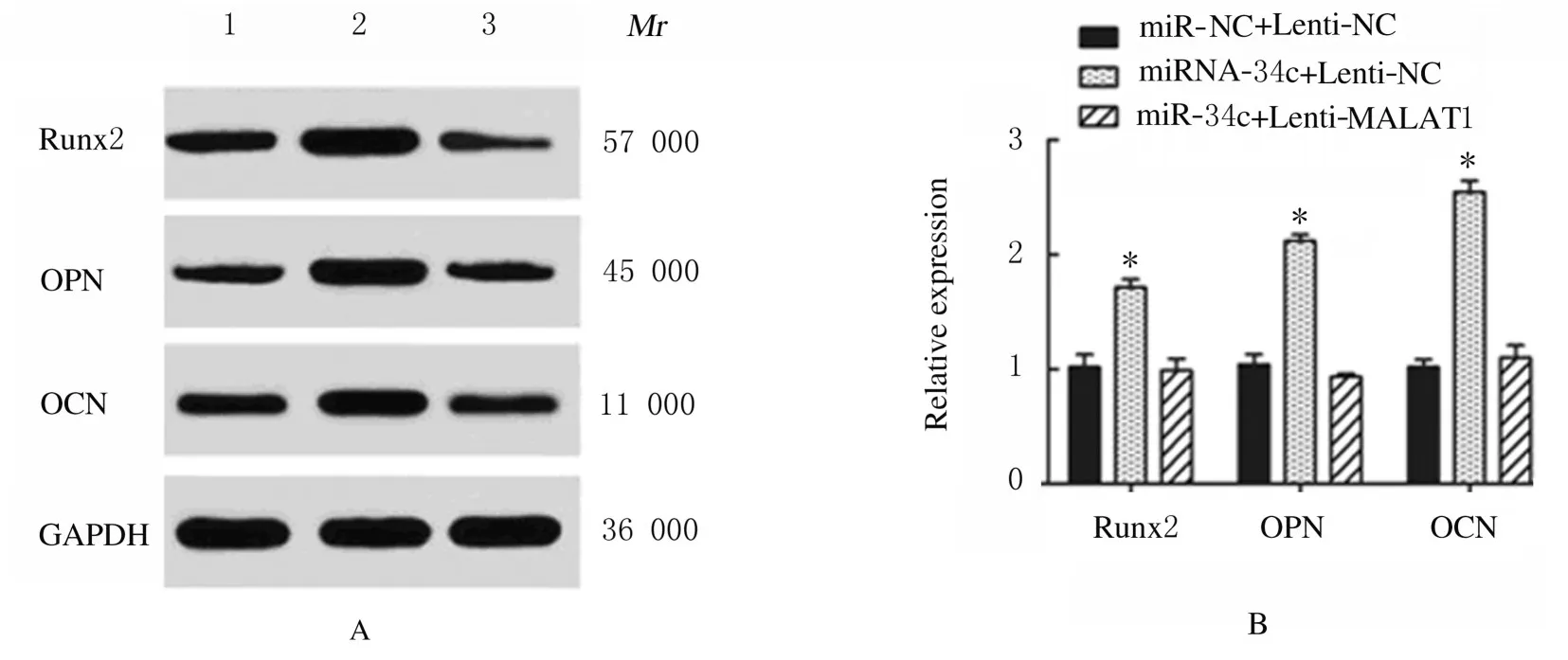
图12 Western blotting 法检测各组ADSCs 中Runx2、OPN 和OCN 蛋白表达电泳图(A)和直条图(B)Fig.12 Electrophoregram(A)and histogram(B)of expressions of Runx2,OPN and OCN proteins in ADSCs in various groups detected by Western blotting method

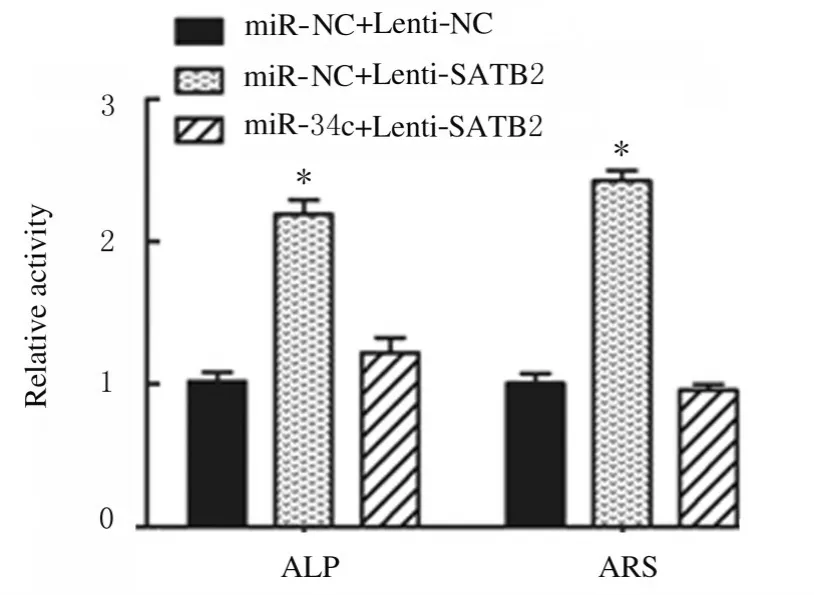
图14 各组ADSCs 中ALP 和ARS 水平Fig.14 Levels of ALP and ARS in ADSCs in various groups

