益生菌对肠易激综合征大鼠内脏高敏感性的作用以及肥大细胞-PAR2-TRPV1通路的影响
田徐露 ,蓝 程,田小兰,崔晓燕 ,王太昊
0 引言
肠易激综合征(Irritable bowel syndrome,IBS)是一种持续发作或间歇性发作的功能性胃肠疾病,具有临床表现多样、发病机制复杂、影响因素众多、病情迁延难愈等特点[1]。近年来,越来越多的证据证实,肠道菌群失调与IBS患者内脏高敏感性、免疫状态低下等因素有关[2]。根据多项指南推荐,益生菌可用于IBS的预防和/或治疗[3],但是其具体的作用机制尚不明确。Kasakura等[4]发现,益生菌可与肥大细胞表面Toll样受体结合,抑制肥大细胞(Mast cell,MC)活化脱颗粒。MC活化与组胺、5-羟色胺等活性物质的释放有关,是介导内脏高敏感性的重要因素[5]。本研究旨在探讨双歧杆菌对IBS大鼠模型内脏高敏感性的影响,以及通过调节蛋白酶激活受体2(Protease activated receptor 2,PAR2)-瞬时感受器电位香草酸受体1(Transient receptor potential vanilloid subfamily member 1,TRPV1)轴抑制MC活化的可能机制,为深入阐述益生菌治疗IBS的作用机制提供新的研究思路。
1 材料与方法
1.1 主要试剂 双歧杆菌三联活菌胶囊购自上海信谊药厂有限公司,国药准字S10950032,规格:0.21 g/粒,含活菌数≥1.0×107CFU,批号:04720170927,4 ℃保存备用。临用前以2 ml生理盐水溶解。5-羟色胺(5-hydroxytryptamine,5-HT)、P物质(Substance P,SP)、促肾上腺皮质激素释放激素(Corticotropin releasing hormone,CRH)、白细胞介素(Interleukin,IL)-10、IL-12酶联免疫吸附测定(Enzyme-linked immunosorbent assay,ELISA)试剂盒购自上海康朗生物科技有限公司;兔抗鼠PAR2单克隆抗体、兔抗鼠TRPV1多克隆抗体、辣根酶标记荧光二抗购自美国Santa Cruz Biotechnology公司;GenElut粪便DNA分离试剂盒、PCR引物、实时荧光定量PCR试剂盒、抑肽酶均购自美国Sigma公司。
1.2 实验动物和分组 30只健康雄性SD大鼠,清洁级,(180±20)g,来源于遵义医学院[许可证号:SCXK(黔)2018-0002],饲以无菌颗粒饲料,自由饮水。适应性饲养1周后,称量大鼠体重,按照随机数字表法将受试大鼠随机分为3组:空白组、模型组和益生菌组,每组10只。
1.3 动物模型的制备及分组干预 模型组和益生菌组大鼠予以醋酸灌肠+束缚应激,参考张杰等[4]方法进行建模:将大鼠麻醉后,经肛门灌入1 ml乙酸,空白组大鼠灌注1 ml 0.9%氯化钠溶液,倒立30 s,再用1 ml磷酸盐缓冲液(0.01 mol/L)冲洗结肠,待苏醒后用胶带捆绑上肢和前胸进行束缚应激,2 h后松开;连用6 d重复上述操作。通过结肠扩张试验(Colorectal distension,CRD)观察大鼠腹部撤离反射(Abdominal withdrawal reflex,AWR)。AWR评分≥1分则造模成功。益生菌组大鼠,每日予以双歧杆菌三联活菌胶囊107CFU/(kg·d)灌胃,1次/d,连用14 d。空白组和模型组大鼠予以等体积生理盐水灌胃。
1.4 大鼠内脏高敏感性检测 待大鼠禁食12 h后,麻醉,经肛门插入带气囊的8F导尿管,置于自制固定装置中限制大鼠转身,分别设定容量为15、30、45、60 mmHg进行球囊扩张,每次持续20 s,间隔1~2 min扩张1次,每个容量值重复扩张3次,取平均值。
1.5 大鼠24 h粪便含水量 收集大鼠24 h的粪便,称量湿重,放入烘箱内烘干2 h,称量干重,粪便含水量(%)=(湿重-干重)/湿重×100%。
1.6 粪便DNA提取以及16s rRNA高通量测序分析 待实验结束后,无菌条件下收集大鼠粪便。采用E.Z.N.A Stool DNA Kit提取粪便样本中的DNA,委托上海生工生物工程有限公司完成测序工作。将下机数据经过滤(设置窗口长度30 bp)后去除低质量reads(≤75%原始read长度)、污染reads(设置adapter和read序列之间的overlap为15 bp,容错率为3)和低复杂度reads,将通过barcode的高质量clean data用于后期分析。肠道细菌丰度(richness)以每克粪便含检测到的细菌基因拷贝数表示。并计算双歧杆菌和大肠埃希菌的比值(B/E值)以代表肠道定植抗力。每个样品重复检测3次。
1.7 ELISA检测 实验结束后,摘眼球采集血液样本;离心取上清,采用双抗体夹心ELISA检测试剂盒测定外周血5-HT、SP、CRH、IL-10、IL-12含量。检测步骤严格按照试剂盒说明书进行操作。
1.8 结肠组织MC甲苯胺蓝染色 实验结束后,截取大鼠距离肛门约8 cm处的结肠组织,置于Carnoy固定液中固定4~6 h,进行石蜡包埋组织切片。经二甲苯脱蜡和梯度(100%~95%)酒精脱蜡至水后,用甲苯胺蓝染色10 min,冰醋酸分化,二甲苯透明,中性树脂封片。MC呈紫红色染色,细胞核呈蓝色。
1.9 脊髓背根神经节(Dorsal root ganglion,DRG)Western blot检测 实验结束后,剥离背部皮肤组织,截取L6-S1椎体,在冰浴中挑取脊髓组织约100 mg,加入蛋白酶裂解液,提取总蛋白,取20 μg蛋白样本,进行10%SDS-聚丙烯酰胺凝胶电泳,脱脂牛奶封闭后,加入PAR2抗体或TRPV1抗体,按1∶50稀释,避光孵育过夜。Pro-light HRP发光试剂盒检测,扫描PAR2和TRPV1蛋白条带积分光密度值(IOD),进行半定量分析。
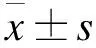
2 结果
2.1 益生菌对大鼠内脏高敏感性的影响 给药14 d后行CRD扩张实验,与空白组比较,模型组大鼠在不同压力扩张情况下AWR评分升高,差异有统计学意义(P<0.05)。益生菌组大鼠AWR评分较模型组显著降低,差异有统计学意义(P<0.05);而且与空白组比较差异无统计学意义(P>0.05)。见表1。
2.2 益生菌对大鼠粪便含水量的影响 入组时,三组大鼠粪便含水量差异无统计学意义(P>0.05),造模后,模型组和益生菌组大鼠粪便含水量明显高于空白组,差异有统计学意义(P<0.05)。而实验结束时,益生菌组大鼠粪便含水量显著低于模型组,差异有统计学意义(P<0.05);但是与空白组比较,差异无统计学意义(P>0.05)。见表2。
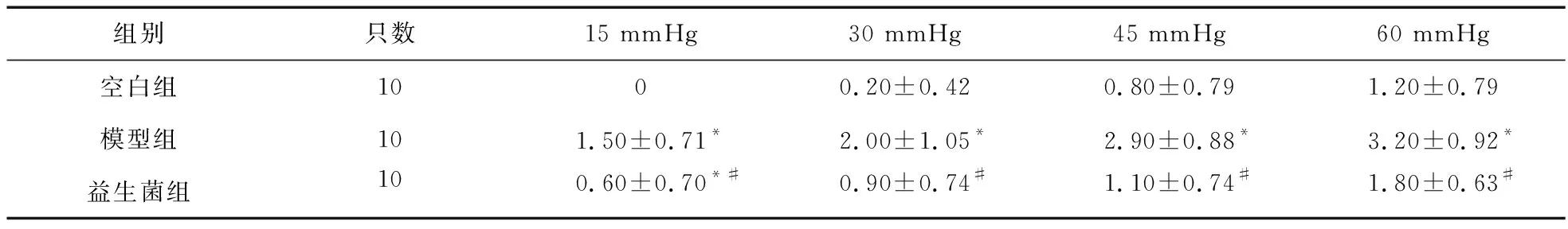
表1 实验结束时三组大鼠不同压力扩张情况下AWR评分
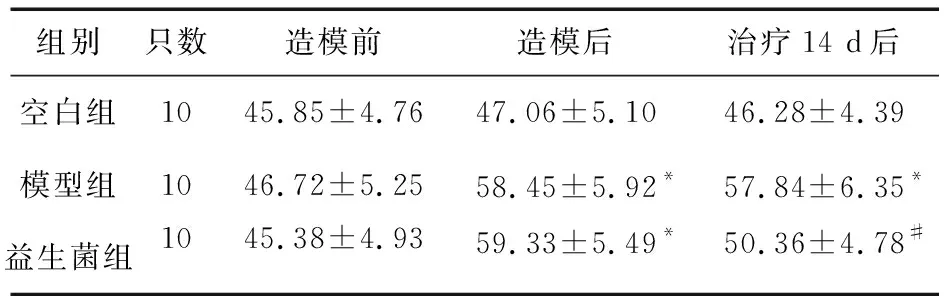
表2 三组大鼠粪便含水量比较(%)
2.3 益生菌对大鼠肠道菌群含量的影响 给药14 d后,与空白组比较,模型组大鼠肠道大肠埃希菌、肠球菌丰度升高,而双歧杆菌、乳酸杆菌丰度和B/E比值降低,差异有统计学意义(P<0.05)。而与模型组比较,益生菌组大鼠肠道大肠埃希菌、肠球菌丰度显著降低,双歧杆菌、乳酸杆菌丰度和B/E比值则显著升高,差异有统计学意义(P<0.05);而且与空白组比较差异无统计学意义(P>0.05)。见表3。

表3 三组大鼠肠道菌群含量比较(%)
2.4 益生菌对大鼠血清中5-HT、SP、CRH、IL-10、IL-12含量的影响 给药14 d后,与空白组比较,模型组大鼠血清5-HT、SP、CRH、IL-12水平升高,而血清IL-10水平降低,差异有统计学意义(P<0.05)。与模型组比较,益生菌组大鼠血清5-HT、SP、CRH、IL-12水平显著降低,而血清IL-10水平显著升高,差异有统计学意义(P<0.05)。见表4。
2.5 益生菌对大鼠结肠组织肥大细胞浸润水平的影响 经甲苯胺蓝染色,与空白组[(1.20±0.92)个/HP]相比,模型组[(3.10±1.29)个/HP]大鼠结肠组织MC浸润明显增加;而益生菌组[(1.50±1.27)个/HP]大鼠结肠组织MC浸润数量相对模型组减少,三组MC浸润数量比较,差异有统计学意义(P<0.05)。见图1。
2.6 益生菌对大鼠DRG组织PAR2、TRPV1蛋白表达的影响 经Western blot法,与空白组相比,模型组大鼠DRG组织PAR2和TRPV1蛋白表达量升高;而益生菌组大鼠DRG组织PAR2和TRPV1蛋白表达量相对模型组减少。见图2和表5。
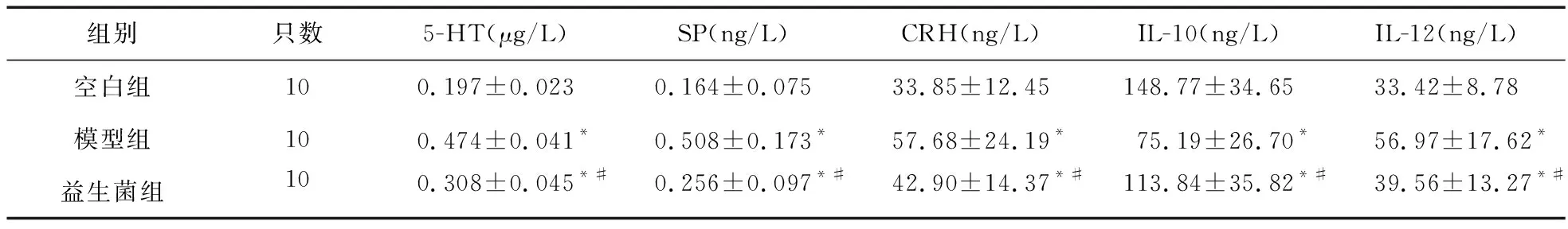
表4 三组大鼠血清中5-HT、SP、CRH、IL-10、IL-12含量比较
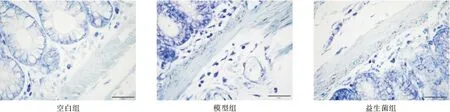
图1 甲苯胺蓝染色法检测各组大鼠结肠组织MC浸润情况(400×)
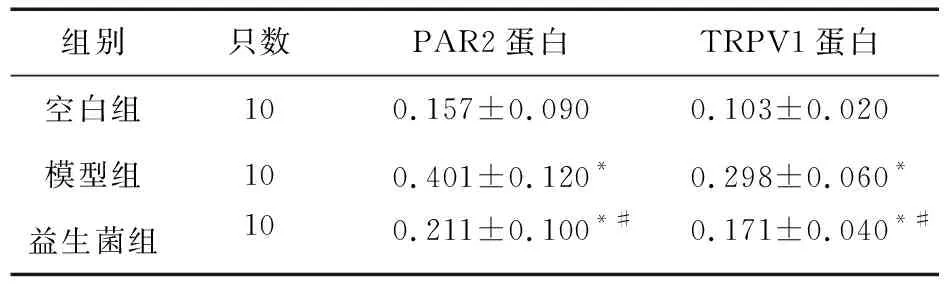
表5 三组大鼠DRG组织中PAR2蛋白和TRPV1蛋白表达比较
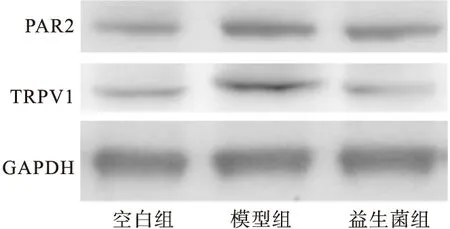
图2 Western blot法检测各组大鼠DRG组织PAR2蛋白和TRPV1蛋白表达情况
3 讨论
IBS是临床上常见的消化系统紊乱综合征,与肠道菌群紊乱密切相关。人体肠道菌群种类多达上千种,绝大多数属于双歧杆菌和类杆菌等专性厌氧菌,这部分属于共生菌[6],此外,中间性菌群占很少一部分,例如,大肠埃希菌、肠球菌等,介于共生菌和致病菌之间,有明显的生理作用,但是也存在潜在的致病性[7],若繁殖失控易损伤肠道黏膜屏障,增加肠道通透性,导致菌群向肠外转移,而且可诱导多种炎症因子分泌及免疫细胞增殖、活化等,释放5-HT、CRH、SP等活性物质,导致内脏高敏感性,进而增加机体对疼痛的感知。益生菌一般包括双歧杆菌、枯草杆菌、乳杆菌等,受胃酸或肠道酶解的影响较小[8]。根据耶鲁和哈佛益生菌工作组发表的益生菌应用共识[9],B级推荐双歧杆菌可用于IBS的治疗。但是目前关于益生菌的作用机制尚不明确,对临床应用有一定的影响。
本研究采用传统的醋酸灌肠方法造模,但是本文的研究目的是探讨益生菌对IBS的治疗机制,因此,需要在造模成功后开始给药;考虑到单纯使用醋酸灌肠,随着时间推移,大鼠内脏高敏感性指标会逐渐减弱,不利于实验的进行。因此,我们在采用醋酸灌肠的同时,加上了束缚应激方法,通过检测实验结束时各组大鼠AWR评分,发现模型组大鼠较好地维持了内脏高敏感性,而且肠道菌群失调情况与空白组也存在显著差异,同时结合大鼠排便情况,证实由该复合因素建立的IBS大鼠模型可支持本实验研究。而与模型组大鼠相比较,不同压力扩张情况下,AWR评分和粪便含水量均明显降低,提示益生菌对于缓解大鼠内脏高敏感性疗效显著。需要说明的是,虽然本研究中益生菌组大鼠AWR评分和粪便含水量与空白组比较差异没有统计学意义,但是考虑到动物模型仅能够模拟IBS的临床症状和病变机制,与临床实际IBS并不完全相同,IBS实际属于慢性进展性疾病,内脏高敏感性属于持续状态,因此,仍旧不能断定益生菌可使得IBS模型大鼠内脏高敏感性恢复至空白组水平,需要通过后续机制研究证明。
近年来,随着神经胃肠病理学的发展,脑-肠轴学说对于阐述IBS的发病机制提供了新的思路。脑肠肽(包括5-HT、CRH、SP等)在内脏高敏感性发生过程中发挥着重要作用[10]。在本研究中,模型组大鼠血清中5-HT、CRH、SP含量较空白组明显升高,说明IBS大鼠内脏高敏感性与中枢神经系统分泌的活性物质有关。例如,陈刚等[11]发现,IBS患者外周血中SP、5-HT、神经肽Y(NPY)水平高于健康对照组,而且与腹泻症状和焦虑抑郁状态有关。CRH是一类介导各种机体应激反应的重要神经递质,主要分布于情感相关区域,通过促进5-HT的释放,增加内脏高敏感性、焦虑、抑郁等状态[12]。SP也是由多肽能神经元分泌的一类信号传导因子,通过激活血小板释放5-HT,导致胃肠蠕动功能紊乱[13]。在本研究中,益生菌组大鼠血清SP、5-HT、CRH水平显著低于模型组,说明益生菌对脑-肠轴异常机制有一定的调节作用,但是与空白组相比仍然较高。
另外,益生菌对肠道菌群紊乱也有显著的改善作用,益生菌组大鼠B/E比值与空白组接近,而且血清IL-10水平升高、IL-12水平降低,说明大鼠肠道内共生菌数量增加,这也可能是改善肠道炎症反应的重要原因。IBS大鼠模型肠道低肠道炎症状态与脱颗粒MC浸润数量也密切相关。MC属于典型的促炎因子细胞,在脑-肠轴信号转导过程中发挥着重要作用[14]。在本研究中,模型组大鼠结肠组织中MC浸润数量显著增加,而且脱颗粒MC多分布于神经元周围,导致机体疼痛阈值或感觉阈值降低。MC释放的活性物质可传入DRG中的PAR2受体,通过与TRPV1蛋白结合,导致神经元兴奋性增加。Cenac等[15]通过敲除小鼠PAR2基因,发现DRG中Ca2+内流及结肠、直肠扩张引起的腹部肌肉收缩都不受MC脱颗粒的影响,说明MC-PAR2-TRPV1轴与IBS内脏高敏感性有关。在本研究中,益生菌组大鼠结肠组织MC浸润数量减少,DRG组织PAR2和TRPV1蛋白表达量也相应降低,说明益生菌对MC-PAR2-TRPV1轴激活有一定的抑制作用。
综上所述,IBS大鼠模型肠道菌群失调导致低炎症状态和内脏高敏感性,而益生菌可通过抑制MC-PAR2-TRPV1轴激活改善IBS大鼠内脏高敏感性,本研究为益生菌作用机制的研究和临床应用的推广提供一定的理论支持。

