血管过氧化物酶1对心肌梗死后心肌纤维化机制的影响
朱 勇,李吉明,高冉冉,杨建中
0 引言
心肌梗死(Myocardial infarction,MI)后发生的心室重构包括心室重量、形态变化和容积增加等,其中以心肌细胞肥大与心肌组织纤维化为心室重构发生病变的主要特征表现[1]。而抑制心肌梗死后心肌组织纤维化过程是治疗心肌梗死的一个重要靶点。成纤维细胞是导致心肌纤维化的重要效应细胞[2-4],在心肌梗死过程中,大量成纤维细胞增殖分化活性增高,代偿性修缮心肌梗死部位,但此现象可能会使心脏丧失心肌顺应性从而导致心肌纤维化[5-7]。心肌纤维化会使心肌僵硬度逐步增加,心室舒张功能逐步减退,引起左心室扩张和心力衰竭,诱发恶性心律失常,甚至猝死。另外,成纤维细胞向肌成纤维细胞的分化是心肌纤维化发展的关键过程[5],肌成纤维细胞大量表达α平滑肌肌动蛋白(α-SMA),其具有更强的收缩能力及分泌能力,这与心肌纤维化等病理损伤密切相关[8-9]。同时,大量文献已证实,成纤维细胞或肌成纤维细胞可以通过分泌一些可溶因子来调控心肌细胞的结构及功能,进而调控心肌细胞的生理功能[10-13]。
血管过氧化物酶1(Vascular peroxidase 1,VPO1)是一种主要存在于心血管系统中的含有血红素的过氧化物酶。VPO1类似于髓过氧化物酶(Myeloperoxidase,MPO),能将过氧化氢(H2O2)催化成为氧化性更强的次氯酸(HOCl),从而促进机体细胞损伤[14]。VPO1主要在血管内皮细胞、平滑肌细胞和心肌细胞中表达,在调节心血管疾病的发展中起着重要的信号传导作用[15-17]。有研究表明,VPO1 在血管紧张素Ⅱ诱导血管平滑肌细胞(Vascular smooth muscle cells,VSMCs)增殖中起着重要作用[18]。
目前,MI后心肌纤维化的发病机制尚未完全明确,心肌纤维化发生与发展过程中有许多细胞和分子参与,调控机制受许多因素的影响,形成机制较为复杂。本实验探究了MI后VPO1对心肌纤维化机制的影响,通过特异性沉默VPO1 的表达,研究其对心肌成纤维细胞增殖分化以及心肌纤维化标志物Ⅰ型胶原(CollagenⅠ)合成的影响,为临床治疗心肌纤维化提供基础。
1 材料与方法
1.1 材料 SPF级成年雄性SD大鼠,鼠龄7周左右,体重180~220 g,由新疆医科大学实验动物中心提供,实验动物许可证号:SYXK(新)20170006。主要试剂:免疫组织化学检测试剂盒(PV 6000G)、细胞计数试剂盒(CCK-8)和Masson 染色试剂盒购自日本Dojindo公司,siRNA 与NC siRNA购自上海吉玛生物有限公司,青霉素、链霉素、60%胰蛋白酶/EDTA和40%胶原酶Ⅱ购于美国 Sigma 公司,兔抗α-SMA、兔抗VPO1、山羊抗兔IgG、抗Ki67和抗 Collagen Ⅰ抗体均购于美国Millipore公司,抗GAPDH和抗3-Cl Tyr抗体购于荷兰Hycult Biotech公司等。
1.2 方法
1.2.1 分组及造模 将40只SD大鼠随机分为2组:假手术组(sham组,10只)和模型组(30只),制作大鼠心肌梗死模型,用2%异氟烷将大鼠麻醉,仰卧固定、胸部备皮,于胸骨左侧第4、5肋间开胸,剪开心包,暴露心脏,在距左冠状动脉起点处 2~3 mm用手术线结扎冠状动脉左前降支,关闭胸腔,缝合胸壁。sham组大鼠只做手术不结扎冠状动脉。术后每只大鼠注射40 000 U/d 的青霉素,防止伤口感染。术后7 d内,模型组有3只大鼠死亡,假手术组无大鼠死亡,检测两组大鼠的心脏超声情况以及左心室组织结构及功能状态的变化。分别在MI后第7、14、28天,随机选择6只大鼠,取其心脏组织进行实验。
1.2.2 Masson 染色 心脏组织用4%多聚甲醛固定,修剪包埋,浸于梯度乙醇进行脱水,二甲苯透明,石蜡包埋切片(厚度约为4 μm)。石蜡切片脱蜡至水后,用weigert氏苏木溶液处理10 min,1%盐酸乙醇分化1 min,蒸馏水冲洗25 min,丽春红酸性品红液染色10 min,l%磷钼酸水溶液分化5 min,2%亮绿染液染色5 min,1%冰醋酸水溶液浸洗1 min。随后分别用95%乙醇、无水乙醇脱水,二甲苯透明,中性树胶封片。在光学显微镜下观察并进行图像采集及分析。
1.2.3 免疫荧光染色 将心脏组织在OCT化合物中冷冻并切成8 μm的纵切片。将切片解冻,用4%甲醛溶液固定20 min,并用0.2%Triton X-100透化20 min。用10%山羊血清室温封闭30 min,并分别与兔抗α-SMA (1∶200)、兔抗VPO1 (1∶50)和兔抗MPO (1∶50)抗体在4 ℃下孵育过夜。加入TRITC 标记的山羊抗兔IgG (1∶200)作为二抗,在室温下孵育2 h。细胞核用DAPI染色10 min后封片。使用荧光显微镜观察并进行图像采集、分析。
1.2.4 免疫组织化学染色 将石蜡切片脱蜡至水,0.01 mol/L枸橼酸盐缓冲液进行抗原修复,3% H2O2+甲醇溶液去除内源性过氧化物酶,分别加抗3-Cl Tyr (1∶100)和抗Ki67 (1∶200)为第一抗体,4 ℃过夜。PBS冲洗3 min,冲洗3次。加二抗,室温孵育10~15 min。PBS冲洗3 min,冲洗2次,DAB显色。经复染,脱水,透明,封片,在电子显微镜下观察,进行图像采集与分析。
1.2.5 心肌成纤维细胞的分离和培养 将左心室剪碎,用60%胰蛋白酶/EDTA和40%胶原酶II在37 ℃下消化。将细胞悬浮液离心,重悬于含15%胎牛血清-100 U/ml青霉素-100 μg/ml 链霉素的DMEM溶液中,并在37 ℃、5%CO2的标准培养条件下培养,使成纤维细胞附着在培养板上,第1~3代用于实验。
1.2.6 Western blot实验 RIPA 裂解缓冲液提取培养的心肌成纤维细胞总蛋白,BCA法进行蛋白浓度测定,电泳。SDS-PAGE电泳分离蛋白,切胶并转移至PVDF膜,5%脱脂奶粉室温封闭2 h,加入抗VPO1 (1∶1 000),抗α-SMA (1∶1 000),抗3-Cl Tyr (1∶500),抗GAPDH (1∶5 000),抗Collagen I (1∶1 000)抗体,在4 ℃下过夜。TBST 漂洗 PVDF膜3次,10 min/次,将PVDF膜与HRP标记的二抗常温孵育1 h,TBST洗膜3次后,滴ECL发光液进行曝光,使用Image-Pro Plus 6.0分析蛋白质灰度值。
1.2.7 siRNA沉默VPO1 将24只健康SD大鼠随机分为2组:siRNA组、NC siRNA组,每组12只。造模的前1周给两组大鼠分别静脉注射VPO1小干扰RNA(siRNA)或阴性对照(NC siRNA),1周3次。将siRNA组随机分为2组:si-VPO1 MI组、si-VPO1 sham组,每组6只。si-VPO1 MI组进行冠状动脉结扎手术,si-VPO1 sham组大鼠不结扎冠状动脉,其他操作均与MI组相同。术后接着对大鼠注射si-VPO1或NC siRNA,每周3次,持续到第28天。将NC siRNA组随机分为NC siRNA MI组和NC siRNA sham组,除在术后给大鼠注射NC siRNA外,其他操作步骤均与siRNA组相同。所有大鼠均在第28天取心脏组织进行后续的Western blot、Masson染色以及细胞增殖分化实验。
1.2.8 CCK8 检测细胞增殖 收集siRNA或NC siRNA处理后,分离培养至对数生长期的心肌成纤维细胞,用 0.5%胰酶消化1~2 min后,用含10%FBS培养基重悬。在96孔板中加100 μl细胞悬液,在37 ℃、5% CO2培养箱里培养24 h。各孔加入10 μl CCK-8溶液孵育2 h,在酶标仪上450 nm处检测吸光光度值。
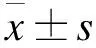
2 结果
2.1 MI后心肌纤维化期间VPO1表达上调 与假手术大鼠相比,MI组大鼠左心室收缩压降低,左心室压力最大变化速率减小,左室末期舒张压升高,心功能明显降低,说明MI形成稳定,MI大鼠模型建立成功。
通过进一步Masson染色观察发现,sham组心肌细胞排列整齐,细胞间质略有少量胶原纤维,而MI组残留心肌细胞数目少,肥大细胞排列紊乱,部分心肌纤维溶解或断裂,且随着MI后时间推移,蓝色胶原纤维也随之增加。见图1。
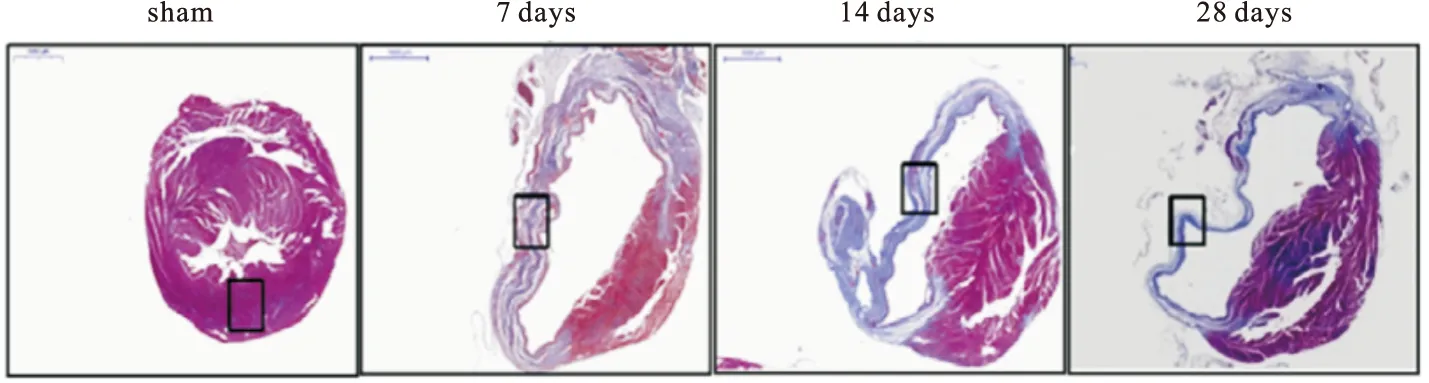
图1 各处理组大鼠心肌梗死区的Masson染色结果(比例尺:50 μm)
经MI处理后,第7、14、28天,MPO和VPO1的免疫荧光为红色,α-SMA的免疫荧光为绿色,且VPO1和α-SMA在心肌梗死的纤维化区域共定位。另外,MPO在MI后第7天荧光很亮,但第14天荧光较弱,到第28天时免疫荧光染色结果与sham 组相比无显著差异。见图2。
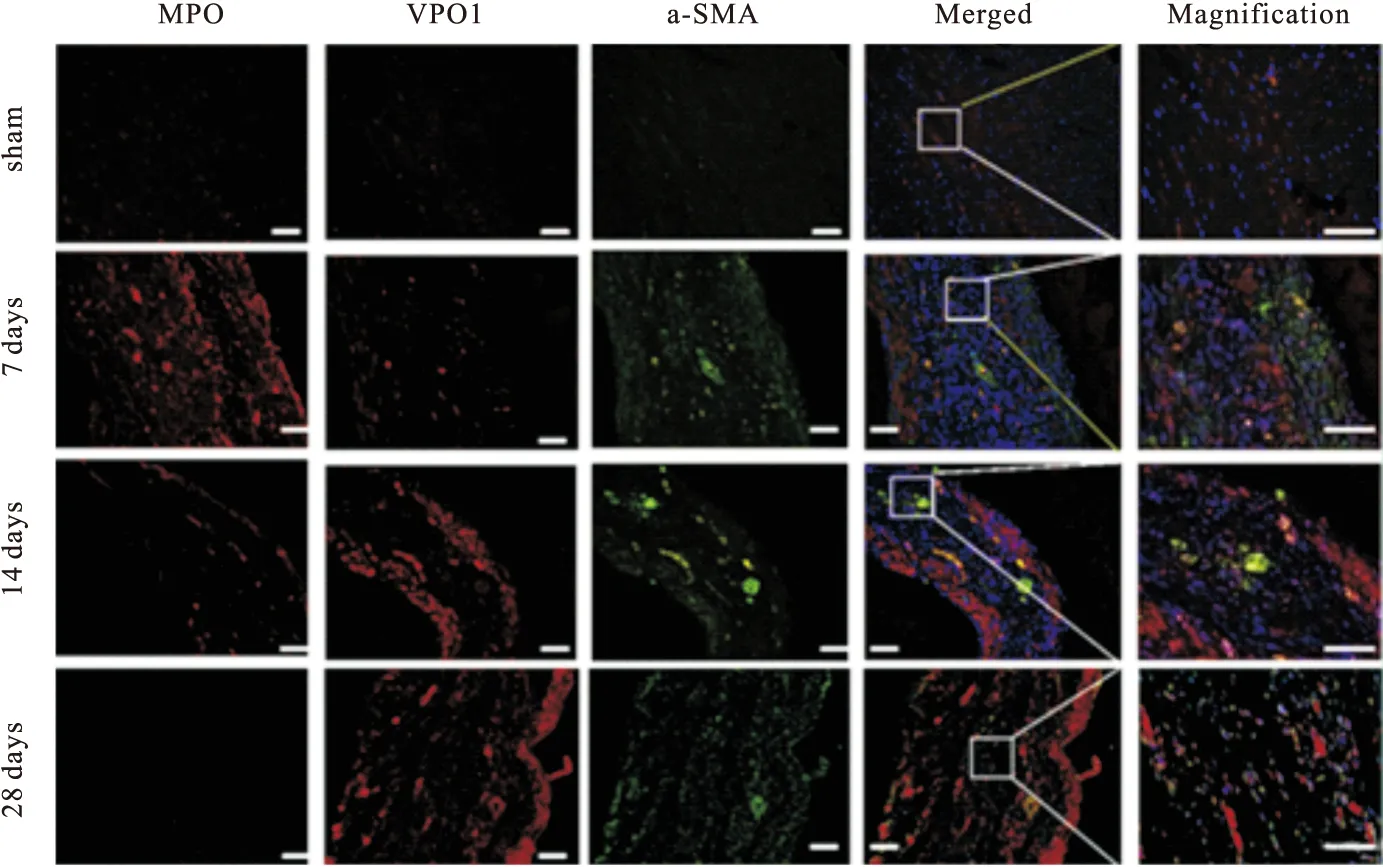
图2 各处理组大鼠心肌梗死区的荧光染色结果(比例尺:50 μm)
Western blot结果显示,与sham组相比,在MI后第14天和第28天,VPO1表达逐渐增加(P<0.01),α-SMA和Collagen I的表达显著升高(P<0.01)。与sham组相比,在MI第7天MPO的表达增加2倍,但第14天开始下降,第28天与sham组相比差异无统计学意义(P>0.05)(图3A、B)。结合免疫荧光染色结果和Western blot结果推测,VPO1可能在心肌梗死后的心肌纤维化阶段比MPO发挥更为重要的作用。
图3 Western blot检测各处理组的心脏组织中蛋白水平
免疫组化染色后发现,与sham组相比,MI组均有大量棕褐色着色细胞的表达(图4A)。3-Cl Tyr 在MI后第7天,表达水平显著增加(P<0.01),在第14天和第28天略有下降,但与sham组相比表达仍上升(P<0.05)。MI后,在第7天及第28天,Ki67阳性细胞表达量增加(P<0.01),且均高于sham组(图4B)。由此可见,3-Cl Tyr和Ki67表达的研究结果与VPO1的结果相一致,推测VPO1可能通过调节心脏成纤维细胞分化、胶原蛋白I合成和细胞增殖来介导心脏纤维化的发展。
2.2 si-VPO1抑制心肌纤维化 为了进一步阐明VPO1在心肌纤维化中的功能作用,使用si-VPO1来沉默VPO1。Western blot结果显示,在MI第28天,与注射si-NC相比,si-VPO1处理后显著抑制VPO1的表达(P<0.01)(图5A)。与si-NC组(13/24,54.2%)相比,si-VPO1组大鼠存活比例较高(14/19,73.6%)(P<0.05)(图5B)。
Masson染色发现,si-VPO1处理的MI组整体胶原沉积少于si-NC处理的MI组(P<0.01)(图6)。
2.3 VPO1在体内诱导心脏成纤维细胞分化和增殖 为了确定VPO1是否是心肌成纤维细胞分化所必需的物质,在 siRNA沉默VPO1实验中分析纤维化标志物。MI后第28天,与si-NC sham组相比,si-NC处理的MI大鼠心脏组织的VPO1、α-SMA、Collagen Ⅰ表达上调(P<0.01)。然而,与si-NC MI相比,用si-VPO1处理MI大鼠后,VPO1、α-SMA、Collagen I的表达被显著抑制(P<0.05或P<0.01),说明si-VPO1可能阻断了MI对VPO1、CollagenⅠ、α-SMA的诱导。见图7。
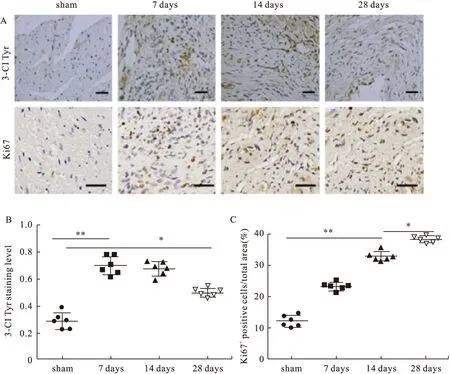
图4 各处理组3-Cl Tyr和Ki67的免疫组化染色水平(比例尺:3-Cl Tyr 50 μm,Ki67 20 μm)
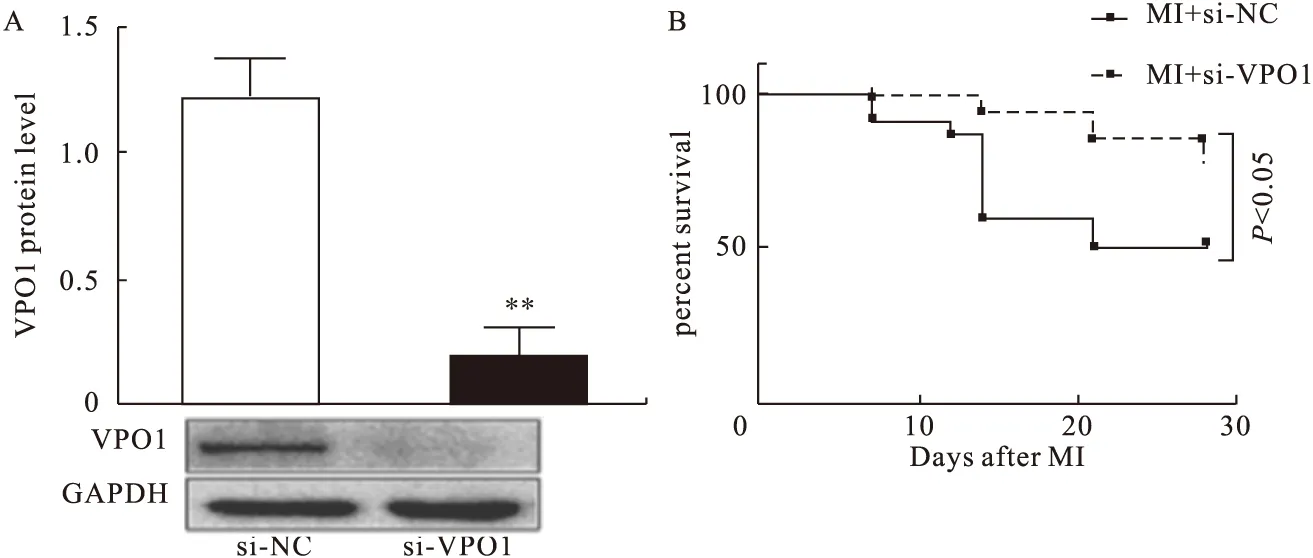
图5 Western blot检测si-VPO1对VPO1表达及大鼠存活率的影响
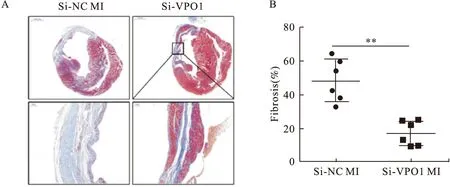
图6 si-NC和si-VPO1处理后Masson染色结果(图6A比例尺:上部1 mm,下部100 μm)
心肌成纤维细胞的增殖是心脏纤维化的发病机制所必需的。MI后第28天,与si-NC sham组相比,si-NC MI组心脏中观察到Ki67阳性细胞显著增加(P<0.01);而si-NC MI组与si-VPO1 MI组相比,si-VPO1 MI处理中Ki67阳性细胞显著减少(P<0.01)(图 8)。结果表明,VPO1可能在体内心肌成纤维细胞的分化和增殖中起重要作用。
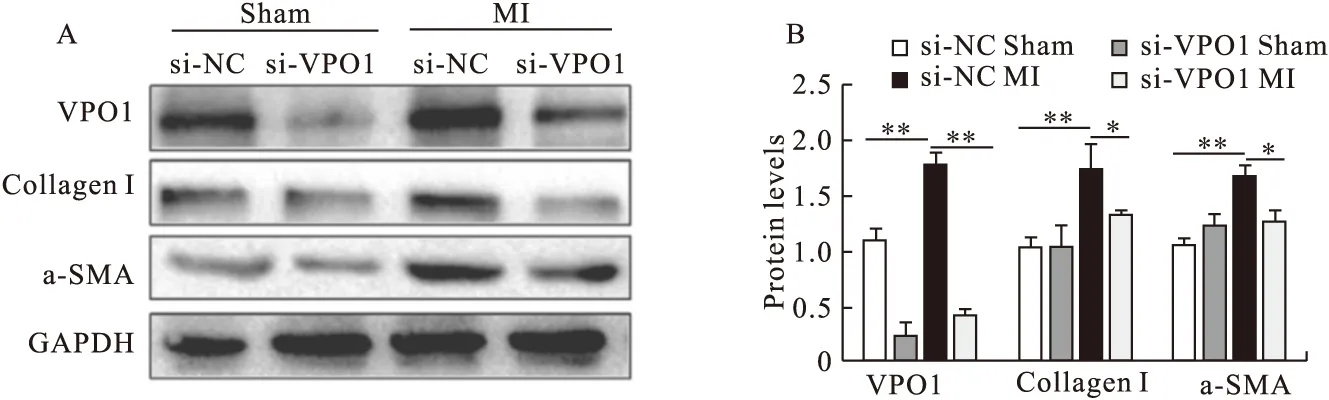
图7 Western blot检测注射si-NC和si-VPO1后心肌组织中VPO1、Collagen I和α-SMA的蛋白表达
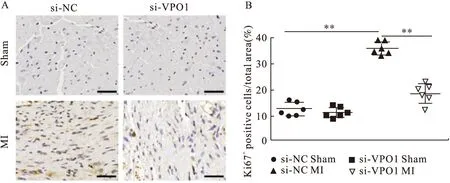
图8 si-NC和si-VPO1处理后心肌组织中Ki67的免疫组化染色结果(图8A比例尺:上部50 μm,下部20 μm)
3 讨论
心肌纤维化是多种心脏疾病发展到一定阶段的共同病变现象,也是MI后心脏重塑的最重要机制[19-20],抑制心肌纤维化有利于心梗后的心室重构[21]。MI后心肌纤维化的发展是一种级联反应,伴随着成纤维细胞分化、增殖、迁移和沉积胶原蛋白等现象。MPO是一种由活化的中性粒细胞和巨噬细胞释放的酶,是一种经过充分研究的过氧化物酶家族成员,产生的HOC1调节心肌梗死后的心脏重塑[22]。同样,VPO1是一种新发现的过氧化物酶家族成员,在心血管系统中高度表达。此外,VPO1可以调节肾纤维化[23]。有研究表明,通过构建小鼠缺血再灌注模型后,VPO1诱导心肌细胞凋亡,而其抑制剂改善了这种现象[24]。本实验发现,在MI的大鼠模型中,VPO1在缺血期间表达逐渐增加,并且随着心肌纤维化程度的加重而增加。在MI的大鼠模型中,VPO1表达显著上调的同时,成纤维细胞向肌成纤维细胞分化的标志物α-SMA和心肌纤维化标志物Ⅰ型胶原(CollagenⅠ)的表达也逐渐上升。在促进心肌纤维化的途径中,心肌成纤维细胞的增殖也是一个重要机制[25-26],Ki67为细胞增殖的一种标记,在细胞凋亡中的S、G2、M期均有表达。本研究中,MI后缺血期间Ki67阳性细胞的数量也在不断增加。
由MPO产生的HOCl会增加左心室扩张并在MI后严重影响心脏功能[22]。有研究表明,MPO表达水平仅在MI后5~7 d达到峰值,随后在没有其他炎症反应的情况下降低[27]。本研究显示,MI后第7天MPO表达增加,随后逐渐降低至与sham组相似的水平。然而,在MI的持续时间内,VPO1表达逐渐上调,第28天仍在上升。3-氯酪氨酸(3-Cl Tyr)是VPO1和MPO产生HOCl的特异性标志物。与sham组相比,MI后第7天,3-Cl Tyr水平显著增加,并且在MI后28 d仍然升高。3-Cl Tyr的升高可能是由于高水平的VPO1表达。因此,推测VPO1可能是心肌纤维化形成和成熟阶段的主要调节因素。
本研究显示,VPO1抑制表达显著减弱了心肌纤维化的程度,大鼠在MI后28 d的存活率显著提高,表明VPO1可被鉴定为MI后心脏重塑和纤维化的关键调节因子。VPO1表达的降低减弱了MI后的心脏纤维化发展,这意味着VPO1可能是潜在的治疗靶点。另外,在抑制VPO1的表达后,心肌成纤维细胞分化和胶原蛋白I沉积也被抑制,并阻止了心肌梗死后心肌纤维化大鼠模型中Ki67阳性细胞数量的增加。
本研究初次证明了VPO1在MI后对心肌纤维化机制的影响。VPO1可能通过调节心肌成纤维细胞分化、胶原蛋白I型合成和细胞增殖来介导心肌纤维化的发展。但VPO1具体参与的作用通路有待进一步探明。此外,VPO1是否可能是MI患者的预后标志物仍然未知,因此,需要进一步研究VPO1作为心脏纤维化生物标志物的临床价值。

