黄连素联合右美托咪定在急性脑梗死大鼠模型中的协同神经保护作用
李艾芳,陈思宇,黄一丹,王 江
0 引言
急性脑梗死(Acute cerebral infarction,ACI)作为一种常见的临床心脑血管疾病,具有很高的发病率和死亡率。其主要是由脑血流量暂时或永久减少造成的,与脑动脉有关[1-2]。目前,溶栓重组组织纤溶酶原激活剂是ACI临床治疗中广泛应用且有效的药物,但其存在很多不良反应[3-4]。右美托咪定(Dex)是一种高度选择性的α2肾上腺素能受体激动剂,具有降低交感神经张力和镇痛作用。研究证明,Dex对脑缺血再灌注损伤发挥保护作用[5-6]。黄连素(BBR)是一种异喹啉衍生的生物碱,在我国有很长的应用史,在局灶性脑缺血和缺血再灌注损伤中发挥保护作用[7-8]。
连接蛋白(Cx)是一种膜蛋白,是细胞间隙连接的重要组成部分[9]。连接蛋白43(Cx43)是脑中表达量最高的Cx,通过间隙连接调节细胞间物质交换和电信号传导,从而调节神经细胞的生长分化和生理功能[9],在中枢神经系统损伤的调节中起着重要作用[10]。水通道蛋白(AQP)对调节脑水平衡和神经系统疾病的临床治疗具有重要意义[11]。AQP4主要在星形胶质细胞、室管膜细胞、软性脑膜、脉络膜丛和大脑下丘核中表达。在早期缺血性卒中的发病过程中,AQP4在脑水肿的形成和消散中起着至关重要的作用[12]。最近研究表明,由自由基、神经元凋亡,兴奋性氨基酸毒性以及脑组织代谢异常引起的损伤和炎症都与ACI的发生和发展有关[13-14]。
本研究采用栓线法建立MCAO大鼠模型,旨在探究黄连素联合右美托咪定是否对MCAO大鼠模型发挥神经保护作用,以期为ACI的有效治疗提供新的科学依据。
1 材料与方法
1.1 实验材料 45只雄性SD大鼠(7~8周,250~280 g)购自新疆医科大学实验动物中心;黄连素、鼠抗GAPDH抗体购自Sigma公司;右美托咪定购自上海恒瑞医药有限公司;BCA蛋白定量试剂盒购自Beyotime公司;蛋白上样缓冲液(5×)、RIPA裂解液、丙二醛(MDA)含量检测试剂盒购自Solarbio公司;超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)ELISA试剂盒购自南京建成生物工程研究所;兔抗Bax、Bcl-2、Cx43和AQP4抗体购自Abcam公司;HRP标记二抗和FITC标记二抗购自北京全式金生物;ECL化学发光检测试剂盒购自北京爱必信生物技术有限公司。
1.2 实验方法
1.2.1 分组 SD大鼠随机分为5组,每组9只:假手术组、模型组、黄连素(BBR)组、右美托咪定(Dex)组、黄连素+右美托咪定(BBR+Dex)组。
1.2.2 ACI模型建立 通过大脑中动脉闭塞(MCAO)[15]建立ACI大鼠模型。将模型组、BBR组、Dex组和BBR+Dex组大鼠用水合氯醛(400 mg/kg)麻醉,仰卧位固定。直肠温度维持在(37.0±0.5) ℃。颈正中线开口,暴露右侧颈总动脉,结扎右侧颈总动脉近心端,颈外动脉残端剪一小口,向颈内动脉插入栓线,并推进至大脑中动脉(插入深度约17~20 mm),直到出现轻微阻力时,梗死区域即为大脑中动脉。1.5 h后,将拴线缓慢拔出。假手术组按照上述方法分离右侧颈总动脉,但不插入栓线。最后,缝合切口,将所有大鼠放回笼中。
1.2.3 动物给药 大鼠按照“1.2.1”项进行分组,BBR组灌胃黄连素(100 mg/kg),Dex组腹腔注射右美托咪定(1 μg/kg),BBR+Dex组灌胃黄连素(100 mg/kg)的同时腹腔注射右美托咪定(1 μg/kg),每天1次,手术后连续给药7 d。模型组和假手术组大鼠灌胃和腹腔注射等量生理盐水。
1.2.4 神经功能缺失体征评分 参考Longa 5分制法[15],手术后24 h进行评分。0分:无神经损伤症状;1分:不能完全伸展对侧前爪;2分:向对侧转圈;3分:向对侧倾倒;4分:不能自发行走,意识丧失。分值越高,说明动物行为障碍越严重。
1.2.5 脑梗死面积评估 在神经功能缺失体征评分后,脱颈椎处死大鼠,从颈椎处剪断颈髓,取出脑组织。-20 ℃条件下速冻20 min后,将脑组织沿冠状位切片。切片置于2% 2,3,5-三苯基四唑氯化物(TTC)染液中,37 ℃孵育30 min。将所有切片于4%多聚甲醛中固定24 h。随后,Image J软件分析脑梗死面积。
1.2.6 抗氧化酶活性和丙二醛含量测定 各组大鼠连续给药7 d后,过量10%水合氯醛(4 ml/kg,腹腔注射)处死大鼠,取大鼠海马组织。根据检测试剂盒说明书分别测定海马组织中MDA的含量,以及SOD、CAT和GSH-Px活性。
1.2.7 冰冻切片免疫荧光染色 各组大鼠连续给药7 d后,过量10%水合氯醛(4 ml/kg,腹腔注射)处死大鼠,取大鼠海马组织。4%多聚甲醛,4 ℃条件下,固定8 h;PBS清洗后,30%蔗糖溶液脱水至组织沉底;OTC胶包埋冰冻组织块,切片机切片;冷丙酮4 ℃固定10 min;PBS清洗后,1.2%双氧水作用30 min;PBS清洗后,0.3% Triton X-100作用30 min;一抗Cx43(1∶400)和AQP4(1∶400) 4 ℃条件下过夜孵育;PBS清洗后,FITC标记的荧光二抗(1∶100)室温孵育2 h;PBS清洗后,荧光显微镜观察并拍照。
1.2.8 Western blot 各组大鼠连续给药7 d后,过量10%水合氯醛(4 ml/kg,腹腔注射)处死大鼠,取大鼠海马组织,RIPA裂解液(含蛋白酶抑制剂)冰上裂解组织30 min,4 ℃、12 000 r/min离心30 min,取上清。BCA蛋白定量试剂盒测定蛋白提取物浓度。向蛋白提取物中加入蛋白上样缓冲液(5×),100 ℃下反应10 min。每组取25 μg样品进行SDS-PAGE分离。将目的条带转印至PVDF膜上,10%脱脂奶粉封闭3 h。加入一抗Bax(1∶1 000)、Bcl-2 (1∶500)、GAPDH (1∶20 000),4 ℃条件下孵育8 h。TBST清洗后,HRP标记二抗(1∶2 000)室温孵育1 h。TBST清洗后,ECL化学发光检测试剂盒检测目的条带并拍照。
2 结果
2.1 黄连素联合右美托咪定对ACI大鼠的协同保护作用 Longa 5分制法进行ACI大鼠神经功能缺失体征评分,TTC染色法检测ACI大鼠脑梗死面积,结果显示,与假手术组相比,模型组大鼠神经功能缺失体征评分和脑梗死面积均显著升高(图1,P<0.05),说明ACI大鼠模型造模成功;与模型组相比,BBR组、Dex组、BBR+Dex组大鼠神经功能缺失体征评分和脑梗死面积均显著减少(图1,P<0.05);与BBR组和Dex组相比,BBR+Dex组大鼠神经功能缺失体征评分和脑梗死面积均显著减少(图1,P<0.05)。

图1 黄连素联合右美托咪定对ACI大鼠的协同保护作用
2.2 黄连素联合右美托咪定减少ACI大鼠海马AQP4和Cx43的表达 采用间接免疫荧光法检测大鼠海马AQP4和Cx43的表达。结果显示,与假手术组相比,模型组大鼠海马AQP4和Cx43的表达显著升高(图2A、B,P<0.05);与模型组相比,BBR组、Dex组和BBR+Dex组大鼠海马AQP4和Cx43的表达显著减低(图2A、B,P<0.05);与BBR组和Dex组相比,BBR+Dex组大鼠海马AQP4和Cx43的表达显著减低(图3A、B,P<0.05)。
2.3 黄连素联合右美托咪定增强ACI大鼠海马抗氧化能力 检测试剂盒分别测定大鼠海马中MDA含量,以及CAT、GSH-Px和SOD活性,结果显示,与假手术组相比,模型组大鼠海马组织中CAT、GSH-Px和SOD活性均降低(图3A、B、C,P<0.05),MDA含量升高(图3D,P<0.05);与模型组相比,BBR组、Dex组和BBR+Dex组大鼠海马组织中CAT、GSH-Px和SOD活性均升高(图3A、B、C,P<0.05),MDA含量降低(图3D,P<0.05);与BBR组和Dex组相比,BBR+Dex组大鼠脑组织中CAT、GSH-Px和SOD活性均升高(图3A、B、C,P<0.05),MDA含量降低(图3D,P<0.05)。
2.4 黄连素联合右美托咪定抑制ACI大鼠海马细胞凋亡 Western blot检测大鼠海马Bcl-2和Bax蛋白表达,结果显示,与假手术组相比,模型组大鼠海马Bcl-2蛋白表达显著降低(图4A,P<0.05),Bax蛋白表达显著升高(图4B,P<0.05);与模型组相比,BBR组、Dex组和BBR+Dex组大鼠海马Bcl-2蛋白表达显著升高(图4A,P<0.05),Bax蛋白表达显著降低(图4B,P<0.05);与BBR组和Dex组相比,BBR+Dex组大鼠海马Bcl-2显著升高(图4A,P<0.05),Bax蛋白表达显著降低(图4B,P<0.05)。
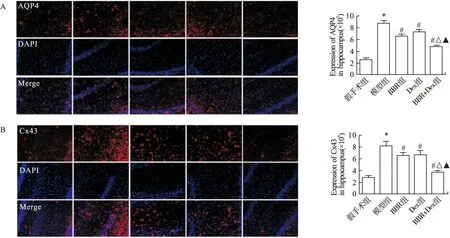
图2 免疫荧光法检测大鼠海马AQP4和Cx43的表达

图3 黄连素联合右美托咪定增强ACI大鼠海马抗氧化能力
3 讨论
ACI是临床上常见的脑血管疾病,是由局部缺血和脑组织坏死引起的。其特点是突然发作,并发症发生率高,致残率高,死亡率高,预后差[16]。当冠状动脉阻塞时可能会发生ACI。流经血管的血液中断导致缺氧和局部缺血,其次是梗死区域厌氧,脑组织能量耗尽,最终导致脑组织坏死或软化[17]。研究表明,MCAO会导致大鼠行为、大脑神经化学和组织学异常,并且可以模拟人类ACI的疾病特征[18]。本研究参考Longa方法[15],通过MACO建立ACI大鼠模型,与假手术组相比,模型组大鼠神经功能缺失体征评分(NDS)和脑梗面积均显著增加,说明ACI大鼠模型造模成功。
右美托咪定可改善脑缺血再灌注损伤后大鼠的神经功能、减少脑梗死面积[19]。黄连素(BBR)预处理可剂量依赖性地减少缺血性中风小鼠的梗死面积、神经功能缺损[20]。本研究应用BBR联合Dex预处理ACI大鼠模型,Longa 5分制法进行ACI大鼠模型神经功能缺失体征评分,TTC染色法检测ACI大鼠模型脑梗死面积,结果显示,与模型组相比,BBR组、Dex组、BBR+Dex组大鼠神经功能缺失体征评分和脑梗死面积均显著降低;与BBR组和Dex组相比,BBR+Dex组大鼠神经功能缺失体征评分和脑梗死面积均显著减少。以上结果说明,BBR和Dex的联合使用与BBR和Dex的单独使用相比,对神经功能恢复和减少脑梗死面积有更明显的效果。
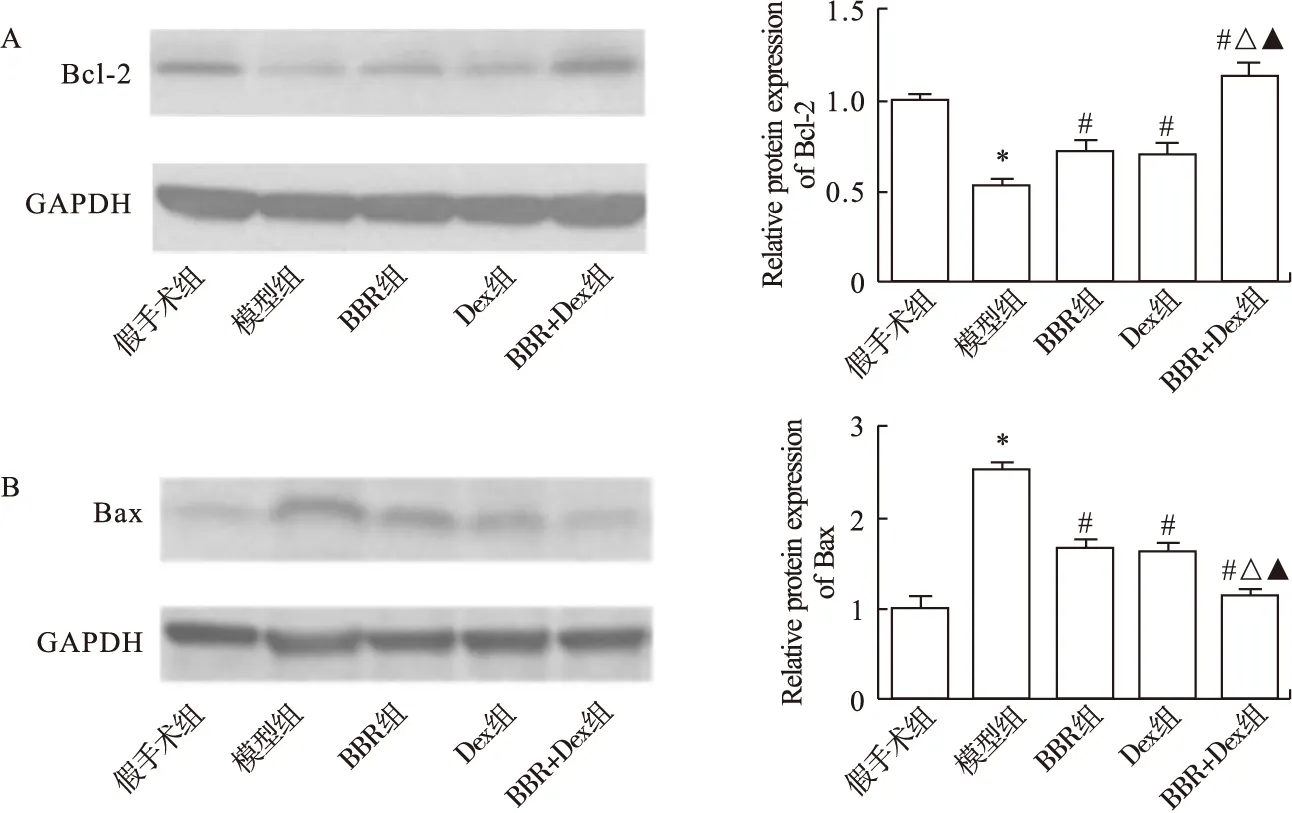
图4 黄连素联合右美托咪定抑制ACI大鼠海马细胞凋亡
缺血后再灌注(I/R)损伤后,脑组织星形胶质细胞中Cx43的表达增加,Cx43通过间隙连接介导凋亡信号从缺血中心区域转移至相邻的缺血半暗带,从而导致神经元细胞死亡,并进一步增加梗死面积[21]。因此,Cx43可作为神经保护作用衡量的标志物。研究表明,AQP4是脑损伤标志物之一,脑缺血后AQP4水平升高,随后导致缺血性脑水肿和继发性脑损伤[22]。已有研究证明,右美托咪定对大鼠脑缺血再灌注损伤具有神经保护作用[23],BBR在阿尔茨海默症和慢性脑灌注不足疾病中发挥神经保护作用[24]。本研究应用间接免疫荧光法检测大鼠海马AQP4和Cx43的表达,结果显示,与假手术组相比,模型组大鼠海马AQP4和Cx43的表达显著升高;与模型组相比,BBR组、Dex组和BBR+Dex组大鼠海马AQP4和Cx43的表达显著减低;与BBR组和Dex组相比,BBR+Dex组大鼠海马AQP4和Cx43的表达显著减低。以上结果说明,BBR和Dex的联合使用与BBR和Dex的单独使用相比,对ACI大鼠的保护作用更为明显。
最近研究表明,由自由基、神经元凋亡、兴奋性氨基酸毒性以及脑组织代谢异常引起的损伤和炎症都与ACI的发生和发展有关[13-14]。研究表明,氧化应激是ACI损害的关键机制, 活性氧(ROS)是缺血性组织损伤的重要组成部分之一,而抗氧化酶是神经细胞保护自身免受ROS毒性侵害的主要防御方法[25]。BBR通过抗氧化作用抑制具有颅脑损伤小鼠的继发性损伤[26]。Dex通过抑制氧化应激,预防脑缺血/再灌注(I/R)损伤[27]。本研究应用检测试剂盒分别测定大鼠海马MDA的含量以及CAT、GSH-Px和SOD活性,结果显示,与假手术组相比,MCAO处理显著减弱大鼠海马抗氧化能力;与模型组相比,BBR、Dex和BBR+Dex处理显著增强大鼠海马抗氧化能力;与BBR 组和Dex组相比,BBR+Dex处理显著增强ACI大鼠海马抗氧化能力。BBR在脑缺血疾病中发挥重要的抗凋亡作用[28],Dex可减少脑缺血再灌注小鼠海马神经元细胞凋亡[19]。本研究发现,与假手术组相比,MCAO处理显著促进细胞凋亡;与模型组相比,BBR、Dex和BBR+Dex处理显著抑制细胞凋亡;与BBR 组和Dex组相比,BBR+Dex处理显著抑制细胞凋亡。以上结果说明,BBR和Dex的联合使用与BBR和Dex的单独使用相比,对增强ACI大鼠海马抗氧化能力和抑制细胞凋亡有更显著的效果。
综上所述,黄连素联合右美托咪定在ACI大鼠模型中发挥协同神经保护作用。而有关黄连素联合右美托咪定发挥协同神经保护作用的具体机制与调控何种信号通路有关,尚有待进一步研究。

