血浆Gd-IgA1浓度与IgA肾病严重程度的相关性及其产生机制研究
戴芹 缪怡 王伟铭
200031上海,上海市徐汇区中心医院肾内科(戴芹),检验科(缪怡);200020 上海,上海交通大学医学院附属瑞金医院肾内科(王伟铭)
IgA肾病(IgAN)目前被认为属于自身免疫性疾病,是全世界范围内最常见的肾小球疾病[1-2],是引起肾衰竭的重要病因[3-4]。由于机体免疫功能异常导致循环中致病性低糖基化IgA1(Gd-IgA1)产生过多,继而发生自身积聚或与循环中的IgG结合形成致病性免疫复合物。肾小球沉积的IgA几乎都是IgA1亚类[5-6],含有Gd-IgA1是IgAN的重要病理特征[7]。Wada等[8]通过111例患者进行回顾性研究发现,IgAN患者血浆及肾组织系膜中Gd-IgA1明显增加,而且血浆Gd-IgA1浓度与患者肾组织中肾小球硬化和小管间质损害程度成正相关。有研究表明Gd-IgA1的产生与两类糖基化酶密切相关:core 1 β1,3-半乳糖基转移酶(C1GalT1,由C1GALT1基因编码)[9]及α-2,6-唾液酸转移酶2(ST6GalNAc-II,ST6GALNAC2基因编码)[10-11],然而导致这两类糖基化酶表达异常的深层机制尚不清楚。
近年来,表观遗传学在疾病发病机制中的作用得到日益关注。赖氨酸残基的翻译后乙酰化已成为所有真核生物中的关键调节机制[12]。组蛋白乙酰化和去乙酰化修饰对基因转录的激活与抑制及对遗传过程的不同时期的转换都起着重要的调控作用[13-14]。本研究拟通过检测和分析不同CKD分期、不同蛋白尿水平的IgAN患者血浆Gd-IgA1浓度,明确Gd-IgA1与IgAN疾病严重程度的相关性。同时首次从表观遗传学角度探讨导致IgA1低糖基化的可能机制,旨在丰富IgAN的发病机制,为IgAN的治疗和干预提供新的思路。
资料与方法
一、研究对象及仪器、试剂
1.研究对象 本研究选取2013年1月至2015年3月于上海交通大学医学院附属瑞金医院肾内科住院的首次肾活检确诊为原发性IgAN患者59例和对照组30例,对照者30例均来自瑞金医院体检站,所有参与者均签署知情同意书。IgAN组:共59例,其中男30例,女29例,年龄分布16~65岁,平均年龄37.2岁,中位年龄为37岁。对照组:共30例,男16例,女14例。年龄分布24~54岁,平均年龄34岁,中位年龄36岁。
原发性IgAN组入选标准如下:(1)首次确诊的IgAN患者,未接受过激素、免疫抑制剂等治疗;(2)年龄为15~65岁;(3)CKD1~4期患者(依据2012年KDIGO指南对CKD的分期标准)。排除标准如下:(1)排除因肿瘤、高血压、代谢性疾病(如糖尿病)、乙肝、自身免疫性疾病(如狼疮、甲亢等)、遗传性肾病、系统性血管炎等继发性因素引起者;(2)肝功能指标异常者;(3)妊娠或哺乳期妇女;(4)有感染或应激情况存在者;(5)严重心血管疾病如心功能不全,恶性高血压,心律失常等患者;(6)CKD5期及已经肾替代治疗的患者。
2.主要仪器和试剂 梯度PCR仪(美国 MJ-research);荧光实时定量PCR仪(美国 Bio-Rad); qRT-PCR逆转录试剂盒(invitrogen);人外周血淋巴细胞分离液(上海普飞);人低糖基化免疫球蛋白A1酶联免疫检测试剂盒(上海晶天);染色质免疫共沉淀试剂盒(millipore);anti-HDAC1 antibody CHIP Grade(美国Abcam);Anti-Histone H3Ac antibody-ChIP Grade(美国Abcam);PCR 引物均由中国铂尚生物有限公司合成,其他试剂均为分析纯产品。
二、方法
1.标本收集 本研究共收集了59例IgAN患者及30例对照者外周血各15 mL至肝素抗凝管中。抗凝血2 000 r/min,离心半径1 500 g,室温离心10 min后收集上清,0.5 mL置EP管分装备用。上述离心后的抗凝血用磷酸缓冲盐溶液(PBS)1∶1稀释后充分混匀后用Ficoll法分离外周血单个核细胞。
2.IgA1及Gd-IgA1检测 采用ELISA法检测IgAN组及对照组血浆IgA1及Gd-IgA1水平。
3.染色质免疫共沉淀(CHIP)检测 按照染色质免疫共沉淀试剂盒的protocol进行实验。第一天:将外周单个核细胞用甲醛交联后超声破碎,检验超声效果,确保DNA的大小为200~1000 bp;第二天:清除超声破碎后的DNA中杂质后用乙酰化抗体与DNA片段进行孵育;第三天:免疫复合物的沉淀及清洗;第四天:DNA样品的回收和纯化;第五天:进行CHIP-qPCR检测目的基因组蛋白的乙酰化水平。CHIP-qPCR的引物序列见表1。

表1 C1GALT1和ST6GALNAC2启动子区域引物序列
4.real-time PCR检测 荧光染料法检测C1GALT1和ST6GALNAC2的 mRNA转录水平。以10 μL体系进行real time-PCR扩增,以GAPDH为内参。每次实验设3复孔,独立实验重复3次。C1GalT1和ST6GALNAC2引物序列见表2。
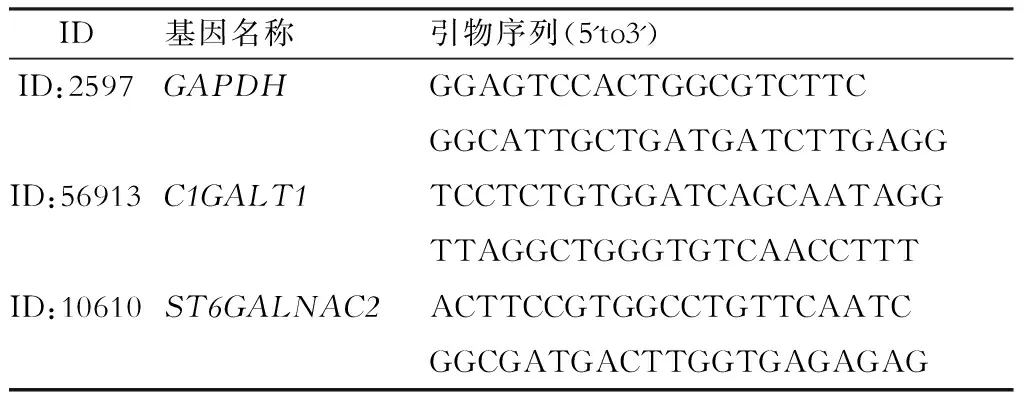
表2 C1GalT1和ST6GALNAC2 real-time PCR 引物序列
三、统计学方法
结 果
一、基本资料
研究中纳入的IgAN患者中CKD1~2期的占了总数70%,CKD3期占了总数20%,CKD4期占了总数10%,显示该研究人群的病情相对较轻。24 h蛋白尿定量>150mg即诊断为蛋白尿。本研究中蛋白尿分级标准为:24 h蛋白尿定量<1g为轻度蛋白尿,1~3.5 g为中度蛋白尿,>3.5 g为大量蛋白尿,19%的患者仅有少量蛋白尿,68%的患者呈中等蛋白尿,而大量蛋白尿的患者仅占了13%。两组研究对象的基本特征如表3所示。
二、IgAN组与对照组血浆IgA1及Gd-IgA1浓度比较
与对照组比较,IgAN组血浆IgA1和Gd-IgA1浓度均显著升高(均P<0.01),两者差异具有统计学意义。(表4)
三、IgAN患者血浆Gd-IgA1浓度与24 h尿蛋白定量及eGFR值的相关性
IgAN患者血浆Gd-IgA1浓度与24 h尿蛋白定量呈正相关(r=0.479,P=0.005);IgAN患者血浆Gd-IgA1浓度与eGFR水平无显著相关性(r=0.087,P=0.56)。(图1)
四、IgAN组与对照组C1GALT1及ST6GALNAC2的mRNA表达量比较
Real-time PCR结果显示,与对照组比较,IgAN组C1GALT1 mRNA的表达量显著下降,为对照组的(0.28±0.06)倍(P<0.01); ST6GALNAC2的mRNA表达量显著升高,为对照组的(2.88±0.60)倍(P<0.01)。(表5)
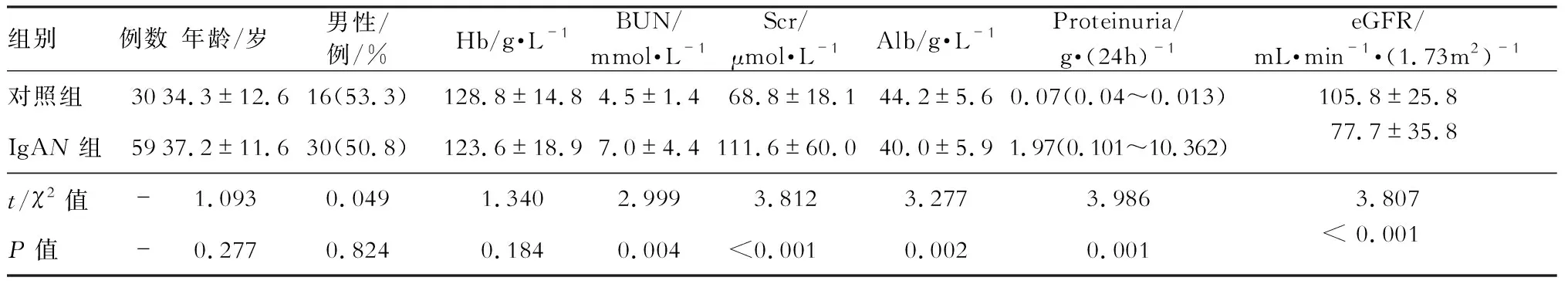
表3 IgAN组与对照组的基本特征比较
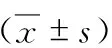
表4 IgAN组与对照组血浆IgA及Gd-IgA1的浓度比较
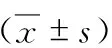
表5 两组C1GALT1及ST6GALNAC2的mRNA表达量的比较
五、 IgAN组与对照组糖基化酶基因C1GALT1和ST6GALNAC2启动子区组蛋白H3和H4乙酰化水平比较
应用H3Ac和H4Ac抗体分别进行CHIP实验,对免疫沉淀的DNA样本及各自的Input使用引物扩增C1GALT1和ST6GALNAC2启动子区域。结果显示,与对照组相比,IgAN组C1GALT1基因启动子区域组蛋白H3、H4乙酰化程度降低,分别为[(0.43±0.20)比(1.00±0.27),P<0.05]和[(0.62±0.11)比(1.07±0.09),P<0.01]; ST6GALNAC2基因启动子区域组蛋白H3、H4乙酰化程度均显著升高,分别为[(3.42±1.32)比(1.00±0.37),P<0.05]和[(2.07±0.29)比(1.10±0.07),P<0.01]。(表6)
讨 论
IgAN是一种常见的肾小球性疾病,以IgA或者IgA为主的免疫复合物肾小球内沉积为特征,临床表现不一,预后各不相同[15],是导致终末期肾病的重要因素,40%IgAN患者在20年内将缓慢进展至终末期肾病[16-17]。研究发现IgAN起病时尿蛋白、肾功能和肾脏病理是提示预后最重要的指标[18]。最新的研究发现,在IgAN患者冷冻肾组织中均含有Gd-IgA1特异性IgG自身抗体,这一发现再次揭示了Gd-IgA1在IgAN发病机制中的重要性[19]。
本研究检测了59例IgAN患者及30例对照者外周血浆IgA1及Gd-IgA1浓度,结果显示IgAN组IgA1及Gd-IgA1浓度均显著高于对照组。我们将59例IgAN患者Gd-IgA1值分别与其24 h尿蛋白量进行相关性分析发现,IgAN患者Gd-IgA1值与24h尿蛋白量呈显著正相关。Zhao等[20]通过对275例IgAN患者进行了最长达96个月随访的前瞻性研究发现:低糖基化IgA1的血清浓度越高,IgAN患者的预后越差;低糖基化IgA1的血清水平越高,其进展至肾功能衰竭的风险就越大。
IgAN患者不仅血浆Gd-IgA1浓度升高,更有研究发现其尿液中Gd-IgA1排泄显著增加,且尿液中Gd-IgA1浓度与尿蛋白的量呈正相关[21],该项结果跟我们研究结果一致。但是本研究未发现患者Gd-IgA1值与其CKD分期之间有显著相关性,有可能与我们入组的患者大多为CKD1期和2期的患者有关。
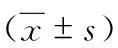
表6 两组糖基化酶基因C1GALT1和ST6GALNAC2启动子区组蛋白H3和H4乙酰化水平比较
IgA1糖基化修饰与两类糖基化酶密切相关:一为core 1 β1,3-半乳糖基转移酶(C1GalT1,由C1GALT1基因编码)[9],其主要作用是增加N-乙酰半乳糖胺的半乳糖基化;另一为α-2,6-唾液酸转移酶2(ST6GalNAc-II,ST6GALNAC 2基因编码)[10],其主要作用是将唾液酸基加到N-乙酰半乳糖胺上[22],减少其半乳糖基化程度。在IgAN中主要表现为C1GalT1的表达减少,活性降低;同时ST6GalNAc-II高表达,活性增加[3]。本研究应用real-time PCR的方法分别检测显示,IgAN组外周血单个核细胞中C1GALT1 mRNA的表达较对照组出现了显著的下调,而ST6GALNAC2 mRNA的表达量则是出现了显著的上调,与Suzuki等[3]的研究结果相一致。但是,IgAN中C1GALT1 mRNA出现显著下调,ST6GALNAC2的mRNA显著上调的内在机制仍不清楚。
疾病表型的变异可以归因于遗传因素和环境因素[23]。研究表明,基因组的变异会影响慢性肾脏病的发生和发展[24]。然而,由于环境因素而导致的表观遗传机制对于维持基因组的正常功能也是很关键的[25]。近年来研究表明,表观遗传学机制参与了各种肾脏疾病的发病机制[26]。表观遗传学机制中最受关注的是细胞核中的乙酰化。在细胞核中,乙酰化修饰主要调节组蛋白生物学和转录[12,27-29]。质谱技术的进步揭示了几乎所有细胞内均有乙酰化的相关靶点[30-31]。细胞内乙酰化是由乙酰化和去乙酰化水平所需的酶、代谢物和辅助因子的定位所驱动。
本研究应用CHIP-qPCR的方法检测了IgA糖基化过程中密切相关的两个基因启动子区的H3和H4乙酰化水平。结果显示,IgAN组C1GALT1基因启动子区H3和H4乙酰化较正常对照组均显著下降,ST6GALNAC2基因启动子区的H3和H4乙酰化水平较正常对照组均显著升高。C1GALT1基因启动子区的H3和H4乙酰化水平下降后使得染色质呈相对“关闭”状态,从而抑制了C1GALT1基因的表达。ST6GALNAC2基因启动子区的H3和H4乙酰化水平较正常人升高,使得染色质呈相对“开放”状态,从而促进了ST6GALNAC2基因的表达,这两个基因的异常表达参与了Gd-IgA1的形成过程。
总之,本研究通过对IgAN患者及对照者外周血IgA及Gd-IgA1浓度的检测以及IgAN患者Gd-IgA1与24 h尿蛋白及eGFR水平的相关性分析,再次验证了Gd-IgA1在IgAN发病和发展过程中的重要作用。本研究首次从组蛋白乙酰化角度探究了糖基化酶基因表达发生改变的内在机制,从表观遗传学角度丰富了IgAN的发病机制,为IgAN的治疗和干预提供新的思路。由于患者肾穿刺组织来源受限,以及技术上针对性地检测单个肾小球系膜区Gd-IgA1的沉积量存在难度,本研究未能探讨IgAN患者血浆Gd-IgA1浓度是否与患者肾脏病理改变或者组织中IgA1的表达有相关性,有待今后进一步完善。

