硫代硫酸钠在钙性尿毒症性小动脉病中的机制和应用
唐静 钟慧 付平
610041 成都,四川大学华西医院肾脏内科(唐静,钟慧,付平);617000 攀枝花,攀钢集团总医院肾脏内科(唐静)
硫代硫酸钠(sodium thiosulfate,STS)又被称为次亚硫酸钠,通常以五水合物的形式存在。STS在医学领域的应用已经一百多年,是氰化物中毒的传统解毒剂,后来也用于减轻肿瘤化疗药物如顺铂的不良反应[1-2]。20世纪80年代Yatzidis等[3]强调STS对钙盐有溶解作用,并可治疗复发性钙盐尿路结石。2004年STS首次被用于治疗钙性尿毒症性小动脉病(calcific uremic arteriopathy,CUA)[4],此后相关报道越来越多,并逐渐受到人们关注。
CUA亦称钙化防御,是一种较为罕见的危及生命的血管钙化综合征,其特征是血管闭塞导致皮肤缺血坏死和溃疡形成,并引起剧烈疼痛。常见于终末期肾病患者。在终末期肾病患者中CUA的发病率为1%~4%[5-6]。其中腹膜透析较血液透析患者发生CUA的风险更高[7-9]。CUA的危险因素有肾功能衰竭、女性、维生素K缺乏、钙磷代谢紊乱、代谢性疾病、自身免疫性疾病和低蛋白血症等[1,7]。CUA一旦确诊,预后极差,1年内病死率高达45%~80%,感染和器官衰竭是导致死亡的主要原因[1,5]。
目前关于CUA的治疗经验多来源于个案报道,尚无高质量的临床研究,缺乏相应的治疗指南及专家共识。以综合治疗为主。尽管STS被认为是重要的治疗药物之一,但目前STS治疗CUA仍为超说明书使用,且不同文献中其使用剂量和方法也各不相同。
一、硫代硫酸钠的药动学特征
STS分子量为248 Da,肠道吸收较差。静脉给药后硫代硫酸盐离子分布在细胞外液。大约20%~50%的硫代硫酸盐经尿液迅速排除,其余被代谢生成亚硫酸盐,进而生成硫酸盐而被排出体外[2]。肾功能正常时其半衰期为15 min。肾功能衰竭时主要经胆汁排泄,其半衰期增加约5倍。由于STS分子量很小,可被血液透析清除[10]。
二、STS治疗CUA的作用机制
1.钙螯合学说 有研究提出STS是一种钙螯合剂,可螯合沉淀于软组织中的钙,将不溶性钙盐变成可溶性的硫代硫酸钙,从而治疗钙化[3]。但O’Neill[11]的研究结果否定这一假说,该研究者发现STS与钙离子的相互作用很弱,在组织培养基中降低钙离子浓度小于4%。他们还发现细胞外的STS具有直接抑制血管钙化作用,这种抑制似乎与钙离子浓度无关,且STS仅抑制损伤或失活的主动脉钙化,而不能预防未损伤血管的钙化。其发生的机制可能与细胞破裂的产物(如凋亡小体或机制小泡)有关。
2.氧化还原反应 STS有两个可用的未配对的电子,可以清除CUA相关的内皮功能失调产生的未配对活性氧[12]。在这个过程中与氧化谷胱甘肽和各种活性氧(如过氧化氢和超氧化物羟自由基)反应生成谷胱甘肽,后者是一种天然的抗氧化剂[12-13]。STS的抗氧化作用还可能阻止四氢生物蝶呤氧化,从而阻止内皮型一氧化氮解耦,减少超氧化物生成,并增加可利用的内皮细胞来源一氧化氮的数量,从而扩张血管、减轻疼痛、保护内皮细胞完整性及减轻血管钙化[12,14]。
3.舒张血管及抗炎作用 除了通过影响一氧化氮扩张血管外,STS还可以通过血管平滑肌细胞内的各种硫醇反应,与L-半胱氨酸和转硫酶反应生成硫化氢。硫化氢是一种公认的最重要的内源性血管扩张剂和神经调节剂,可舒张血管[15]。Zanardo等[16]发现硫化氢同时还可以通过激活KATP通道抑制白细胞黏附从而达到抗炎和镇痛作用。
4.钙化抑制因子及内皮生长因子学说 STS上调钙化抑制剂如基质-Gla蛋白、骨桥蛋白和焦磷酸盐来抑制钙化[17]。同时,STS可以直接抑制脂肪细胞钙化,也可通过抑制脂肪细胞中内皮生长因子A和瘦素的分泌阻止血管平滑肌细胞钙化[18]。Hayden等[14]还提出STS可能通过修复内皮功能障碍,快速缓解神经炎症性疼痛。
综上所述,STS在CUA治疗中的作用可能是多方面的,它可能通过螯合钙、抗氧化、舒张血管、改善血管内皮功能、镇痛及抑制血管钙化等作用发挥疗效。
三、硫代硫酸钠在CUA患者中的临床应用
1.静脉给药 静脉注射是STS最常见的用药途径,病例报告中70.3%患者采用静脉注射[19]。文献中静脉STS的治疗方案不尽相同。国外文献报告的治疗剂量为每次5~25 g,每周3次,多采用100 mL生理盐水稀释[10,14,20-21]。也有报告提出根据体重调整剂量,体重>60 kg时为25 g,体重≤60 kg时为12.5 g[22]。维持性血液透析患者通常在透析结束前的30~60 min静脉给药[7,23]。由于STS分子量较小,可能因透析清除而降低疗效,也有文献采用透析后给药。Malbos等[24]报道了4例CUA患者,透析后30 min内给予STS 12.5~25 g静脉注射治疗。 Araya等[25]和Miceli等[26]的研究也采用了透析后给药的方法,每次透析后给予25 g STS或25%STS溶液 25 g·(1.73 m2)-1,每次60 min以上。上述方法都能迅速缓解疼痛,16 d至数周后显示皮肤改善。Singh等[27]通过对STS药动学的研究,建议其治疗剂量根据透析频率或强度进行调整。对常规透析患者,每次24~25 g,每周3次,透析后给药。强化透析或连续性肾脏替代治疗的患者需要增加剂量(表1)。对非透析的慢性肾功不全的患者,剂量需根据肾功能调整,估算肾小球滤过率(estimated glomerular filtration rate,eGFR)>60 mL·min-1·(1.73 m2)-1的患者可以每周给予3~5次,对于eGFR≤60 mL·min-1·(1.73 m2)-1的患者建议每周2次,每次12.5 g[28]。Bourgeois等[29]报道每日静脉给药比每周3次静脉给药累积剂量增加更快,尽管87%发生代谢性酸中毒,但耐受良好,且疗效差异不明显。每日静脉注射STS在肾功能正常的患者也有报道,并未显示出不良反应的增加[30]。儿童用药报道罕见,推荐用量多为25 g·(1.73 m2)-1加入100 mL生理盐水中,血液透析后给药,每周3次[25,31]。
近年来国内学者对CUA治疗的报道也有增加,用药剂量和方法与国外略有不同。多数报道剂量偏小。陈雅等[32]报道了1名CUA的患者,静脉注射STS 3.84 g/d,连续2个月,联合碳酸镧及甲状旁腺切除术缓解了患者的皮肤损害。刘玉秋等[33-34]建议从5 g开始逐步增加剂量,最高到10 g/d,生理盐水250 mL稀释后静脉输入,每疗程2周,每2月一个疗程。其他个案报道的用药剂量范围为每周3次,每次6.4~16 g[35-36]。陈玉秀等[37]的研究与国外相近,采用25 g STS加入100 mL生理盐水,透析结束30 min前使用,多数也能耐受(28/30)。综上所述,对于STS治疗剂量,国内多低于国外,原因可能是基于人种和体格的差异,也可能受到国人临床经验的影响。因此,我们还需要更多临床研究探索适宜的治疗剂量。在参考国内外文献同时,建议兼顾人种的差异,从小剂量开始逐渐增加到合适且患者能耐受的治疗剂量,同时密切关注不良反应。
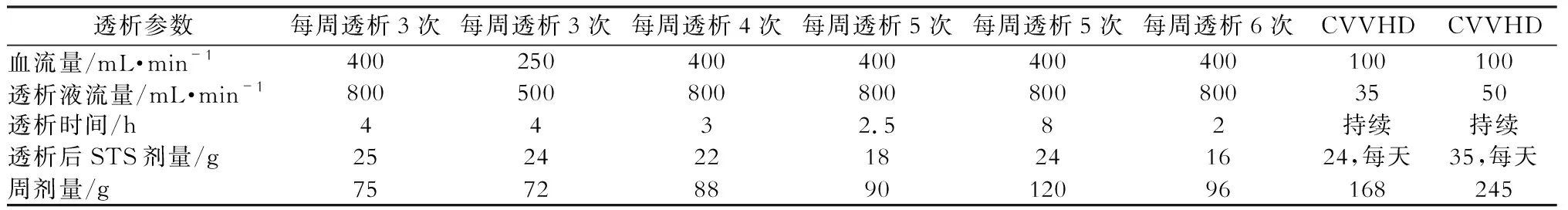
表1 不同透析方案时硫代硫酸钠的给药方案
STS静脉给药止痛效果明显,输液过程中即可出现疼痛一过性减轻。一般治疗2周后疼痛可持续缓解。皮肤病变好转需要数周或更长时间,最短治疗时间为3个月。STS治疗的总时间通常为6个月或直至病变完全愈合[7]。 Nigwekar等[38]的回顾性调查发现,172例接受STS治疗的CUA患者中大多数临床症状得到改善,其中26.4%完全缓解,18.9%显著改善,28.3%部分改善。使用STS治疗的患者1年病死率为35%[38],与常规治疗的病死率50%~80%相比,明显降低[1]。
2.病灶内给药 近年来STS病灶内注射也有报道,该治疗方式能迅速缓解疼痛,且患者耐受性较好。Isoherranen等[39]予CUA患者病灶内注射STS溶液,每针间隔1~2 cm,剂量为0.5~3.75 g(或浓度为250 mg/mL STS溶液2~15 mL)。每周1~2次,之后根据临床反应调整注射频率。2周后病变可减轻。病灶内注射后局部药物浓度较高,避免了静脉给药的潜在不良反应,如低血压、代谢性酸中毒等。此外,病灶内注射治疗剂量更小、更经济,且操作方便,门诊即可进行治疗。但病灶内注射可能导致细菌侵入诱发感染[40]。注射时的疼痛也可能限制局部使用,提前注射利多卡因或用利多卡因稀释STS或可减轻疼痛[39]。由于目前报道病例数较少,局部用药仍需要更多研究。
3.口服给药 药物动力学提示口服STS的生物利用度较差,仅为7.6%,但仍有病例报道口服有效[41]。Shetty等[41]报道2名腹膜透析患者,其中一名予以STS 1 500 mg每日二次,4 d后疼痛缓解,数月后溃疡愈合。另一名由最初的每天3 000 mg 增加到3 750 mg,最终疼痛缓解和溃疡面积缩小。静脉治疗后予以口服STS先静脉后口服的序贯治疗也有报道。有报道先予以静脉治疗,待患者疼痛缓解、皮肤溃疡愈合后,改为口服,维持治疗6个月~1年[42-43]。口服剂量为0.6~1.2 g(每日3次)或2.6 g(每日一次)。其中1例患者因腹泻,由2.6 g(每日一次)减少剂量为2.6 g(每周3次),均成功预防了CUA复发。CT显示病灶钙化程度减低,所有患者均未发生代谢性酸中毒等其他药物不良反应。但口服STS的经验仍较少,先静脉注射后口服的序贯治疗以预防CUA复发还值得进一步研究。
4.腹腔给药 在腹膜透析患者中有腹腔使用STS的报道。Mataic等[44]报道了1例静脉STS不耐受且静脉通路建立困难的腹膜透析患者。STS 25 g加入2 L低钙腹透液保留1 d,隔日一次。研究发现腹腔内给药提高了腹透液对钙的清除(提高13 mg/L)。STS与腹膜透析液混合后不产生沉淀,腹腔内给药可避免静脉用药导致的消化道症状,患者耐受性较好。但STS对腹膜转运特性的影响尚不清楚[44-45]。Gupta等[46]报道1例腹膜透析患者在2 L腹膜透析液中加入25 g STS,共3次,12 h后患者出现化学性腹膜炎。因此,对于腹膜透析患者,可考虑腹腔给药,但是有发生化学性腹膜炎的风险。关于腹腔给药的疗效报道较少,需谨慎评估。
四、STS不良反应
STS的不良反应以静脉用药时多见,病灶内注射、口服及腹腔用药报道较少,不良反应相对较少。静脉使用最常见的不良反应是恶心、呕吐和代谢性酸中毒[19],输液速度过快是导致恶心、呕吐的主要原因,少数患者可能会出现严重的阴离子间隙升高的代谢性酸中毒[21,47]。严重的酸中毒可导致谵妄、虚弱或心律失常,甚至癫痫发作[48]。可能有以下3个原因导致严重酸中毒:(1)硫代硫酸盐溶解成硫代硫酸;(2)代谢中产生的硫化氢增加氢负荷;(3)硫化氢抑制氧化磷酸化导致局部缺血,引起乳酸酸中毒[49]。口服碳酸氢钠有助纠正酸中毒,但可能导致钠负荷过高。碳酸氢盐透析液或可缓解STS诱发的代谢性酸中毒,透析中使用可能减轻上述不良反应。
其他少见不良反应有流鼻涕、鼻窦充血、QT间期延长[50-51]。有病例报道它还增加了败血症的风险[19]。发生这些不良反应时需要调整剂量或改变用药途径,甚至停药。到目前为止,仅有1例STS治疗相关高钙血症的报道[52],考虑高钙血症可能与高浓度的可溶性硫代硫酸钙有关。
一项STS治疗CUA的动物研究提示长期使用STS与骨强度降低有关[53]。这可能与STS导致代谢性酸中毒、甲状旁腺激素水平升高及消耗骨钙磷酸盐有关。另一研究发现STS治疗CUA患者5月后L1-L2腰1-腰2椎体的骨密度没有变化,但髋关节骨密度下降[54]。因此,对CUA患者,长时间使用STS仍应监测骨密度。
五、小结
STS是治疗CUA最常选择的药物之一。目前的用药途径主要为静脉注射,国内报道的用药剂量明显偏小,可能基于人种和体格的差异。病灶内注射也显示出治疗的有效性及较好的耐受性。口服用药或序贯治疗虽有报道,但口服生物利用度低,尚需进一步观察。因腹腔内用药案例较少,可能增加腹膜炎的风险,需谨慎对待。尽管目前仍无法评估单用STS的疗效,但它仍为CUA患者提供了一个有希望的治疗策略,只是目前其最佳剂量、用药时间及途径仍需进一步研究明确。

