弓形虫RH株ROP18基因的原核表达及鉴定
段倩玉,蒋 蔚,陈 芸,张曼玉,曹敬政,王 权
(1.中国农业科学院上海兽医研究所,上海200241;2.南京农业大学动物医学院,南京210095)
刚地弓形虫(Toxoplasma gondii)是一种重要的机会性致病原虫,该寄生虫在全世界范围存在,可以感染包括哺乳动物和鸟类在内的几乎所有温血动物[1]。摄入未煮熟含包囊的肉或接触含卵囊的猫粪都会导致感染。在人类中,免疫功能正常的感染者通常是无症状的,而免疫功能亢进的感染者可能患脑炎,免疫功能受损的感染者和经胎盘获得弓形虫的先天性弓形虫病患者可能会产生严重疾病;如果孕妇在怀孕期间感染,则会导致胎儿发育中的严重先天性疾病,造成死产和新生儿损失[2]。此外,家畜感染可对公共健康构成威胁并造成巨大的经济损失[3]。因此,预防弓形虫病对于人类健康和畜牧业的发展均具有重要意义。
刚地弓形虫作为专性细胞内寄生原虫,必须入侵宿主细胞来获取营养并在细胞内增殖。微线体、棒状体和致密颗粒作为弓形虫的三种重要细胞器,可帮助弓形虫入侵宿主细胞并诱导宿主细胞发生改变[4]。棒状体是一个大的且具有细长输送管道的细胞器,在虫体入侵的同时,器官内容物(棒状体蛋白)通过管道释放出来[5]。棒状体蛋白(rhoptry protein,ROPs)在宿主细胞的入侵、纳虫空泡(parasitophorous vacuole,PV)的形成及弓形虫的增殖调节中起重要作用。其中,弓形虫棒状体蛋白18(rhoptry protein 18,ROP18)是一种丝氨酸/苏氨酸蛋白激酶,属于ROP2(rhoptry protein 12)蛋白质家族,对急性毒力具有重要意义。在弓形虫感染期间,宿主细胞诱导产生的免疫相关蛋白(immunityrelated GTPases,IRGs)通过破坏纳虫空泡膜(parasitophorous vacuole membrane,PVM)的完整性来攻击寄生虫;而弓形虫分泌的ROP18可通过N末端低复杂性区域结合在PVM上,并通过磷酸化宿主产生的GTP酶(IRGs)而防止PVM被破坏,以逃避宿主的免疫攻击[6]。ROP18作为弓形虫的重要毒力因子,其生物学功能有待更深入的研究,为此,本研究选择实验室常用的Ⅰ型强毒力虫株RH株用来扩增截短的ROP18基因,构建原核表达质粒,成功获得了重组ROP18蛋白,并利用纯化后的蛋白免疫小鼠制备多克隆抗体,通过Western blot和间接免疫荧光试验(indirect immunofluorescence assay,IFA)鉴定重组蛋白免疫活性,为深入研究其生物学功能奠定了基础。
1 材料与方法
1.1 弓形虫虫株、菌种、质粒与小鼠刚地弓形虫RH株由本实验室液氮冷冻保存;大肠埃希菌(E.coli)DH5α及BL21(DE3)感受态细胞购自天根生化科技有限公司;原核表达质粒pET-30a(+)由本实验室保存;昆明雌性8周龄小鼠购自上海杰思捷实验动物有限公司。
1.2 试剂与仪器高保真DNA聚合酶购自诺唯赞生物科技有限公司;限制性内切酶BamH Ⅰ和HindⅢ、T4连接酶、DL2000 DNA marker、DL15000 DNA marker购自宝日医生物技术(北京)有限公司;树脂型基因组DNA提取试剂盒购自上海赛百盛基因技术有限公司;琼脂糖凝胶回收试剂盒购自美国AXYGEN公司;小量质粒提取试剂盒、AlexaFluor488标记的驴抗鼠IgG、蛋白marker、ECL底物显色液试剂盒购自赛默飞世尔科技(中国)有限公司;胰蛋白胨、酵母提取物和琼脂粉购自英国OXOID公司;卡那霉素、异丙基硫代半乳糖苷(IPTG)购自生工生物工程(上海)股份有限公司;BCA蛋白定量试剂盒购自Bio-Rad公司;WHB细胞爬片购自上海卧宏生物科技有限公司;DAPI、抗荧光淬灭剂购自上海碧云天技术有限公司;PCR扩增引物由上海睿勉生物科技有限公司合成;PCR仪购自赛默飞世尔科技(中国)有限公司;培英THZ-D台式恒温振荡器购自北京乾明基因技术有限公司;DYY-6D型电脑三恒多用电泳仪电源购自艾科仪器设备有限公司;Bio-Rad GelDoc EZ凝胶成像系统、PowerPac™ 通用电泳仪电源购自伯乐生命医学产品(上海)有限公司;细菌恒温培养箱购自济南乐瑞医疗器械有限公司;SYG-20型银汞调合器购自上海寰熙医疗器械有限公司;蔡司激光共聚焦显微镜由中国农业科学院上海兽医研究所中心仪器实验室保管。
1.3 弓形虫DNA的提取从液氮中复苏冻存的弓形虫RH株,于37℃水浴快速解冻,269×g离心8 min,收集沉淀,用300 μL无菌生理盐水重悬虫体,腹腔注射接种昆明鼠,待3 d后小鼠出现被毛竖立、精神不振等症状时,采用颈椎脱臼法将小鼠处死,无菌生理盐水冲洗腹腔收集腹水,吸到5 mL注射针管中,以5 μm滤器过滤纯化,269×g离心8 min,收集沉淀获得弓形虫。用树脂型基因组DNA提取试剂盒提取RH株的基因组DNA,-20℃保存备用。
1.4 引物的设计与合成根据刚地弓形虫RH株的ROP18蛋白编码基因序列(GenBank登录号:JX045330)设计合成一对含有BamH Ⅰ和Hind Ⅲ酶切位点的引物(划线部分是酶切位点),上游引物F:5'-CGCGGATCCATGTTAGAGGGACAGCCAG CA-3';下游引物R:5'-CCCAAGCTTTTATTCTGT GTGGAGATGTTCCTG-3'。
1.5 ROP18基因的扩增以弓形虫RH株的基因组DNA为模板,以合成引物F/R扩增ROP18基因。PCR反应条件:94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸1 min,共30个循环;72℃延伸10 min。PCR产物进行1%琼脂糖凝胶电泳检测,并用琼脂糖凝胶回收试剂盒回收目的片段,-20℃保存备用。
1.6 重组质粒pET-30a-ROP18的构建及鉴定用小量质粒提取试剂盒提取pET-30a(+)质粒,将已纯化的ROP18目的片段与pET-30a(+)载体分别用BamH Ⅰ和Hind Ⅲ进行双酶切,并用琼脂糖凝胶回收试剂盒回收酶切后的条带。回收产物用T4 DNA连接酶16℃连接过夜,连接产物转化至大肠埃希菌(E.coli)DH5α感受态细胞中,用含70 μg/mL卡那霉素的固体LB平皿培养后挑取单个菌落扩增后小提质粒,进行PCR和双酶切鉴定,将鉴定正确的阳性重组质粒送至苏州金唯智生物科技有限公司测序。
1.7 重组蛋白的表达及可溶性鉴定测序正确后将重组质粒转化至大肠埃希菌(E.coli)BL21(DE3)感受态细胞,过夜培养,挑取阳性BL21单克隆菌落,接种于含70μg/mL卡那霉素的LB液体培养基中,37℃、200 rpm震荡过夜,次日以1∶50的比例扩大培养至A600为0.4~0.6时,加入IPTG至终浓度为0.2 mmol/L,37℃、180 rpm诱导表达6 h,同时设置空载对照及未诱导对照,9705×g离心10 min,收集菌体沉淀,用无菌1×PBS洗涤菌体沉淀3次,再用原菌液体积1/10的PBS重悬菌体沉淀,置于冰上超声破碎,9705×g离心10 min,分别收集上清液和沉淀。SDS-PAGE电泳分析重组蛋白的存在形式。
1.8 重组蛋白ROP18的纯化包涵体形式的目的蛋白以His·bind Resin纯化试剂盒纯化效果不佳,故采用KCl染色切胶法[7]纯化目的蛋白:根据目的蛋白相对分子量配制15%的分离胶,并配一层薄层浓缩胶,不插样品梳直接上样进行SDS-PAGE电泳,80 V、20 min后转120 V、60 min至溴酚蓝达最底部,停止电泳。将胶块取下置于提前配制好的预冷的KCl(0.25 mol/L)中,室温震荡染色5~10 min,出现银白色条带,将胶条切下,1×PBS洗3遍直至胶条无色,胶条置于-80℃保存备用。将胶条用干净的研钵研磨成细沙状收集于离心管中,加入适量1×PBS,振荡混匀后依次置于-80℃、室温反复冻融3次,9705×g离心30 min,吸取上清即为纯化后目的蛋白,用BCA法测定蛋白浓度。
1.9 鼠抗重组蛋白ROP18多克隆抗体的制备将纯化后的足够浓度的重组蛋白加等体积的完全佐剂乳化后,按照100 μg/只首次免疫昆明小鼠的足垫,之后按等体积加不完全佐剂乳化,依然按照100 μg/只的剂量每隔两周加强免疫一次。其中,二免部位为皮下,三免部位为肌肉,三免10 d后尾静脉采集血液分离血清,以ELISA法检测多克隆抗体效价。
1.10 重组蛋白ROP18的Western blot分析取蛋白纯化后样品于EP管中,加适量蛋白上样缓冲液,充分混匀后煮沸10 min,进行SDS-PAGE。电泳结束后,将目的蛋白转印至NC膜,以5%脱脂乳室温封闭1.5 h,加入1∶500倍稀释犬阳性血清,室温孵育3 h,1×PBST洗涤3次后,加入1∶2000倍稀释的HRP标记的山羊抗犬IgG作为二抗室温孵育1.5 h,充分洗涤后进行ECL显影反应,化学发光成像观察结果。
1.11 重组蛋白ROP18的间接免疫荧光试验分析将Vero细胞接种于提前备好的带有WHB细胞爬片的24孔细胞板内,显微镜下观察细胞生长至铺满细胞板80%时,按速殖子与Vero细胞比例为1∶1接种弓形虫速殖子,继续置于37℃、5%CO2培养箱中培养;感染24 h后用镊子取出爬片,1×PBS洗涤3遍;用4%多聚甲醛于4℃固定20 min;洗涤后,用0.5%的TritonX-100处理15 min,1×PBS洗涤3遍;于湿盒内用1% BSA(PBS稀释)37℃封闭30 min;充分洗涤后加入1% BSA稀释的鼠抗ROP18抗血清(1∶1000)作为一抗,37℃孵育1 h,1×PBS洗涤3次;避光加入Alexa Fluor 488标记的驴抗鼠IgG(1∶2000)作为二抗,37℃孵育1 h,1×PBS洗涤3次;细胞爬片经DAPI复染细胞核后充分洗涤风干,滴加抗荧光淬灭剂封片,通过激光共聚焦显微镜的油镜观察并采集图像。
2 结果
2.1 ROP18基因的扩增以刚地弓形虫RH株的基因组DNA为模板,采用PCR方法扩增ROP18截短基因,扩增产物经1%琼脂糖凝胶电泳鉴定,出现单一目的条带,大小为678 bp,与预期大小一致,且阴性对照处无特异性条带(图1)。
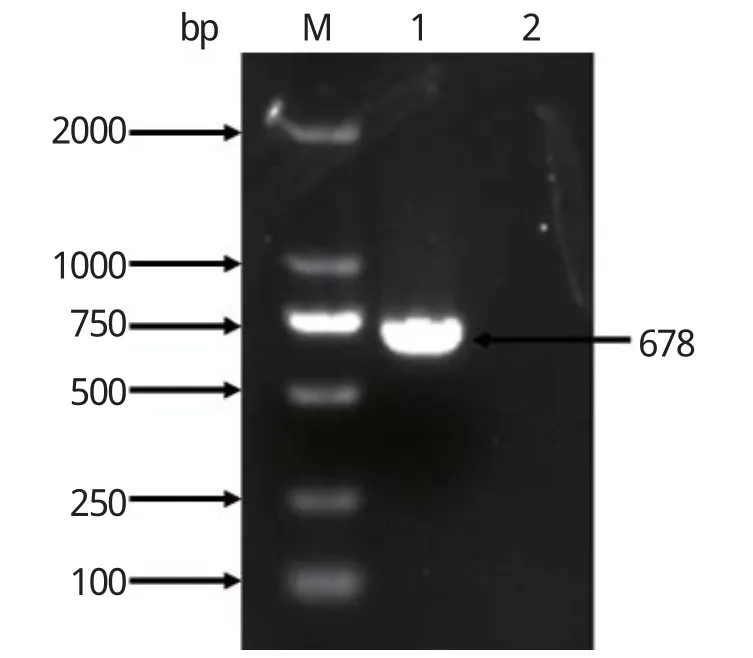
图1 ROP18基因的PCR扩增Fig.1 PCR amplification of ROP18 gene
2.2 重组质粒的鉴定
2.2.1 重组质粒的PCR鉴定 以构建的重组质粒pET-30a-ROP18为模板,以F/R为引物进行PCR扩增,经1%琼脂糖凝胶电泳鉴定,出现与预期大小一致的目的片段(图2)。
2.2.2 重组质粒的双酶切鉴定 构建的重组质粒pET-30a-ROP18经BamH Ⅰ和Hind Ⅲ双酶切得到约5400 bp与678 bp 2条片段,与预期大小一致(图3),说明重组质粒构建成功。
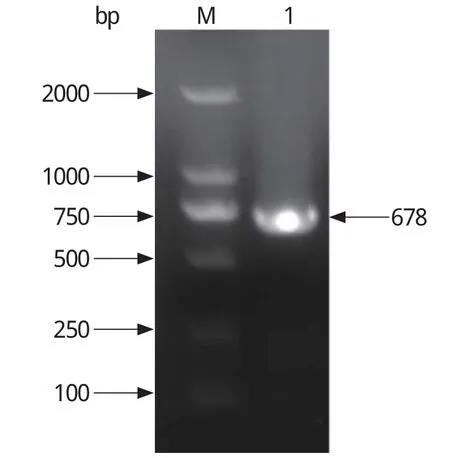
图2 pET-30a-ROP18重组质粒的PCR鉴定Fig.2 Identification of pET-30a-ROP18 by PCR amplication
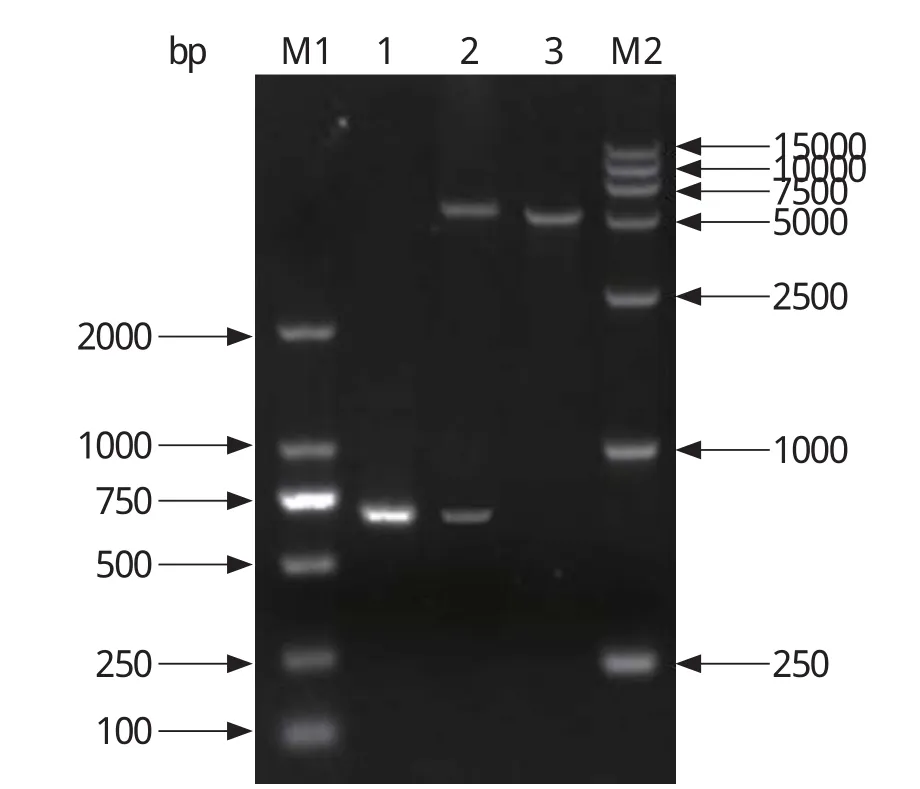
图3 pET-30a-ROP18重组质粒的双酶切鉴定Fig.3 Identification of pET-30a-ROP18 by double enzyme digestion
2.3 重组蛋白的表达及可溶性鉴定取超声破碎后的上清液和沉淀经SDS-PAGE鉴定,可看出在沉淀中约31 kDa处有一条明显的蛋白条带,重组蛋白分子量大小与预期相符,且以包涵体形式存在于沉淀(图4),获得的重组蛋白命名为rROP18。
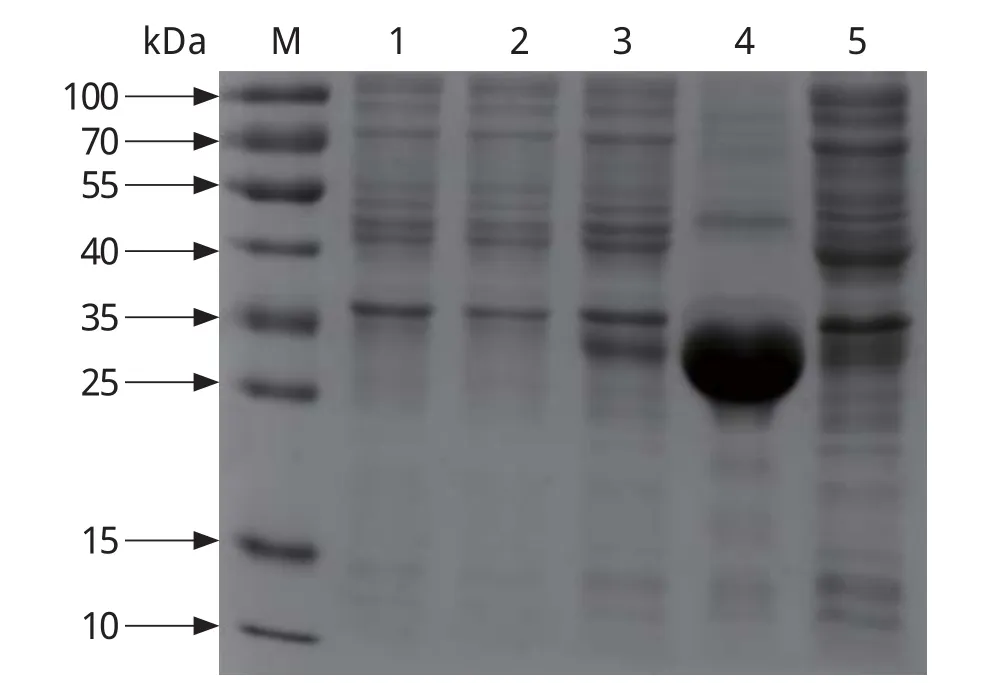
图4 pET-30a-ROP18表达产物的SDS-PAGE分析Fig.4 SDS-PAGE analysis of pET-30a-ROP18 expression
2.4 重组蛋白rROP18纯化后SDS-PAGE分析采用KCl染色切胶法纯化包涵体形式表达的目的蛋白,将胶条研磨至细沙状依次置于-80℃、室温反复冻融3次,离心后收集上清,成功获得高纯度的重组蛋白rROP18(图5)。
2.5 重组蛋白rROP18的Western blot分析将纯化后的重组蛋白rROP18进行Western blot分析(图6)。结果显示,该蛋白能够被弓形虫感染的犬阳性血清识别,在31 kDa处有特异性条带。说明重组蛋白rROP18有良好的反应原性。
2.6 间接免疫荧光试验分析用重组蛋白rROP18免疫小鼠制备的多克隆抗体进行间接免疫荧光试验。通过激光共聚焦显微镜观察发现制备的多克隆抗体能特异性识别弓形虫的天然蛋白ROP18,其主要分布在弓形虫速殖子的胞浆内,且棒状体常存在的部位呈现较强荧光(图7)。
3 讨论

图5 rROP18纯化后的SDS-PAGE分析Fig.5 SDS-PAGE analysis of the purified recombinant protein ROP18
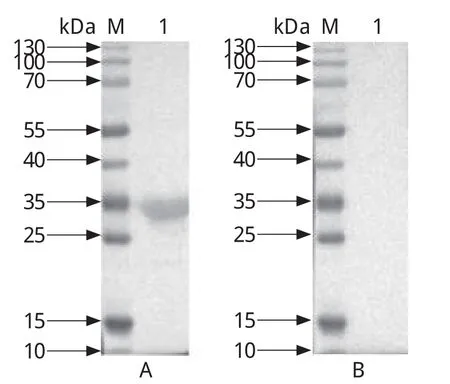
图6 rROP18的Western blot分析Fig.6 Western blot analysis of rROP18

图7 针对rROP18的多克隆抗体IFA结果Fig.7 IFA results of rROP18 polyclonal antibody
弓形虫属于专性细胞内寄生原虫,能在世界范围内感染几乎所有温血动物和人类,引起人兽共患弓形虫病,严重威胁着人类健康且对畜牧业的发展造成巨大的经济损失[8]。弓形虫与宿主天然免疫系统之间存在着精妙的平衡关系。弓形虫病的防治,除了筛选有效的抗弓形虫药物外,开发研制有效的疫苗是防治本病的重点,而对其天然免疫影响因素的了解是研制开发新型疫苗的第一步。当弓形虫感染发生时,宿主天然免疫系统被激发,激活树突细胞和巨噬细胞分泌促炎细胞因子(如IL-12)刺激自然杀伤细胞(natural killer cell,NK)和CD4/CD8 T细胞分泌γ-干扰素[9]。IFN-γ是宿主控制弓形虫感染的关键因素,它诱导产生的IRGs通过破坏PVM的完整性来攻击寄生虫[10-13]。对于无毒力的弓形虫虫株而言,IRGs可高效聚集到PVM上,因此,它们的速殖子能有效地被宿主清除。然而,Ⅰ型强毒株如RH株在PVM上分泌防御因子来阻断宿主细胞的清除机制,因此,他们能繁殖并导致急性弓形虫病[14-16]。近些年来,弓形虫用于抵抗宿主免疫清除的因子被广泛研究。其中,ROP18属于ROP2家族中真正的丝氨酸/苏氨酸激酶,在调控宿主免疫和细胞凋亡中起关键作用,这可能有助于弓形虫的免疫逃逸及在宿主细胞内寄生[17]。ROP18可定位在PV上,一些部位富含精氨酸,推测可能与该蛋白锚定在PVM表面有关;另外,ROP18通过特异性结合不同的宿主免疫相关分子介导宿主先天性和适应性免疫应答的抑制[18]:例如ROP18可与IRG6结合,使其磷酸化丧失活性,不能聚积于PVM上并破坏弓形虫周围的PVM,使虫体逃避宿主免疫系统的清除在宿主体内生存并繁殖;ROP18还可磷酸化Smad1 Ser-187以触发其蛋白酶体依赖性降解[19]。综上所述,ROP18在弓形虫的入侵和逃避宿主天然免疫清除方面起重要作用,是弓形虫的重要毒力因子。弓形虫还具有介导宿主细胞线粒体与PVM结合的能力,宿主细胞线粒体和PVM之间的接触可能为弓形虫蛋白和宿主线粒体的相互作用提供更好的通道,其中,ROP18就具有维持宿主细胞线粒体膜完整性和操纵宿主细胞线粒体凋亡的潜力[20]。本研究对弓形虫RH株ROP18基因的表达及免疫活性鉴定,为ROP18功能和运用的深入研究提供基础材料。
本研究从GenBank中查找弓形虫RH株编码ROP18的基因序列,设计特异性引物,选择330~555 aa片段构建重组质粒,插入的弓形虫基因片段测序结果与GenBank参考序列比对,同源性为100%。在IPTG终浓度为0.2 mmol/L,37℃、180 rpm诱导6 h时能成功以包涵体形式大量表达目的蛋白;采用KCl切胶法纯化后,可获得高浓度的目的蛋白,并且免疫小鼠后成功制备出ROP18的多克隆抗体。Western blot结果表明:该重组蛋白能与感染弓形虫的犬阳性血清发生特异性反应;IFA结果显示:ROP18主要分布在弓形虫速殖子的胞浆内,且棒状体常存在的部位呈现较强荧光。荆振宇[21]将截短的ROP18基因连接到pET-30a(+)构建了重组表达质粒,表达的重组蛋白有非常好的免疫活性,初步建立了弓形虫病ELISA检测方法。本研究制备的重组表达蛋白rROP18有良好免疫活性,为今后深入研究弓形虫的入侵机制及ROP18在抵抗宿主天然免疫方面功能的研究奠定了坚实基础。
——一道江苏高考题的奥秘解读和拓展

