原钙黏蛋白10通过NF-κB/cyclin D1信号通路抑制乳腺癌MDA-MB-231细胞增殖*
岳丽玲, 刘 溪, 张 微, 于海涛, 刘立琨, 高秀丽, 朱文斌, 李 娜
(齐齐哈尔医学院 1医药科学研究院,2附属第三医院乳腺外科,黑龙江齐齐哈尔161006)
我国乳腺癌发病率位居女性肿瘤发病率榜首,且发病呈逐年上升和年轻化趋势[1]。虽然乳腺癌的诊治目前已取得长足的进展,但其高发病率及治疗后的复发转移仍严重威胁着患者的生存。因此,深入研究乳腺癌的发病机制,探寻新的肿瘤分子标志物成为研究的重点。
原钙黏蛋白10(protocadherin 10,PCDH10)是钙黏蛋白家族的新成员,早期有关PCDH10的研究主要集中于神经元疾病,如自闭症[2]。最近的研究表明,PCDH10经常因其启动子区高甲基化而失活,并在胃癌、大肠癌和肺癌以及其他肿瘤中发挥抑癌基因作用[3-6]。此外,过度表达PCDH10能够抑制包括鼻咽癌、食道癌和结肠癌在内的多种肿瘤细胞生长[7]。然而,关于乳腺癌中PCDH10表达的研究非常有限,仅有报道PCDH10在乳腺癌中发生异常甲基化[8-9],但是PCDH10在乳腺癌细胞中的表达、生物学功能和机制仍未阐明。因此,本研究通过检测乳腺癌细胞和正常乳腺上皮细胞MCF-10A中PCDH10的表达情况,体外建立PCDH10稳定过表达细胞,并分析PCDH10对乳腺癌细胞增殖和细胞周期的影响及分子机制,以探讨PCDH10在乳腺癌发生发展中可能的作用途径。
材料和方法
1 细胞株
人乳腺癌细胞MDA-MB-231、MCF-7、ZR-75-1和Bcap37及人正常乳腺上皮细胞MCF-10A均购自中科院上海细胞库。
2 主要试剂
L-15培养液、MEM培养液、RPMI-1640培养液和胎牛血清(HyClone);MEBM培养液(LONZA);逆转录试剂盒(北京全式金生物技术有限公司);PCR试剂盒(TaKaRa);兔抗人PCDH10多克隆抗体(Proteintech);兔抗人细胞周期蛋白D1(cyclin D1)单克隆抗体、细胞周期蛋白依赖性激酶4(cyclin-dependent kinase 4,CDK4)单克隆抗体、磷酸化核因子κB(nucear factor-κB,NF-κB)p65 亚 基(phosphorylated p65,p-p65)单克隆抗体和磷酸化NF-κB抑制蛋白α(phosphorylated NF-κB inhibitor α,p-IκBα)单克隆抗体(CST);鼠抗人GAPDH单克隆抗体(CST);MTT粉剂(Sigma);细胞周期检测试剂盒、BCA蛋白定量试剂盒和ECL发光试剂盒(北京康为世纪生物科技有限公司);PCDH10慢病毒过表达载体由本实验室构建;PCDH10引物序列由上海生工生物工程公司合成。
3 实验方法
3.1 细胞培养 MCF-7细胞培养于MEM培养液,ZR-75-1和Bcap37细胞培养于RPMI-1640培养液,MDA-MB-231细胞培养于L-15培养液,MCF-10A细胞培养于MEBM培养液,培养液中均含有10%的胎牛血清;除MDA-MB-231细胞不需CO2外,所有细胞均置于37℃、5%CO2培养箱中贴壁生长。
3.2 RT-PCR检测PCDH10在乳腺癌细胞和正常乳腺上皮细胞中的表达 采用Trizol法分别提取各细胞总RNA,取500 ng总RNA进行RT-PCR扩增。PCDH10的上游引物序列为5'-ACTGCTATCAGGTATGCCTG-3',下游引物序列为5'-GTCTGTCAACTAGATAGCTG-3',扩增产物长度为219 bp;内参照β-actin的上游引物序列为5'-GTGGACATCCGCAAAGAC-3',下游引物序列为5'-GAAAGGGTGTAACGCAACT-3',扩增产物长度为303 bp。PCR条件:94℃变性30 s,56℃退火30 s,72℃延伸1 min,共35次循环。1%琼脂糖凝胶电泳检测扩增产物。
3.3 RT-PCR及Western blot法验证MDA-MB-231细胞慢病毒感染效果 胰酶消化MDA-MB-231细胞,在24孔板每孔中加入5×104个细胞,细胞80%以上融合时进行病毒感染。以预实验得到的重组慢病毒载体pLV-PCDH10的最佳MOI值100感染MDA-MB-231细胞,8 h后更换细胞上清为新鲜培养液,加入2 mg/L的嘌呤霉素筛选1周后得到稳定转染PCDH10的MDA-MB-231细胞,命名为pLV-PCDH10细胞;同时设立未转染的空白对照(blank)组和转染病毒空载体的阴性对照(pLV-NC)组细胞。分别提取各组细胞总RNA与总蛋白,RT-PCR和Western blot法分别检测PCDH10在各组细胞中的mRNA和蛋白表达。
3.4 MTT法分析细胞增殖能力 取处于对数生长期的pLV-NC组和pLV-PCDH10组细胞,分别以每孔3×103个细胞接种于96孔板,每组设4个复孔,分别培养24、48、72和96 h后加入20µL的MTT溶液(5 g/L),继续培养4 h后,弃上清,每孔加入150µL的DMSO,避光震荡10 min后酶标仪490 nm波长处测定吸光度(A)值,绘制细胞生长曲线图。
3.5 平板集落形成实验 收集pLV-NC及pLVPCDH10组细胞,计数,按每孔1.5×103个细胞接种于6孔板中,每组细胞设3个复孔。37℃恒温培养箱静置培养2周,甲醇固定15 min,PBS洗去固定液,加入0.2%结晶紫染色20 min,流水缓慢冲去染液,室温干燥。计数集落数,并按以下公式计算集落形成率:集落形成率(%)=集落数/接种细胞数×100%。
3.6 流式细胞术检测细胞周期 将转染细胞按每孔5×105个接种于6孔板中,37℃培养过夜。收集各组细胞,预冷PBS洗1次,加入预冷的70%乙醇4℃固定过夜。PBS洗涤2次,然后加入100µL的RNase A 37℃水浴30 min,再加入400µL PI染液,重悬细胞,4℃避光反应30 min,流式细胞仪检测各组细胞周期的变化。
3.7 Western blot检测相关蛋白表达 收集pLV-NC组和pLV-PCDH10组细胞提取总蛋白,BCA法测定蛋白浓度。每组取20µg蛋白进行SDS-PAGE,转膜,封闭液室温封闭2 h后加入I抗[PCDH10(1∶800)、cyclin D1(1∶1 000)、CDK4(1∶1 000)、p-NF-κB p65(1∶1 000)、p-IκBα(1∶1 000)、GAPDH(1∶1 000)]4℃孵育过夜。TBST洗膜后,加入II抗室温孵育2 h,TBST洗膜后ECL显色,凝胶成像分析系统成像。以GAPDH作为内参照,检测各蛋白条带吸光强度。
4 统计学处理
各组实验重复3次,所有实验数据采用SPSS 19.0统计软件分析,以均数±标准差(mean±SD)表示,两样本均数比较采用t检验,组间比较用单因素方差分析(one-way ANOVA),以P<0.05表示差异具有统计学意义。
结 果
1 乳腺癌细胞中PCDH10基因的表达
RT-PCR结果显示,PCDH10基因在MDA-MB-231、MCF-7、ZR-75-1和Bcap37这4种乳腺癌细胞中的表达水平均低于正常乳腺上皮细胞MCF-10A,且在MDA-MB-231和Bcap37细胞中表达水平最低(P<0.01),见图1。
2 慢病毒感染MDA-MB-231细胞后PCHD10的mRNA和蛋白表达上调
感染pLV-PCDH10慢病毒载体的MDA-MB-231细胞经嘌呤霉素筛选后,RT-PCR和Western blot法验证效果。结果显示,pLV-PCDH10组细胞PCDH10的mRNA和蛋白表达水平均显著高于blank组及pLV-NC组(P<0.05),而PCDH10在blank组及pLVNC组中的mRNA和蛋白表达水平无显著差异(P>0.05),见图2。后续实验选取同样感染慢病毒的pLV-NC组作为pLV-PCDH10组的阴性对照。
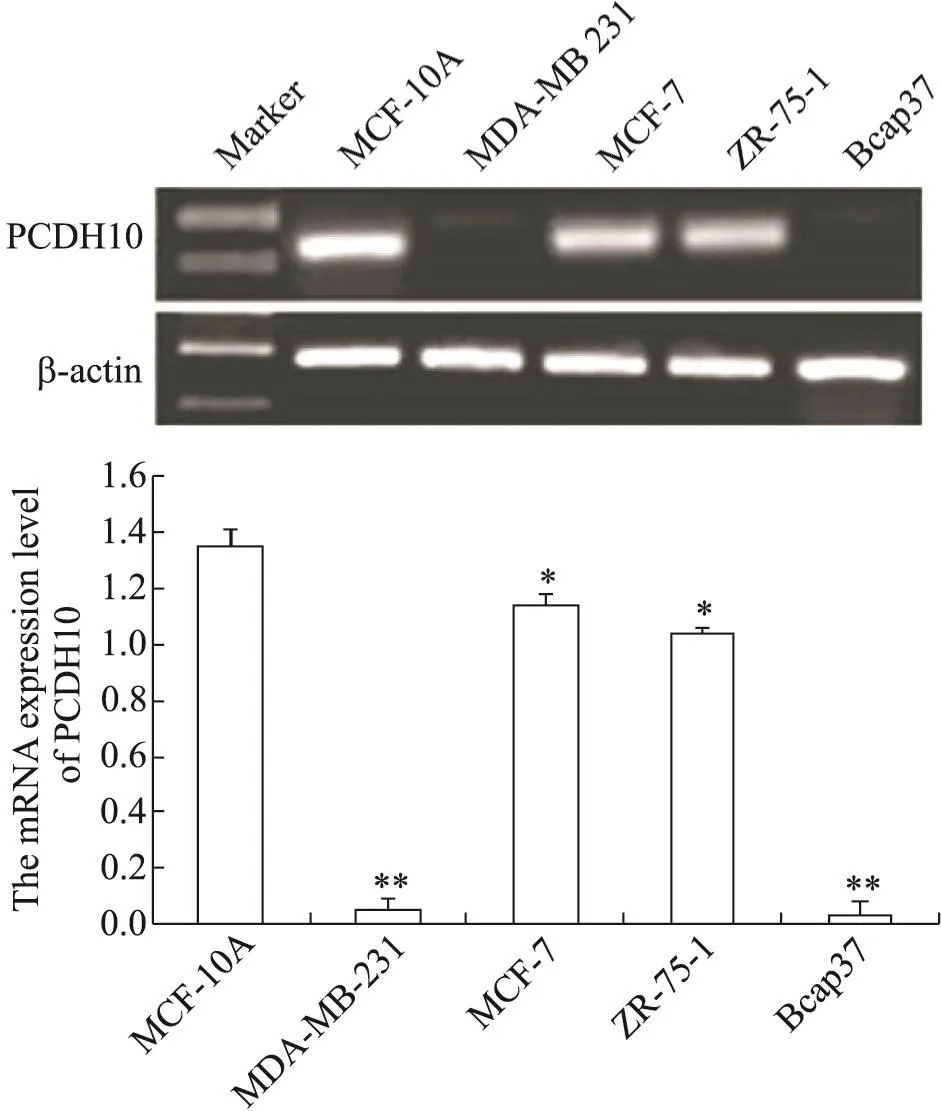
Figure 1.The expression of PCDH10 mRNA in breast cancer cell lines and normal mammary epithelial MCF-10A cells detected by RT-PCR.Mean±SD.n=3.*P<0.05,**P<0.01 vs MCF-10A cells.图1 乳腺癌细胞与正常人乳腺上皮MCF-10A细胞中PCDH10的mRNA表达水平
3 过表达PCDH10可抑制MDA-MB-231细胞增殖
MTT结果显示,pLV-NC组细胞生长旺盛,而接种48 h后稳转pLV-PCDH10组细胞活力显著低于pLV-NC组(P<0.05),见图3A;集落形成实验结果显示,pLV-PCDH10组细胞集落形成率(12.27%)远低于pLV-NC组(31.87%),差异有统计学意义(P<0.05),见图3B。
4 过表达PCDH10影响MDA-MB-231细胞周期分布
流式细胞术结果显示,pLV-PCHD10组细胞G0/G1期细胞比例(57.46%)高于pLV-NC组(47.04%),差 异 有 统 计 学 意 义(P<0.05);与 pLV-NC 组(30.01%)相比,pLV-PCHD10组S期细胞比例(23.90%)显著降低(P<0.05),见图4。
5 过表达PCDH10对MDA-MB-231细胞周期相关蛋白表达的影响
通过Western blot检测周期相关蛋白cyclin D1和CDK4的表达,结果显示,与pLV-NC组相比,pLVPCHD10组细胞cyclin D1和CDK4蛋白的表达水平显著降低(P<0.05),见图5。
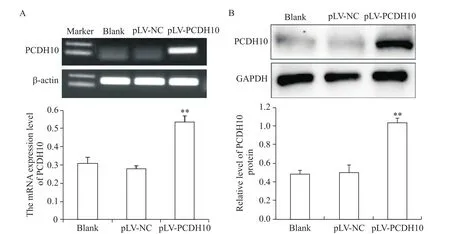
Figure 2.PCDH10 expression was signifcantly increased in MDA-MB-231 cells transfected with pLV-PCDH10.A:the mRNA expression of PCDH10 was detected by RT-PCR;B:the protein expression of PCDH10 was determined by Western blot.Mean±SD.n=3.**P<0.01 vs blank group or pLV-NC group.图2 转染后MDA-MB-231细胞中PCDH10的mRNA和蛋白表达水平
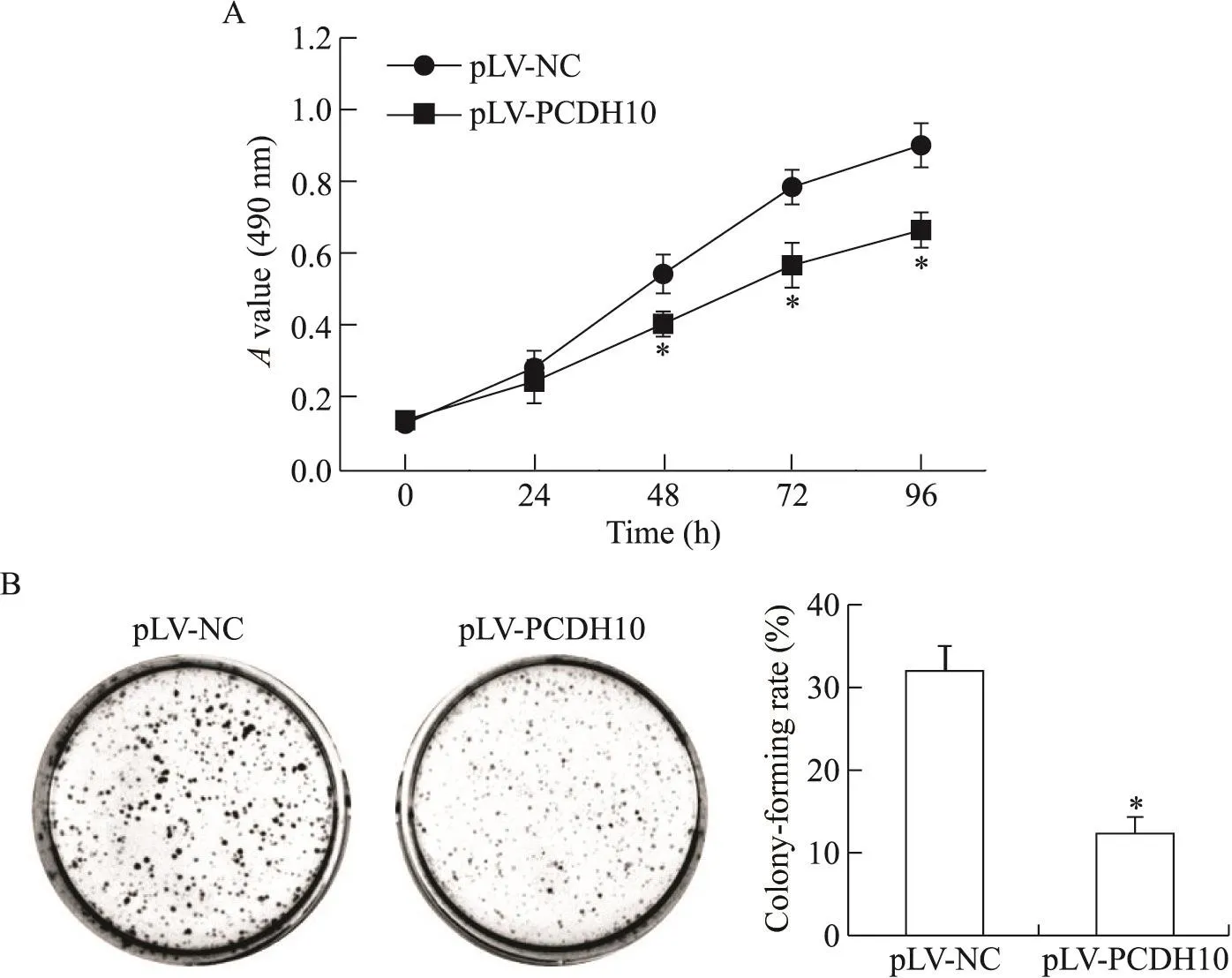
Figure 3.Overexpression of PCDH10 inhibited the proliferation of breast cancer MDA-MB-231 cells in vitro.A:the cell viability was measured by MTT assay;B:the growth of the cells was detected by colony formation assay.Mean±SD.n=3.*P<0.05 vs pLV-NC group.图3PCDH10过表达对MDA-MB-231细胞增殖的影响
6 过表达PCDH10对NF-κB和IκBα蛋白表达的影响
利用Wetern blot检测过表达PCDH10细胞中磷酸化NF-κB p65和p-IκBα蛋白表达变化。结果显示,与pLV-NC组相比,pLV-PCDH10组中NF-κB p65和IκBα蛋白的磷酸化水平均显著降低(P<0.01),见图6。
讨 论
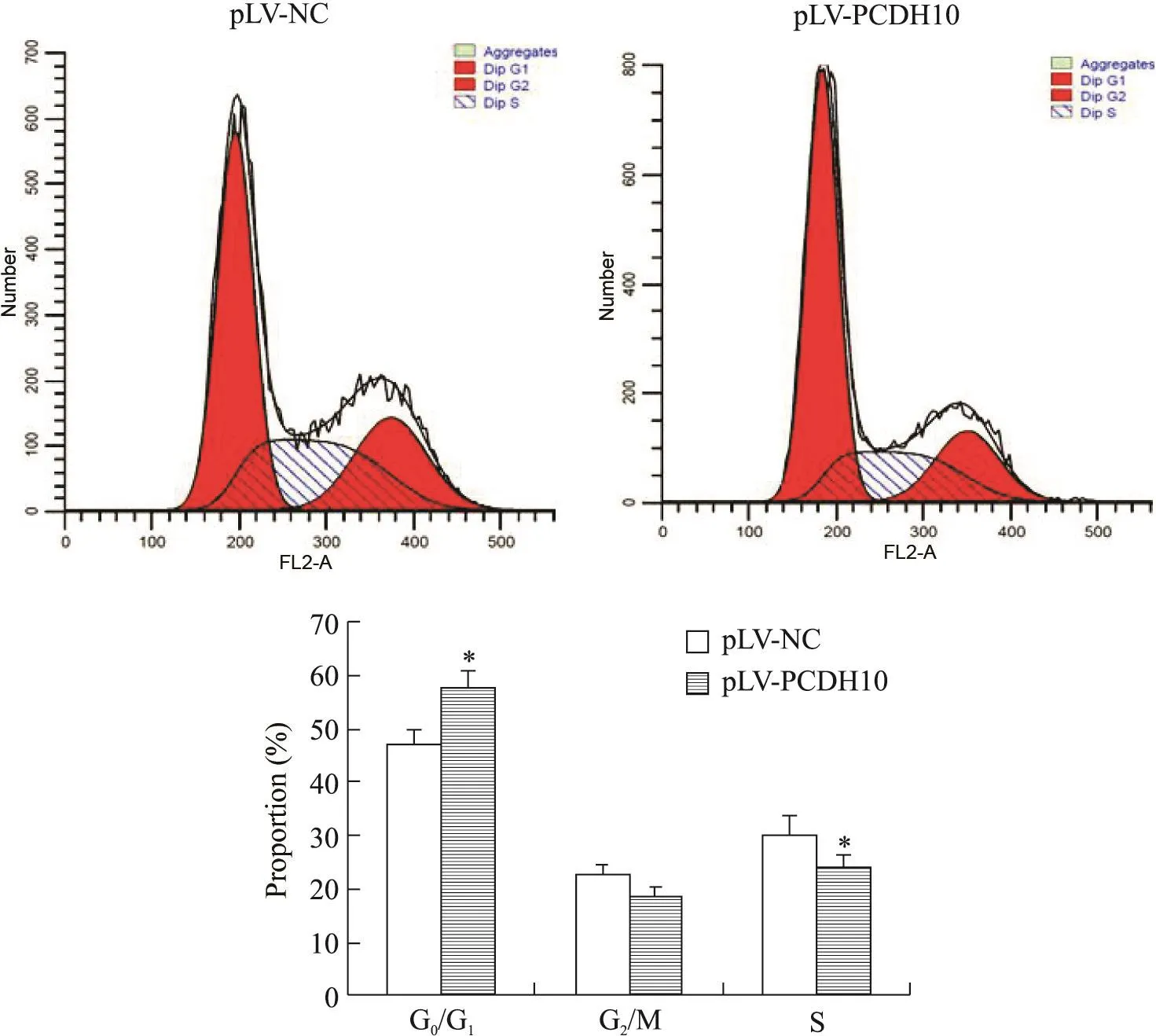
Figure 4.PCDH10 overexpression induced MDA-MB-231 cell cycle arrest at G1phase.The distribution of cell cycle was analyzed by fl ow cytometry.Mean±SD.n=3.*P<0.05 vs pLV-NC group.图4 PCDH10过表达对MDA-MB-231细胞周期的影响
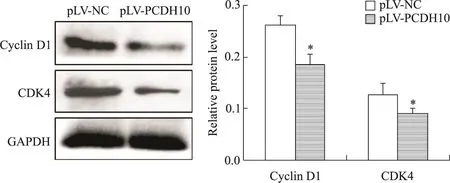
Figure 5.PCDH10 overexpression suppressed the expression of cell cycle-related proteins cyclin D1 and CDK4.The protein expression levels of cyclin D1 and CDK4 were examined by Western blot.GAPDH was used as an internal loading control.Mean±SD.n=3.*P<0.05 vs pLV-NC group.图5 过表达PCDH10对cyclin D1及CDK4蛋白表达的影响
PCDH10基因位于人类染色体4q28.3,属于原钙黏连蛋白家族的成员,在细胞间的信息传递、细胞黏附和分化等方面发挥重要作用;还在神经细胞中参与轴突引导,影响神经元活性,维持神经回路稳定及细胞形成的功能[10-11]。最近的研究认为,PCDH10是一种新型的肿瘤抑制基因,在肺癌、胃癌、食管癌、鼻咽癌、宫颈癌等多种实体肿瘤中表现出表观遗传学沉默作用[12],并与肿瘤的发生、增殖、侵袭及转移密切相关[13-14]。PCDH10的表达和甲基化状态异常还与肝癌[15]、胰腺癌[16]患者预后相关,PCDH10表达的下调预示着预后不良。这些研究表明PCDH10在肿瘤的发生发展中扮演着重要角色。Liu等[9]报道乳腺癌患者PCDH10发生异常甲基化,而PCDH10在乳腺癌细胞中具体发挥的生物学作用及其相关分子机制尚不清楚。

Figure 6.PCDH10 overexpression suppressed the phosphorylation of NF-κB p65 and IκBα in MDA-MB-231 cells.The phosphorylation levels of NF-κB p65 and IκBα were detected by Western blot.GAPDH was used as an internal loading control.Mean±SD.n=3.**P<0.01 vs pLV-NC group.图6 过表达PCDH10对MDA-MB-231细胞NF-κB和IκBα蛋白的影响
本研究通过RT-PCR检测显示,MDA-MB-231、MCF-7、ZR-75-1和Bcap37这4种乳腺癌细胞中PCDH10的mRNA表达水平均低于正常乳腺上皮MCF-10A细胞,提示PCDH10在乳腺癌细胞中存在表达下调或者缺失。我们将PCDH10慢病毒过表达载体成功转染入MDA-MB-231细胞进一步研究PCDH10对乳腺癌细胞功能的影响。细胞增殖能力的分析显示,PCDH10过表达可抑制细胞生长,降低细胞增殖能力,提示PCDH10可能参与乳腺癌细胞增殖的调控。Ying等[7]证实PCDH10过表达可以减少非小细胞肺癌H1650和H1975细胞的增殖和迁移;在肝癌细胞中,PCDH10的上调抑制HepG2和HuH7细胞增殖及集落形成[17]。我们的结果与这些研究结果相一致,表明PCDH10能够影响肿瘤细胞的增殖。
真核细胞通过调控细胞周期维持机体的正常代谢和增殖,细胞周期调控紊乱使肿瘤细胞异常增殖是肿瘤的基本特征[18]。因此,我们进一步检测了PCDH10过表达对乳腺癌MDA-MB-231细胞周期的影响,结果表明PCDH10过表达可引起G0/G1期细胞周期阻滞,使进入S期的细胞比例减少,从而抑制细胞增殖。细胞周期相关蛋白cyclin D1能够在G1期达到表达峰值,是细胞周期启动因子,可与CDK4/6结合,介导G1到S期的转换,当我们评估PCDH10过表达后cyclin D1和CDK4表达水平时,发现二者的蛋白表达量均减少。这表明PCDH10可通过阻滞细胞周期而抑制乳腺癌细胞增殖。
NF-κB是一个存在于真核细胞中的核转录因子,在人类多种恶性肿瘤均观察到NF-κB p65活化,并在肿瘤细胞的增殖分化、侵袭和转移过程中发挥重要作用[19]。有研究报道,PCDH10通过抑制NF-κB途径诱导骨髓瘤细胞凋亡[20]。我们观察到在MDAMB-231细胞中过表达PCDH10可使NF-κB p65和IκBα蛋白的磷酸化水平下调。IκB是NF-κB的主要调控抑制蛋白,其磷酸化使NF-κB激活,启动下游基因转录[21],这表明PCDH10能够抑制NF-κB的活性。Hinz等[22]研究表明cyclin D1为NF-κB下游靶基因,其启动子上存在NF-κB结合的位点,当NF-κB表达激活过程被阻滞后,cyclin D1基因的转录表达受抑制,导致细胞周期延迟[23]。因此,我们的结果表明,PCDH10可通过抑制NF-κB p65和IκB的磷酸化阻断NF-κB激活,从而下调cyclin D1等细胞周期相关蛋白表达,使细胞周期调节失控导致乳腺癌细胞的生长增殖受到抑制。
综上所述,PCDH10基因能够抑制乳腺癌细胞的增殖,其作用可能是通过调节NF-κB/cyclin D1信号通路途径,影响细胞周期而发挥抑癌功能。

