基于茎环引物探针法定量检测乙型肝炎病毒miR-3的方法学建立*
陈 希, 崔毅峙, 王 通△
(1暨南大学生命与健康工程研究院,广东广州510632;2东莞微量精准检测研究院,广东东莞523808)
乙型肝炎病毒(hepatitis B virus,HBV)感染所致的慢性乙型肝炎(chronic hepatitis B,CHB)是全球重大的公共卫生问题[1]。CHB难以治愈,患者面临较高停药后病毒反弹的风险[2],其主要原因是HBV遗传物质会以共价闭合环状DNA(covalently closed circular DNA,cccDNA)形式存在于肝细胞核中,形成难以清除的HBV病毒储存库[3-4]。近年来研究发现,约有20%~30%的CHB患者在体内仍有HBV抗原的情况下,停药后未出现病毒反弹,从而形成了CHB功能性治愈的研究方向和领域。功能性治愈即在患者外周血中检测不到病毒抗原和核酸的情况下,允许cccDNA的存在,但要处于静默状态[5-6]。
HBV cccDNA至少可转录出4种HBV RNA,按碱基长度分别被命名为0.7 kb、2.1 kb、2.4 kb和3.5 kb HBV RNA[3-4],其中血清中 HBV RNA 主要以3.5 kb的前基因组RNA(pre-genomic RNA,pgRNA)为主[7]。最新的专家共识表明,血清HBV RNA,尤其是HBV pgRNA可反映肝内cccDNA转录活性,并对多种HBV抗原的临床变化有显著的预后作用[7-10]。除了HBV pgRNA,HBV还可编码一种微小RNA(microRNA,miR),即HBV miR-3,后者通过靶向降低HBV pgRNA和病毒核心抗原的表达而抑制病毒的复制[11]。HBV miR-3还可在CHB患者血浆中被检测出,在急性期患者血浆中含量显著高于恢复期的病人[11]。
虽然Yang等[11]利用茎环引物和SYBR Green染料对HBV miR-3进行了半定量检测,但是该方法基于与宿主miR-16的相对定量,并且未能报道其灵敏性和特异性。HBV miR-3的检测方法学目前尚不成熟。因此,本研究拟通过广泛筛选特异性引物探针组来建立精准绝对定量检测HBV miR-3的方法。
材料和方法
1 材料
1.1 细胞系 Hep3B细胞(携带HBV基因组)和HepG2细胞(HBV阴性)均购自美国模式培养物集存库(American Type Culture Collection,ATCC)。
1.2 主要试剂与仪器 DMEM培养液、胎牛血清(fetal bovine serum,FBS)、丙酮酸钠、磷酸盐缓冲液(phosphate-buffered saline,PBS)、胰蛋白酶、Taq-ManTMMicroRNA Reverse Transcription Kit、TaqMan Universal Master MixⅡ(2×,no UNG)及合成引物均购自Thermo Fisher Scientific;HBV miR-3寡序列标准品(HPLC纯化级别)购于TaKaRa;SsoAdvancedTMUniversal SYBR®Green Supermix购自Bio-rad;miR-cute miRNA提取分离试剂盒购自北京天根生化科技有限公司。PCR仪购自东胜龙;StepOne Plus型实时荧光定量PCR仪购自Thermo Fisher Scientific。
2 方法
2.1 细胞培养 Hep3B及HepG2细胞均以完全DMEM培养液进行培养,完全DMEM培养液含10%FBS、1 mmol/L 丙酮酸钠、1×105U/L青霉素、100 mg/L链霉素和10 mg/L环丙沙星。细胞于37℃、5%CO2培养箱中培养。
2.2 茎环逆转录引物设计 设计的序列在PrimerSelect进行二级结构分析,序列5'端和3'端能互补配对形成稳定的茎环结构,接着我们在茎环序列的3'端加入与目标miRNA 5'端互补配对的核苷酸,再利用PrimerSelect进行引物二级结构分析,3'端能稳定暴露出与miRNA相匹配片段的为合适的茎环逆转录引物。
2.3 miRNA提取 细胞miRNA提取使用miRcute miRNA提取分离试剂。细胞用胰蛋白酶消化后,用完全DMEM培养液重悬,用血细胞计数板进行细胞计数,取约106个细胞进行裂解提取miRNA。步骤简介如下:离心沉淀细胞后加入裂解液MZ,在涡旋仪上充分涡旋混匀,室温孵育5 min。加入200µL氯仿,剧烈震荡15 s,室温孵育5 min。于4℃、13 400×g离心15 min。吸取上层约500µL溶液转移至新EP管。缓慢加入215µL无水乙醇,混匀后加至吸附柱miRspin,室温13 400×g离心30 s,保留流出液。吸取600µL流出液于新EP管,加入450µL体积无水乙醇,加至吸附柱miRelute,室温13,400×g离心 30 s,每次均弃流出液,保留吸附柱。吸附柱依次经去蛋白液MRD和漂洗液RW洗涤离心弃废液后,加入RNase-free water洗脱miRNA。
2.4 miRNA逆转录 逆转录试剂盒为TaqManTMMicroRNA Reverse Transcription Kit。实验设计中包含10倍浓度梯度稀释的HBV miR-3标准品样品,储液浓度为6.02×1015copies/L(下文以E加数字代表样品拷贝数的数量级),根据实验需求用RNase-free ddH2O进行稀释,设置阴性对照NTC(no template control)。逆转录体系为15 µL,其中样品5µL,逆转录引物工作浓度为80 nmol/L,其他试剂及其用量按说明书推荐使用。逆转录程序为:冰上孵育5 min,16℃ 30 min,42℃ 30 min,85℃ 5 min,4℃保存。
2.5 SYBR Green法qPCR 使用SsoAdvancedTMUniversal SYBR®Green Supermix(2×)试剂盒。qPCR体系为20µL,其中逆转录产物2µL,前引物(forward primer,F primer)工作浓度为1.5 µmol/L,后引物(reverse primer,R primer)工作浓度为0.7µmol/L,其他试剂及其用量按说明书推荐使用。qPCR程序为:95℃ 30 s;95℃ 10 s,60℃ 10 s,40个循环。熔解曲线程序按照StepOne Plus仪器内部设定。
2.6 TaqMan MGB探针法qPCR 使用TaqMan Universal Master MixⅡ(2×,no UNG)试剂盒。qPCR体系为20µL,其中逆转录产物2µL,前引物(F primer)的工作浓度为1.5µmol/L,后引物(R primer)的工作浓度为0.7µmol/L,TaqMan MGB探针工作浓度为0.2µmol/L,其他试剂及其用量按说明书推荐使用。qPCR程序为:95℃ 10 min;95℃ 15 s,60℃ 1 min,40个循环。
3 统计学处理
对浓度梯度标准品样品浓度进行以10为底的对数转化,再与相对应的Ct值进行最小二乘法线性拟合标准曲线,计算决定系数R2,并计算扩增效率Eff%=[10^(-1/slope)-1]×100%。
结 果
1 Yang等[11]报道的方法存在非特异扩增
为了验证Yang等[11]所报道方法的特异性及灵敏度,我们首先重复了该实验。样品为人工合成的HBV miR-3标准品,10倍浓度梯度范围设置从E6到E1,阴性对照为NTC和H2O。
HBV miR-3标准品在浓度范围为E6~E3时,扩增曲线在浓度梯度标准品能区分开,而在E2和E1浓度下时,扩增曲线与阴性对照NTC和H2O大致重叠(图1A)。HBV miR-3标准品在E6~E3浓度范围内时,熔解曲线为单峰曲线(图1B中黑色曲线),熔解温度约85℃,说明HBV miR-3标准品在该浓度范围下扩增产物单一。而阴性对照NTC与H2O有熔解峰(图1B红色与蓝色曲线),当HBV miR-3标准品在E2和E1浓度下时,熔解曲线出现杂峰(图1C黑色曲线)。
2 SYBR Green法筛选出特异性较好的引物组
为了实现对HBV miR-3的微量精准定量,本研究基于茎环引物RT-qPCR方法的原理,针对HBV miR-3序列设计特异性的茎环逆转录引物和荧光定量PCR引物(序列见表1),并使用SYBR Green法对引物进行测试。
其中KEY和T1~T6为文献报道的茎环,C1~C18为自行设计的茎环,区别是茎环部分的序列不同。对引物组进行测试,筛选条件为:阳性对照Hep3B细胞熔解峰与标准品重叠(“+”表示),阳性对照Hep3B熔解峰单一(“+”表示);以总循环数40减去阴性对照NTC与H2O的Ct值所得的值来衡量阴性对照非特异干扰情况,值越小表示非特异干扰越小。根据以上条件对所有引物组进行排列,结果汇总于表2,其中表现较佳引物组和较差引物组的代表性溶解曲线分别见图2A、B。
接着我们选择了排列前6套引物组,进一步设计特异性TaqMan MGB探针(序列见表3),以提高敏感性和特异性。
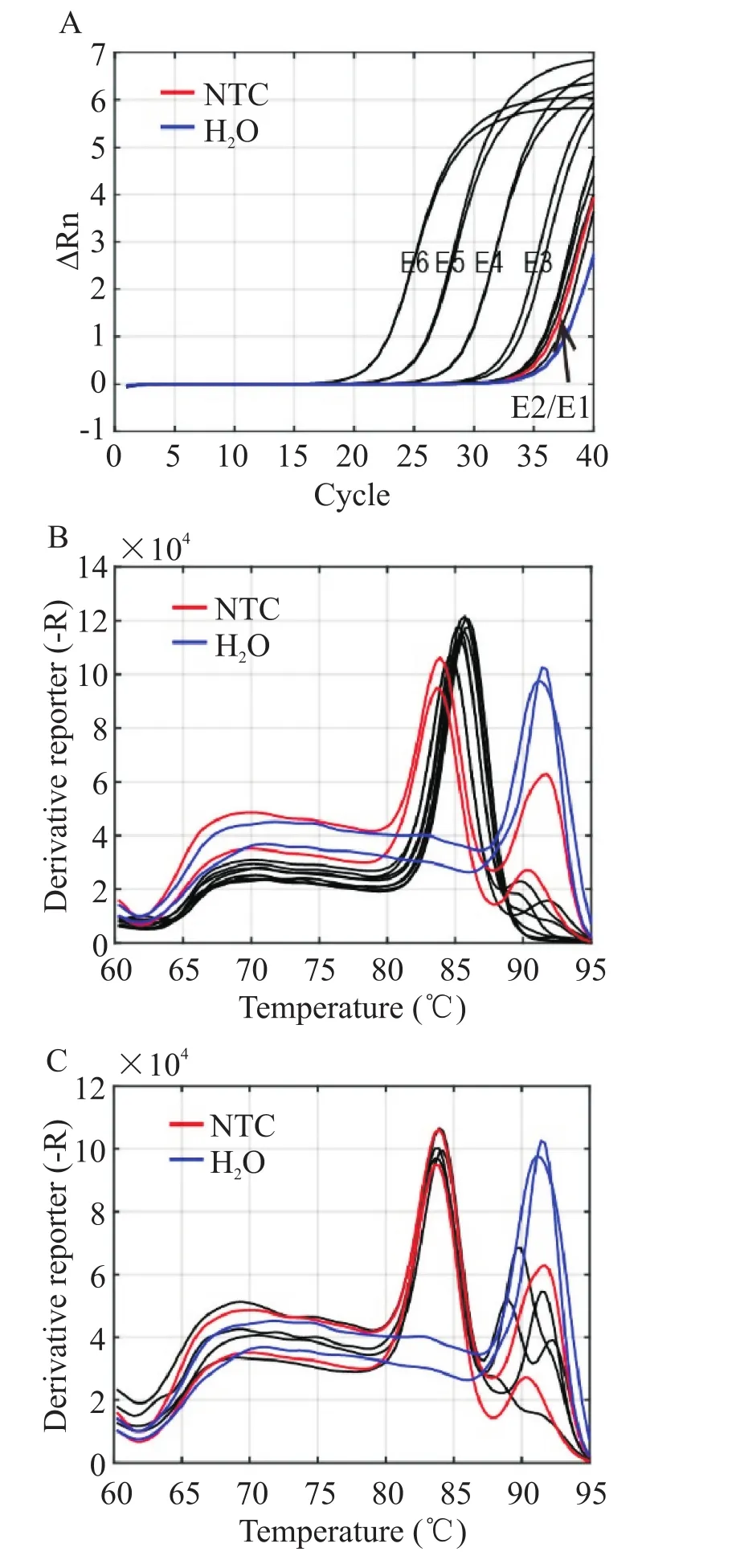
Figure 1.Non-specific amplification was found while using methods reported by Yang et al[11] to measure HBV miR-3.A:the amplification curves(the black curves from left to right are standards from E6 to E1,respectively);B,C:the melting curves(the black curves in B are gradient standards from E6 to E3,and the black curves in C are gradient standards from E2 to E1).The red and blue curves represent the negative controls of NTC(no template control)and H2O,respectively.图1 Yang等[11]报道的方法在检测HBV miR-3时存在非特异扩增
3 确定具有高敏感性和特异性的定量检测HBV miR-3标准品的引物探针组
为了测试引物探针的特异性及灵敏度,本研究使用10倍浓度梯度标准品(范围从E8到E1)、阴性对照NTC和H2O。结果如图3所示,左侧为扩增曲线图,右侧为拟合标准曲线图。其中C5的阴性对照NTC和H2O无扩增,标准品的线性扩增范围为E4~E8,扩增效率仅68.4%,标准曲线决定系数R2为0.989(图3A)。C7的阴性对照NTC和H2O无扩增,标准品的线性定量范围为E3~E8,扩增效率为94.2%,标准曲线决定系数R2为0.985(图3B)。C18的阴性对照NTC和H2O无扩增,标准品的线性定量范围为E3~E7,决定系数R2为0.998,扩增效率为90.8%(图3C)。KEY的阴性对照NTC和H2O无扩增,标准品的线性定量范围为E2~E8,决定系数R2为0.997,扩增效率为88.0%(图3D)。T3的阴性对照NTC和H2O无扩增,标准品的线性定量范围E3~E8,决定系数R2为0.992,扩增效率为86.5%(图3E)。T5的阴性对照NTC出现了非特异扩增(图3F),虽然该组引物在标准品样品上表现良好,标准曲线线性范围在E2~E8,扩增效率(94%)较KEY高,但特异性没KEY好。综合以上各套引物在标准品中的定量结果,我们认为KEY是用于HBV miR-3定量检测的最佳引物,检测的特异性和灵敏度均在设计的引物中表现最好(图3D)。
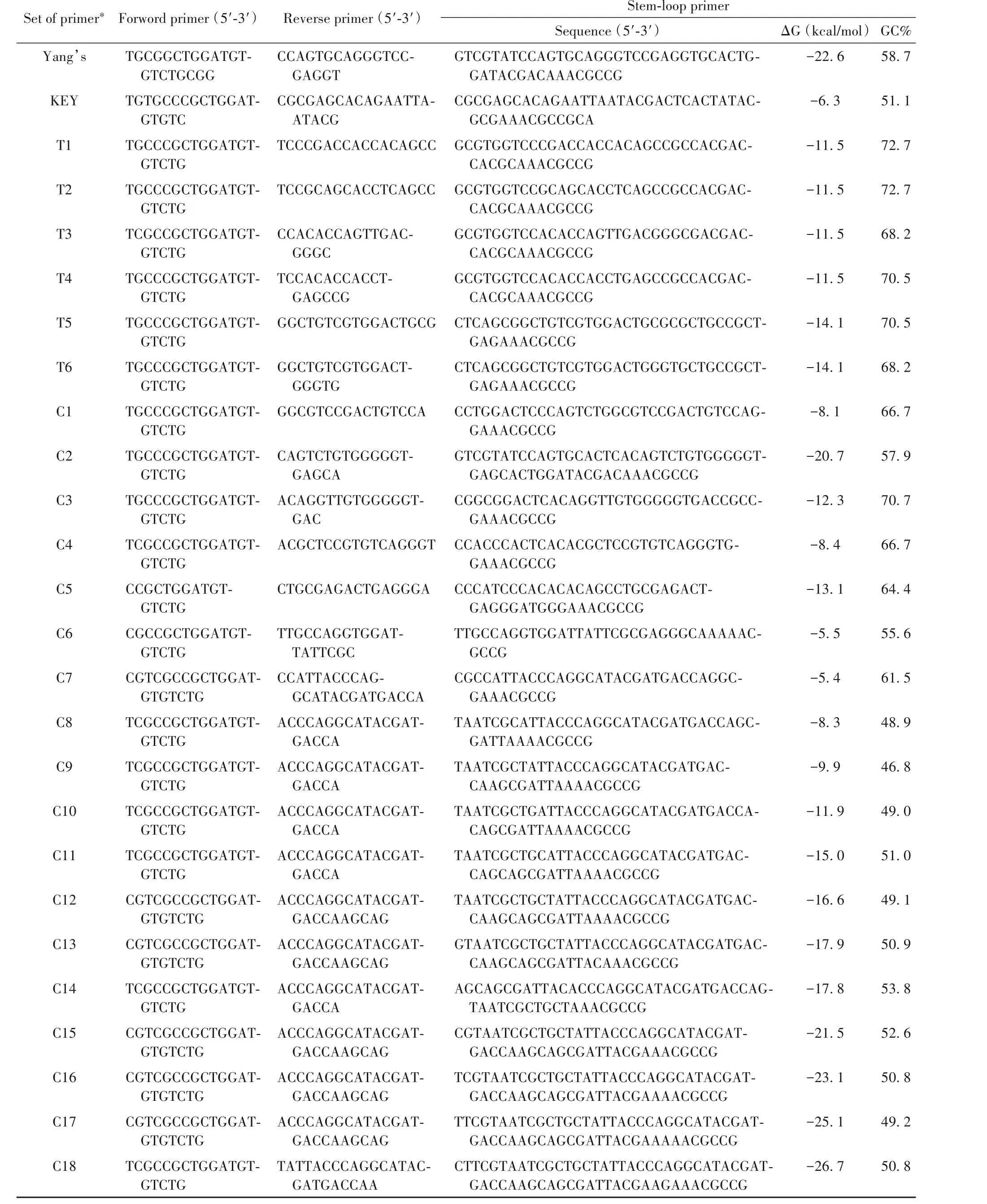
表1 引物序列信息Table 1.List of primer sequences
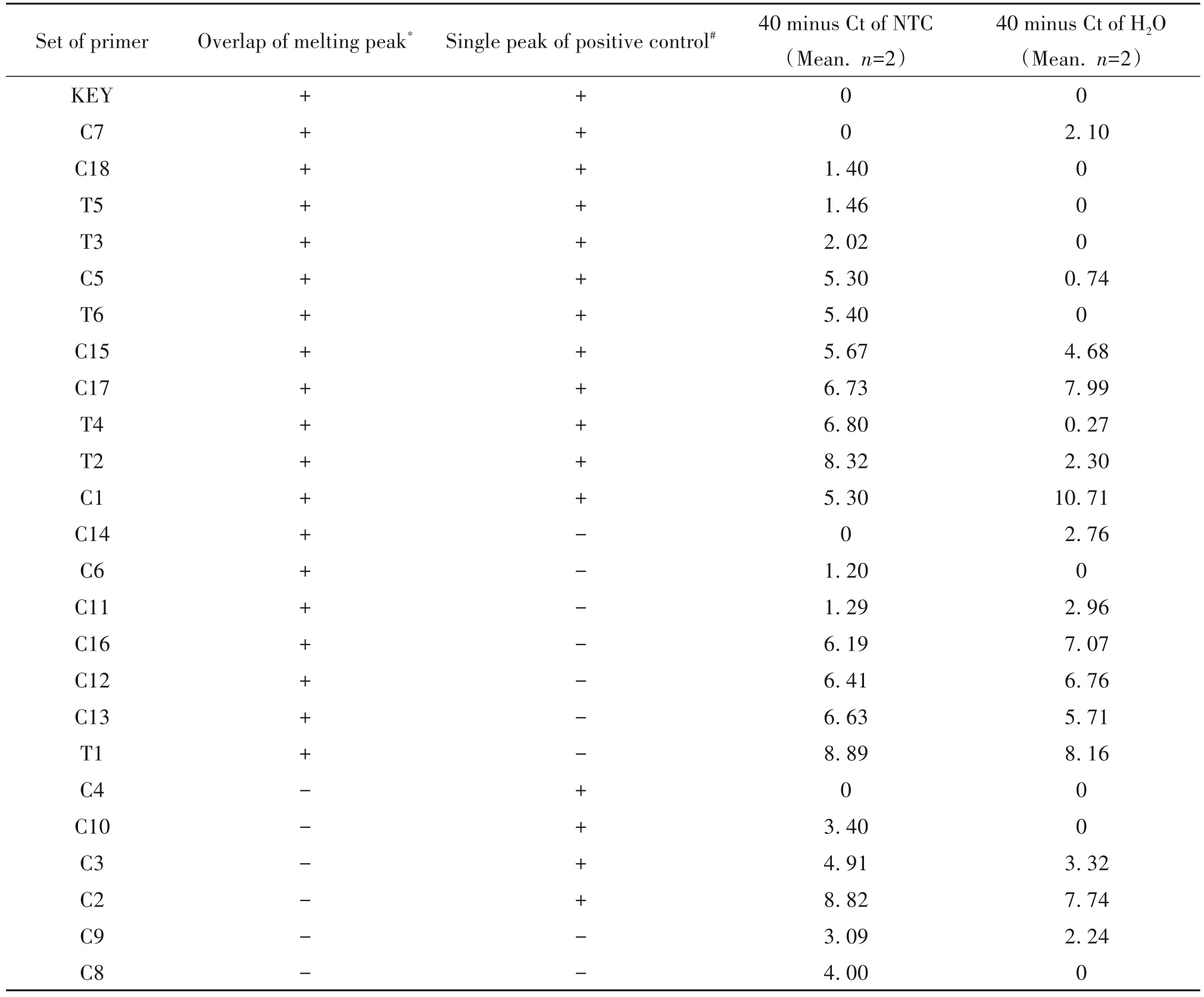
表2 SYBR Green法中各引物组表现汇总Table 2.Performance of primer sets in SYBR Green qPCR
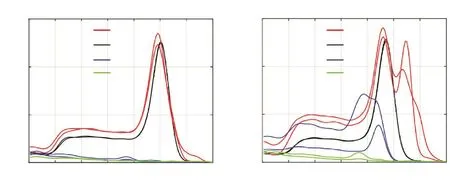
Figure 2.Screening of specific primers using SYBR Green method for specific measurement of HBV miR-3.Representative melting curves that are acceptable and unacceptable are shown in A and B,respectively.图2 HBV miR-3特异性引物SYBR Green法筛选
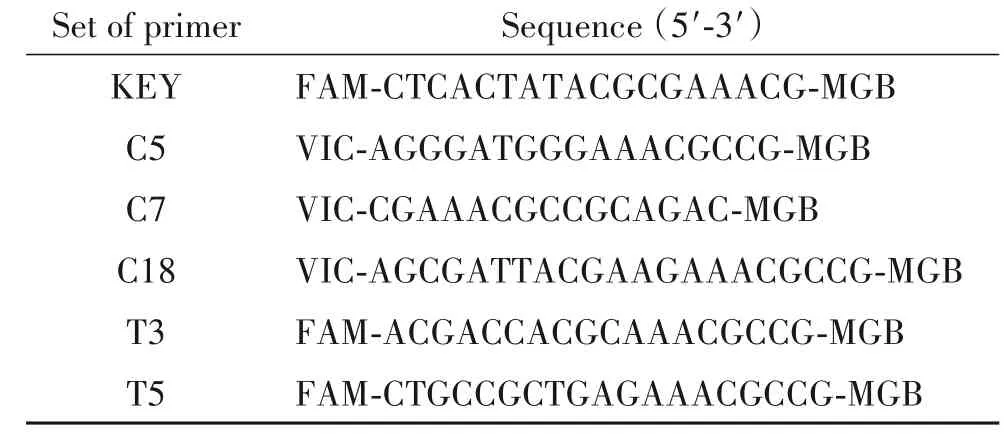
表3 TaqMan MGB探针序列信息Table 3.List of TaqMan MGB probe sequences
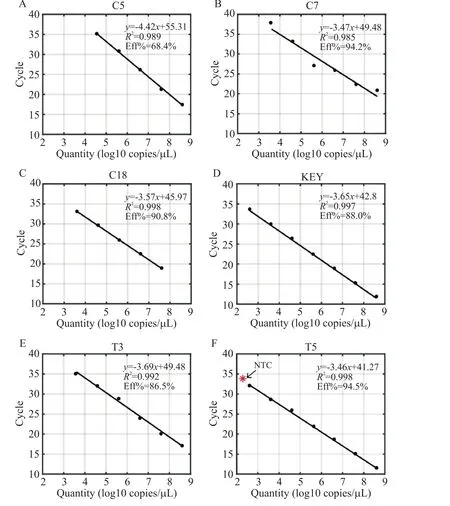
Figure 3.Screening of specific primer-probes for specific and sensitive measurement of HBV miR-3.A~F:the standard curves of C5,C7,C18,KEY,T3 and T5,respectively.The red dot in F represents the NTC(no template control).图3 HBV miR-3特异性高灵敏引物探针组中的筛选
4 在细胞系内验证HBV-miR-3新引物探针组的表现
本研究对HBV阳性的Hep3B细胞和HBV阴性的HepG2细胞提取的miRNA进行检测,结果如图4所示,C5和C7两套引物Hep3B细胞中HBV miR-3的Ct值接近40,可认为未检出。C18、KEY、T3和T5均能检测出Hep3B细胞中的HBV miR-3,Ct值最低为27(在T3中),最高为31(在C18中),且阴性对照RT-free均无扩增。在阳性对照能被顺利检测出的几套引物中,对于HepG2细胞样品,在C18中未检出,在其余几套中有非特异检出,其中KEY引物探针组在HepG2细胞中的Ct值约为37,在Hep3B细胞中的Ct值约为29,仍然表现出良好的特异性和敏感性。
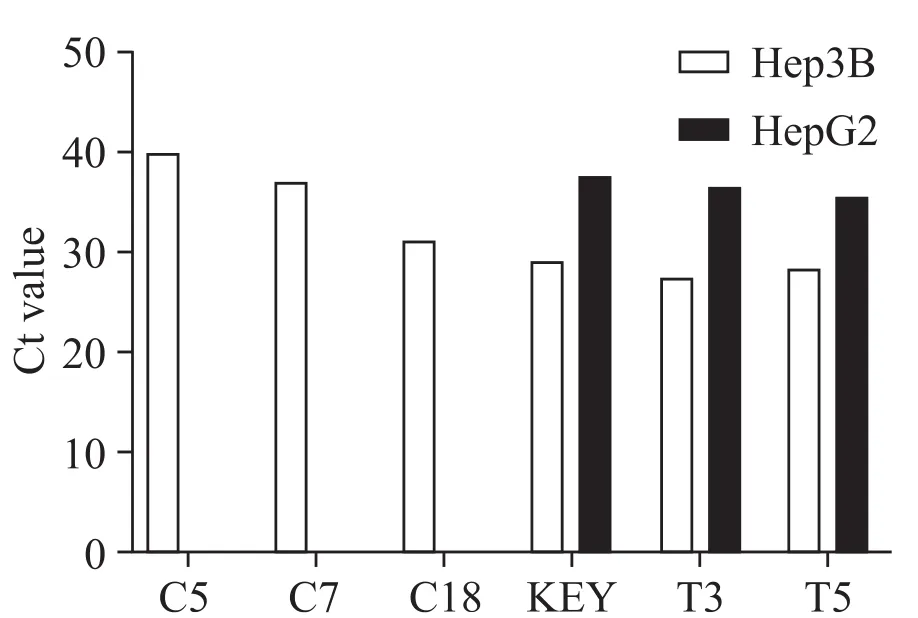
Figure 4.Measurement of HBV miR-3 in cell lines using the 6 sets of primers with TaqMan MGB probes.Different primer-probe sets were tested for measuring HBV miR-3 in HBV-positive Hep3B cells and HBV-negative HepG2 cells.Each bar showed mean Ct value of 2 independent experiments.图4 新引物探针组在细胞系中定量检测HBV miR-3的情况
讨 论
本研究通过重复了HBV miR-3发现者Yang等[11]在文献中使用的相对定量法方法,显示该SYBR Green法存在较为明显的非特异扩增。基于茎环引物探针RT-qPCR方法,本研究综合评价了多个茎环包括Yang等[12]改进的key-like茎环(即KEY)、Feng等[13]使用的茎环和根据茎环设计原理[14]自主设计的18个通用茎环,进而利用以上茎环,针对HBV miR-3序列设计特异性逆转录茎环引物。虽然设计的原理相同,研究表明不同的茎环引物及其qPCR引物对有较大差异。结合TaqMan MGB探针测试,确定了一套灵敏度和特异性最佳的引物探针组KEY,成功建立了一套HBV miR-3微量、特异的绝对定量方法,为后续研究HBV miR-3的生物学功能和临床意义奠定了重要基础。
目前miRNA的定量检测方法有很多,如传统的Northern blotting、microarray、茎环引物探针RT-qPCR技术等,还有基于等温核酸扩增技术、滚环扩增技术、纳米技术等新兴技术[15]。但是,综合考量各种方法的灵敏度、特异性、成熟度、方便程度等,目前应用最广的为茎环引物探针RT-qPCR技术[14]。
本研究进行SYBR Green实验时发现,在目标miRNA浓度较高时,特异性往往好,在浓度低时,目标miRNA在梯度间往往区分不开;且从熔解曲线看,低浓度样品与阴性对照会出现非特异的产物峰。因此,对于丰度比较高的miRNA,我们认为SYBR Green法进行相对定量仍是较好的方法,但也要进行引物设计和PCR条件优化以尽量减少非特异性干扰。例如,有研究者把使用SYBR Green法的qPCR循环数降低到35,以排除非特异扩增干扰[16]。Feng等[13]使用设计的几个茎环引物,结合SYBR Green法建立一套检测番茄在病毒感染后的多个miRNA变化的方法,但其扩增效率均高于100%,说明其中存在非特异干扰。
如本文前言所述,HBV感染的问题主要在疗效评估,这就需要我们对治疗后残留的病毒核酸能够准确定量,SYBR Green法在这种需求上有局限性。本文所报道的方法是针对HBV miR-3的首个引物探针法,并且达到了极低的定量检出限和标准曲线动态范围(E2~E8),同时在维持高扩增效率的同时保证了特异性。而SYBR Green法的定量检出限仅在E4~E3水平,灵敏度比我们报道的KEY引物探针组低了近100倍。本研究的结果也展示了SYBR Green法在检测HBV miR-3中的非特异性检出问题较突出。
即使都使用引物探针法,不同引物探针组的表现也不尽相同。我们认为,这可能与茎环引物的特性有关。例如,由Yang等[12]设计的key-like茎环在茎的部分只有4对CG碱基进行互补配对,环的部分有27个碱基,环中有4对间隔的碱基互补配对,是茎环结构能够形成的原因,但其ΔG约为-6.3 kcal/mol,整体稳定性较Chen等[14]设计的茎环(ΔG约为-22.6 kcal/mol)弱。其前后引物和探针设计的方法与Chen等[14]不同,前引物全部为miRNA序列,后引物为茎环特异序列,探针设计跟在前引物之后,只有3个碱基属于miRNA。该设计理论上存在的问题是,逆转录引物会与探针结合,前引物的熔解温度无法通过5'端突出部分进行调节,因此引物设计时限制条件比较多,从其结果看,阴性对照NTC也会出现非特异扩增。因此我们选择以Chen等[14]的原理设计后续的qPCR前后引物及探针,结果消除了阴性对照的非特异干扰。较弱的茎环稳定性也使其在进行qPCR定量时,茎环结构易于打开,从而提高了检测效率,由于序列本身较短,也不易产生非特异干扰。
综上所述,基于茎环引物探针RT-qPCR定量检测miRNA的方法,我们设计并评价了一套灵敏度和特异性的引物探针组KEY,成功建立了HBV miR-3微量、特异的绝对定量方法。该方法有望为HBV感染的疗效评估提供新手段和新指标。

