牛病毒性腹泻病毒E2蛋白多表位疫苗筛选及生物信息学验证
何金科,杨亚军,邓肖玉,何延华,张 超,马忠臣,王 震,陈创夫*
(1.石河子大学 生命科学学院,新疆 石河子8320001.2.石河子大学 动物科技学院,新疆 石河子 832000)
牛病毒性腹泻病毒(BVDV)是牛的重要病原体,是单股正链RNA病毒,属于黄病毒科瘟病毒属[2],具有高传染性,能够感染各个年龄阶段牛只,任何规模的牛群。BVDV感染一旦被引入一个地区的牛群中,往往会继续流行,单个牛群的感染状态可以迅速改变。在2~3年内,可以从主动感染变为免疫,再变为易感状态[3]。然而,对于整个牛群而言,持续感染牛(PI)才是BVDV的主要感染源[4],只有阻止PI牛进入牛群才可以停止BVDV传播。BVDV基因组由5′非翻译区(5′UTR) 、1个开放阅读框(ORF)和3′非编码区(3′UTR)组成,由细胞和病毒蛋白酶加工成4种结构蛋白(C、Erns、E1和E2)和8种非结构蛋白(Npro、p7、NS2、NS3、NS4A、1NS4B、NS5A和NS5B)[5-6],在这些糖蛋白中,E2蛋白是BVDV的受体结合蛋白,负责病毒进入宿主细胞[7],并且是主要的保护性抗原,能够诱导病毒中和抗体(VN)并保护牛免受BVDV攻击[8]。当BVDV进入机体后,体液免疫应答主要针对E2和NS2/3,其次是Erns和E1,而接种灭活苗后,主要产生E2抗体,因此E2在BVDV免疫诊断及免疫预防方面具有重要价值[9]。E2作为中和抗体的主要靶标,能够单独诱导保护作用,用E2糖蛋白表达的颗粒疫苗可诱导交叉中和抗体反应,防止白细胞减少,减轻临床症状[10]。利用酵母表达的BVDV E2蛋白可以有效的激活抗原递呈细胞(APC)炎症和吞噬细胞能力,并且诱导T细胞Th1/Th2免疫应答[11]。用重组BVDV E2疫苗免疫小鼠,虽产生高水平抗体,并不能中和所有毒株[12]。BVDV感染是一个复杂的过程,E2蛋白在免疫应答和致病过程中起着极其重要作用,是BVDV引起免疫反应活性的重要保护性抗原,是基因工程疫苗的首选保护性抗原基因,以E2为基础的疫苗研发一直是研究热点[9,13]。目前,通过接种灭活疫苗和减毒活疫苗控制BVDV[14],然而由于成本过高,给疫苗的推广带来困难。因此,需要新的策略来构建一种低成本且有效的BVDV疫苗。本研究中,使用生物信息学方法预测B细胞和T细胞表位,筛选出优势表位组成多表位疫苗,通过免疫信息学方法预测疫苗蛋白的免疫原性和安全性。三级结构预测细化后获得在Ramachandran图的优选区域中精制3D模型。疫苗构建体与TLR3分子对接以检查疫苗的结合能力。最后,通过二硫化物工程和计算机模拟克隆以增加疫苗构建体的稳定性确保其在微生物系统中的有效表达。本研究建立一种筛选多表位疫苗并进行生物信息学验证的新方法,有助于筛选BVDV有效疫苗。
1 材料与方法
1.1 序列来源BVDV E2蛋白完整的氨基酸序列来自NCBI数据库(NP_776263.1)。
1.2 E2蛋白B细胞表位预测使用4种预测软件分析E2蛋白的线性B细胞表位,包括Immunomedicine Group:Tool(http://imed.med.ucm.es/Tools/antigenic.pl);ABCpred Prediction(http://crdd.osdd.net/raghava/abcpred/ABC_submission.html);BepiPred 2.0 Server (http://tools.iedb.org/bcell/)和( http://sysbio SVMTriP.unl.edu/ SVMTriP/prediction.php)。Immunomedicine Group是用免疫医学方法预测能引发抗体反应具有抗原性的区段,在BCPRED服务器上预测线性表位长度为20,特异性默认为75%。在ABCpred上,线性表位预测长度为16,阈值为0.51。BepiPred 2.0服务器上阈值为0.50。在SMVTriP上预测线性表位长度为20。
1.3 E2蛋白T细胞表位预测NetBoLApan(http://www.cbs.dtu.dk/services/Net MHCpan/NetBoLApan/)在线服务器预测MHCⅠ类分子结合表位,使用NetMHCⅡpan 3.2 Server(http://www.cbs.dtu.dk/services/NetMHCIIpan/)预测MHCⅡ类分子结合表位。
1.4 优势表位序列的筛选与融合从预测的B细胞和T细胞表位筛选出高分和重叠肽作为优势表位,将筛选出来的表位引入甘氨酸(G)和丝氨酸(S)进行融合。
1.5 过敏原和抗原性预测基于SVM方法,使用AlgPred服务器对疫苗构建体的过敏原进行预测(http://www.imtech.res.in/raghava/algpred/submission.html ),阈值为-0.40。使用VaxiJen服务器对疫苗构建体的总体抗原进行预测(http://www.ddg-pharmfac.net/vaxijen/VaxiJen/VaxiJen.html),阈值为0.40。
1.6 理化参数的评估及糖基化位点预测使用Expasy的ProtParam(http://us.expasy.org/tools/protparam.html)分析疫苗构建体的物理化学参数,包括理论等电点(pI)、相对分子质量、半衰期、不稳定指数、脂肪指数和亲水性平均值(GRAVY)。使用NetNGlyc服务器( http://www.cbs.dtu.dk/services/NetNGlyc/)预测多表位疫苗的N-糖基化位点。
1.7 二级结构预测使用PSIPRED服务器(http://bioinf.cs.ucl.ac.uk/psipred/)预测疫苗构建体的二级结构。
1.8 三级结构的预测、细化及验证使用RaptorX服务器预测多表位疫苗的三级结构(http://raptorx.uchicago.edu/StructurePrediction/predict/)。然后将得到PDB格式的三级结构图使用GalaxyWEB服务器(http://galaxy.seoklab.org/cgi-bin/submit.cgi?type=REFINE)进行细化,该方法具有改善全局和局部结构质量的能力。最后使用RAMPAGE服务器(http://mordred.bioc.cam.ac.uk/~rapper/rampage.php)验证多表位疫苗的三级结构,产生的Ramachandran图用于分析识别结构模型中潜在错误。
1.9 三级结构突出表位预测为了验证疫苗构建体是否具有强体液免疫和细胞免疫的能力,使用ElliPro服务器(http://tools.iedb.org/ellipro/)预测疫苗构建体三级结构中连续和不连续的抗体表位。
1.10 用于疫苗稳定性的二硫化物工程二硫键形成可以增强疫苗模型的稳定性,在进行下一步之前,有必要提高蛋白模型的稳定性。二硫化物工程是一种用于在目标蛋白质结构中产生二硫键的新方法。使用Disulfide by Design 2 服务器(http://cptweb.cpt.wayne.edu/DbD2/)对疫苗构建体的精制模型进行二硫化物工程。
1.11 疫苗构建体与免疫受体的分子对接为了产生适当的免疫应答,抗原分子须要同免疫受体分子相互作用。使用ClusPro 2.0 (https://cluspro.bu.edu/login.php)服务器进行蛋白质-蛋白质对接,检查设计的疫苗构建体与TLR3(PDB ID:2A0Z)受体的结合亲和力。
1.12 密码子优化和silico克隆最终获得的疫苗构建体需要进行优化以适应其在宿主内表达,使用JCAT服务器(http://www.jcat.de/)进行密码子优化,选择肠杆菌K12宿主,使密码子适应宿主,导致疫苗蛋白更高的表达。在优化的过程中,需要避免非依赖性转录终止,原核生物核糖体结合位点和限制酶的切割位点。使用SnapGene限制性克隆模块将优化后的序列插入pET28a(+)载体中的EcoRⅠ和HandⅢ之间。
2 结果
2.1 BVDV E2蛋白氨基酸序列从GenBank获得NS3蛋白氨基酸序列:374个氨基酸HLDCKPEFSYAIAKDERIGQLGAEGLTTTWKEYSPGMKL-EDTMVIAWCEDGKLMYLQRCTRETRYLAIL-HTRALPTSVVFKKLFDGRKQEDVVEMNDNF-EFGLCPCDAKPIVRGKFNTTLLNGPAFQMVC-PIGWTGTVSCTSFNMDTLATTVVRTYRRSKP-FPHRQGCITQKNLGEDLHNCILGGNWTCVPG-DQLLYKGGSIESCKWCGYQFKESEGLPHYPI-GKCKLENETGYRLVDSTSCNREGVAIVPQGT-LKCKIGKTTVQVIAMDTKLGPMPCRPYEIISS-EGPVEKTACTFNYTKTLKNKYFEPRDSYFQ-QYMLKGEYQYWFDLEVTDHHRDYFAESILV-VVVALLGGRYVLWLLVTYMVLSEQKALG。
2.2 E2蛋白B细胞表位预测使用ImmunoMedicine Group、ABCpred、BepiPred和SVMTriP在线服务器预测E2蛋白的线性表位(表2,3),SVMTriP预测得分越高表示作为潜在表位的可能性越高(表4)。
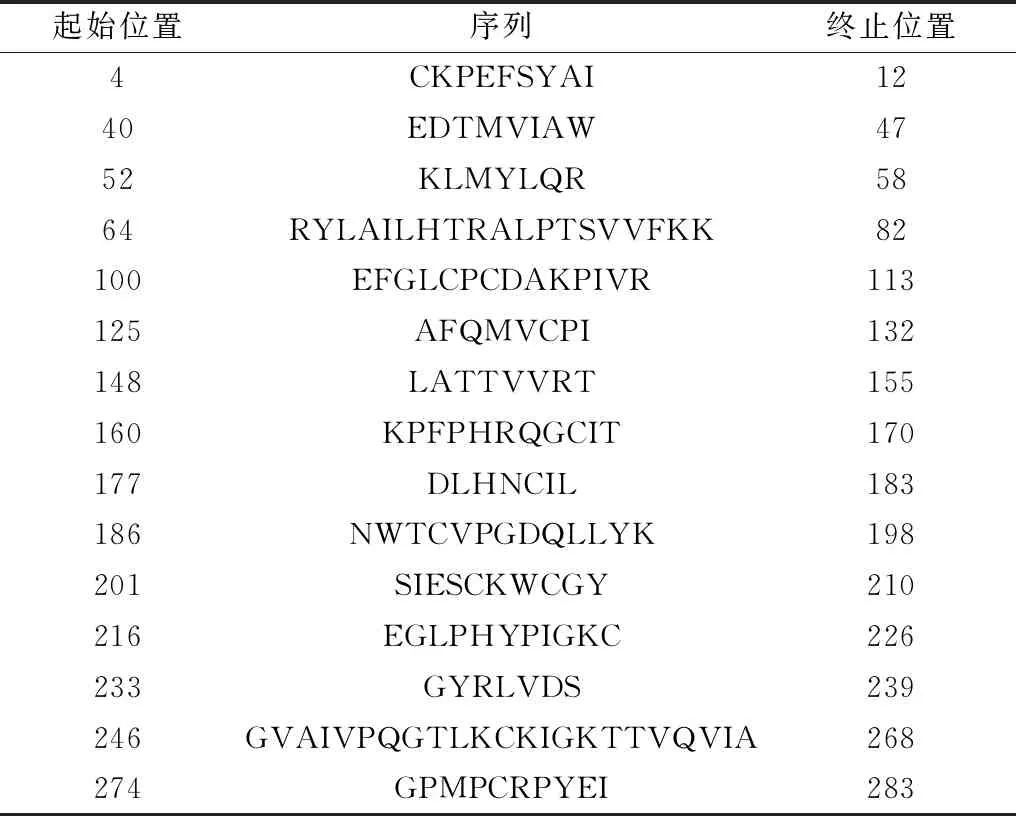
表1 ImmunoMedicine Group服务器预测线性B细胞表位

表2 BepiPred服务器预测线性B细胞表位
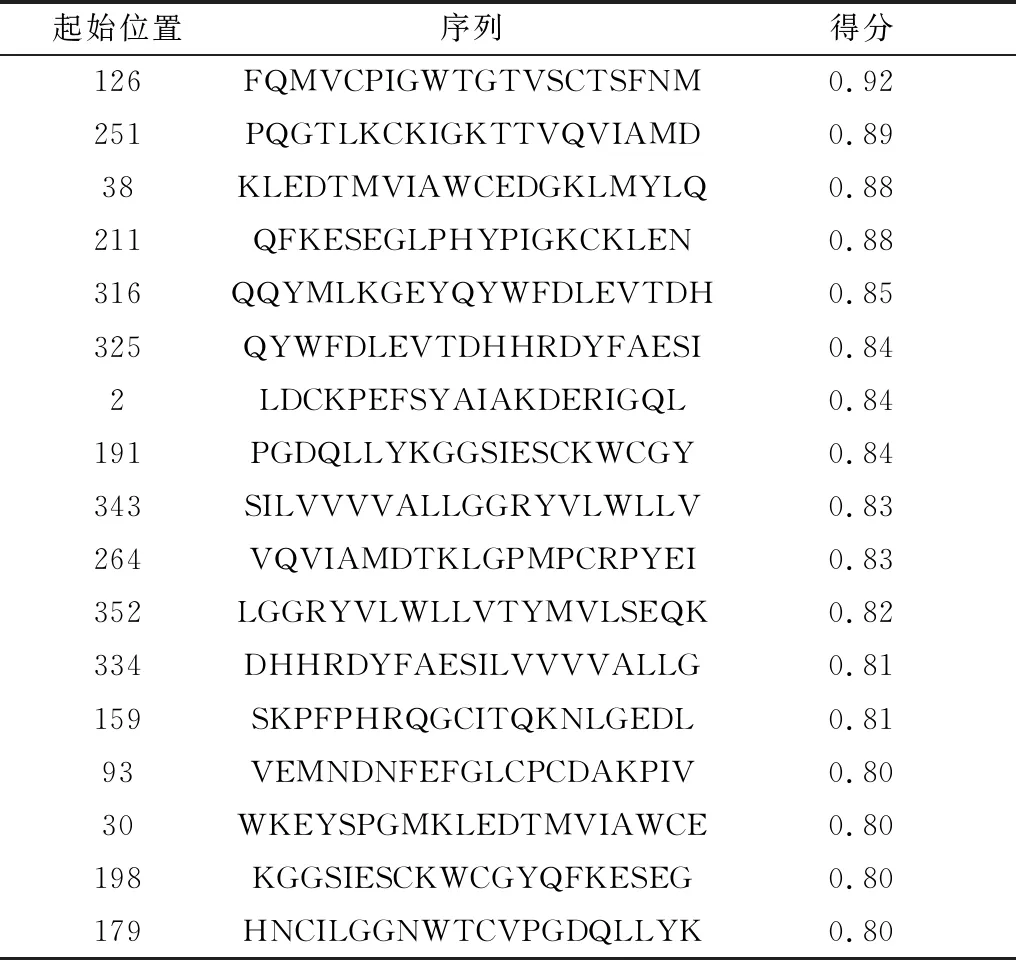
表3 ABCpred服务器预测线性B细胞表位

表4 SVMTriP服务器预测B细胞线性表位
2.3 E2蛋白T细胞表位预测使用NetBoLApan在线预测软件预测E2蛋白MHC-Ⅰ(CD8+T)表位,参数为BoLA-1*02301、BoLA-3*00201和BoLA-4*02401,得分越高结果越可靠(表5)。使用NetMHCⅡpan在线预测软件预测E2蛋白MHC-Ⅱ(CD4+T)细胞表位,参数为HLA-DRB1*0301、HLA-DRB1*0401和HLA-DRB1*0801(表6)。
2.4 E2蛋白优势表位筛选及融合将所得到的T和B细胞表位进行筛选,最终选出E2蛋白10个显性表位(8个用于B细胞,2个用于T细胞),将筛选出来的序列用柔性linker GS连接组装成多表位疫苗(表7)。多表位疫苗的氨基酸序列为WGSFQMVCPI GWTGTVSCTSFNMGSTLATTVVRTYR-RSKPFPHRQGCITGSHNCILGSNWTCVPGDQ-LLYKGSSIESCKWCGYGSPQGTLKCKIGKTT-VQVIAGSYMLKGEYQYWFDLEVTDHHRGS-LAILHTRALPGSRKQEDVVEM。
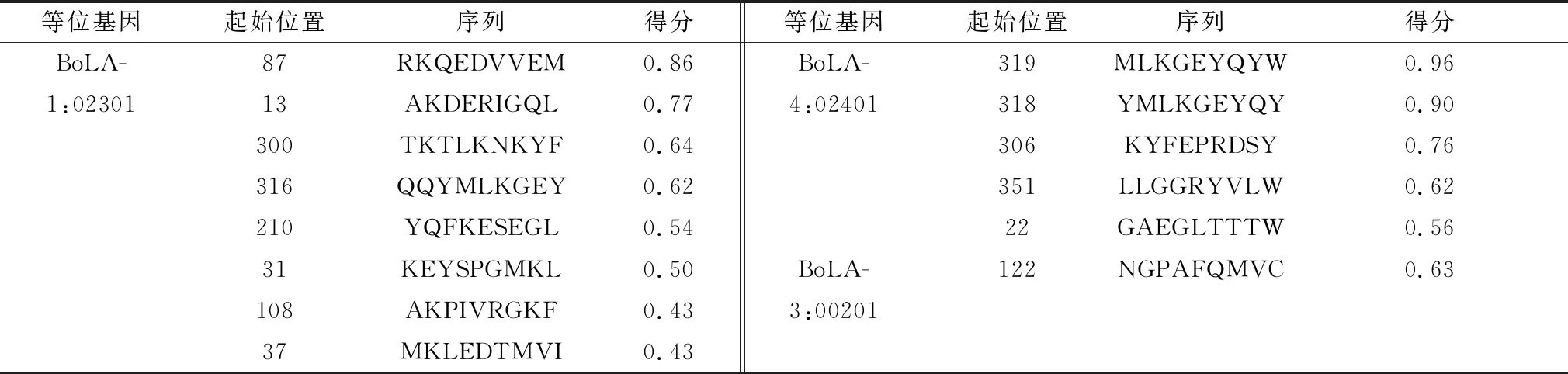
表5 预测E2蛋白MHCⅠ类分子结合表位
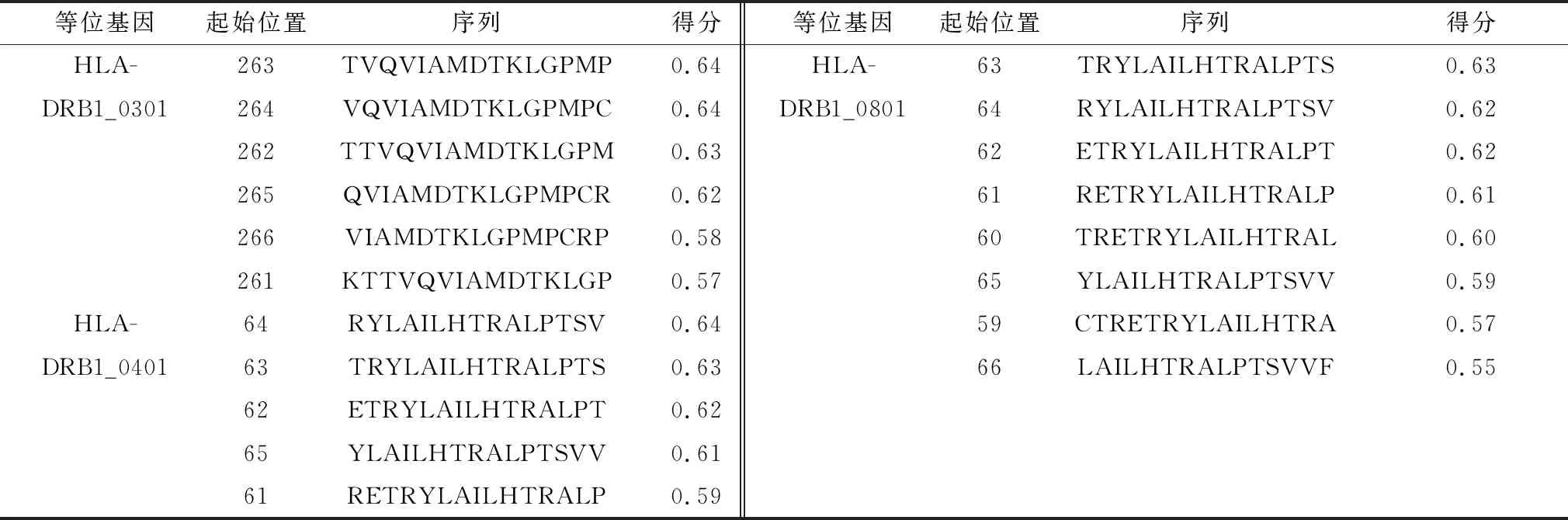
表6 预测E2蛋白MHCⅡ类分子结合表位
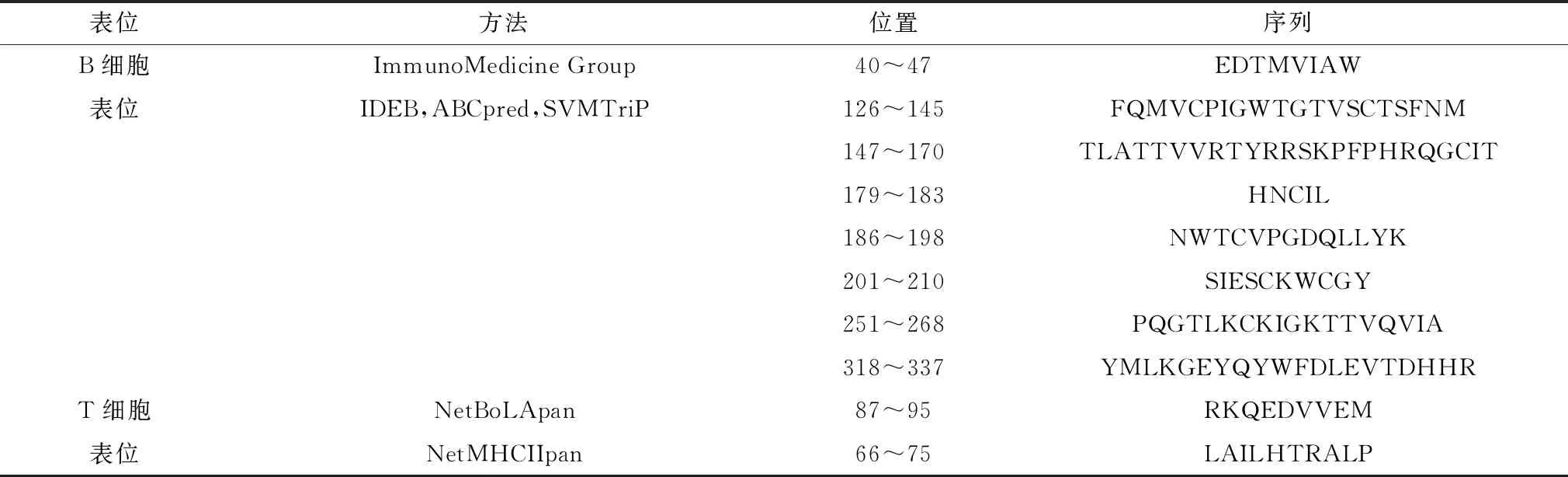
表7 筛选T细胞和B细胞优势表位
2.5 过敏原和抗原性评估AlgPred服务器预测评分为=0.499 64,低于阈值-0.4,表明疫苗构建体本质上是非过敏性的。VaxiJen服务器对抗原预测的评分为0.789 0,显著高于阈值0.4,表明最终的疫苗构建体是良好的抗原。
2.6 多表位疫苗的理化参数及N-糖基化位点ProtParam服务器分析结果表明,疫苗构建体由155个氨基酸组成,化学式为C755H1173N209O223S13,相对分子质量为17 000,理论pI值为8.66,哺乳动物网织红细胞(体外)的半衰期估计为1 h,而酵母和大肠杆菌(体内)的半衰期估计为30 min和大于10 h,脂肪指数为69.10,亲水性的平均值(GRAVY)为-0.211。糖基化与蛋白的稳定性密切相关,NetNGlyc结果表明多表位疫苗具有一个潜在的N-糖基化位点(图1)。
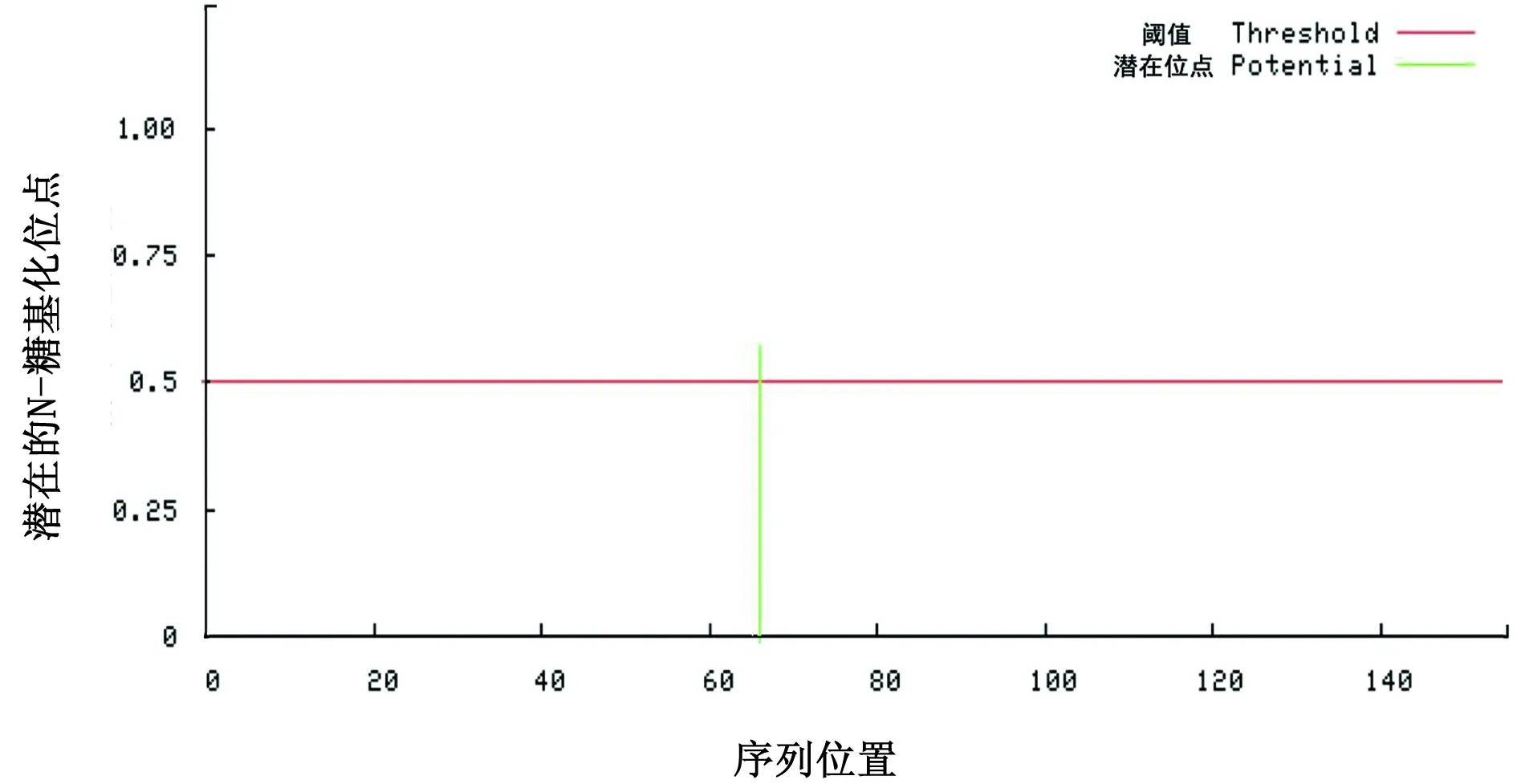
图1 多表位疫苗的N-糖基化位点
2.7 多表位疫苗的的二级结构PSIPRED服务器结果表明,α螺旋占约3.2%,β折叠占约43.2%,无规卷曲占约53.6%(图2)。
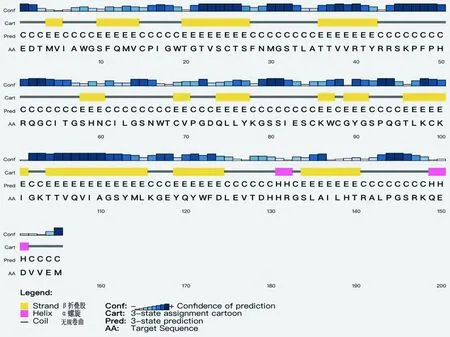
图2 PSIPRED预测二级结构 红色H.α螺旋;黄色E.β折叠股;灰色C.无规卷曲
2.8 多表位疫苗三级结构预测、细化和验证RaptorX服务器成功构建多表位疫苗的三级结构(图3A),Ramachandran作图发现优势区域(favored)中具有88.2%残基,允许区域(allowed)中占7.2%残基和异常区域(outlier)中仅占4.6%残基(图3B)。使用GalaxyWEB服务器进行进一步的细化后生成5个模型,综合评分选择了模型4(图3C),Ramachandran作图显示模块中优势区域(favored)占93.5%残基,允许区域(allowed)中占5.2%残基和异常区域(outlier)中仅占1.3%残基(图3D)。与细化前相比,细化后RAMPAGE得到了更好的结果。
2.9 三级结构表位作图从疫苗构建体的3D模型中预测出了3个线性表位和5个不连续表位,线性表位的最高得分为0.746(图4A),不连续表位最高得分为0.792(图 4B),数量和评分均证实了设计的多表位疫苗具有免疫原性。
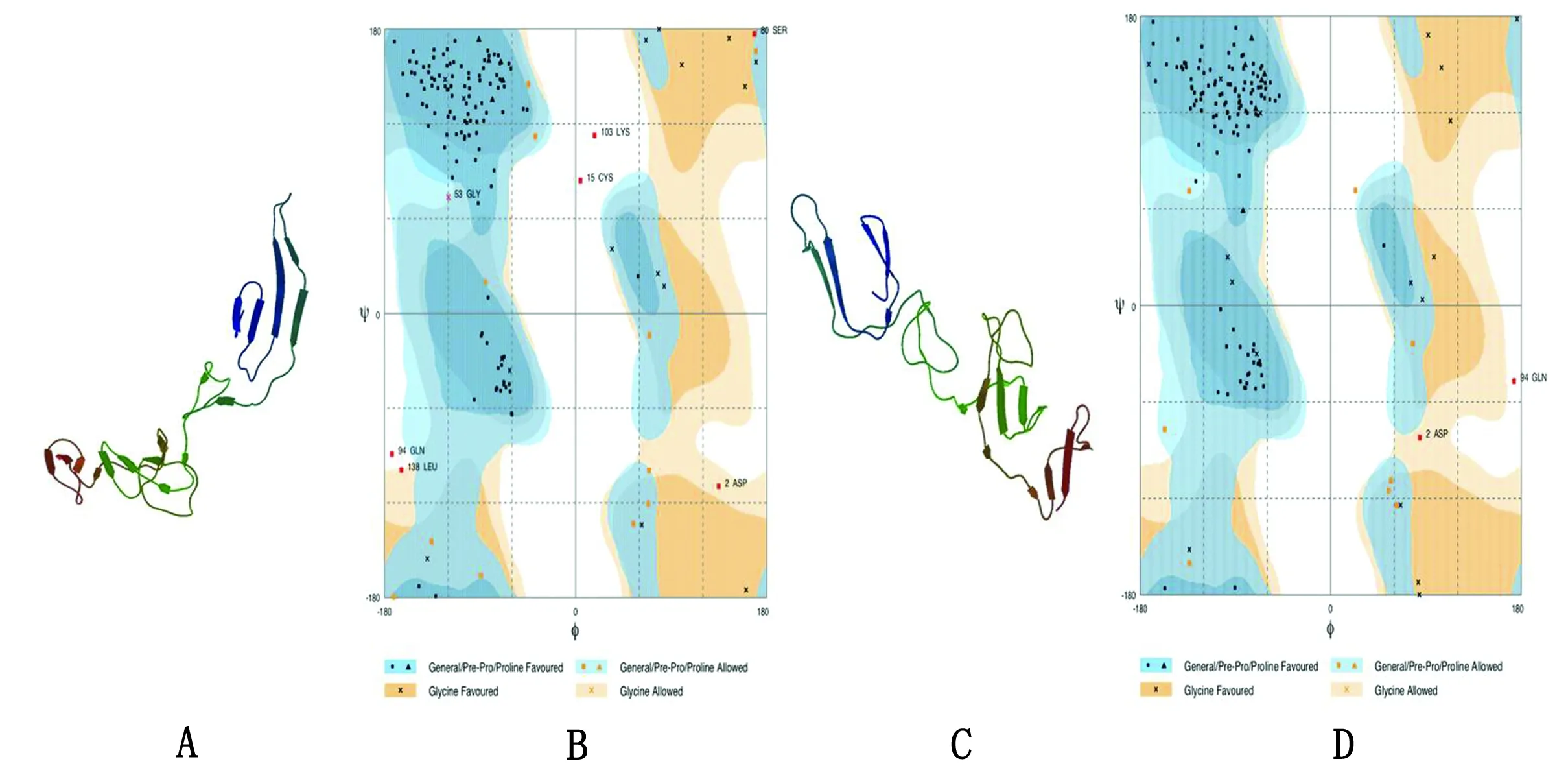
图3 多表位疫苗三级结构的预测及分析 A.表位疫苗的三级结构;B.Ramachandran作图验证三级结构;C.细化后的三级结构;D.Ramachandran作图验证细化后的三级结构
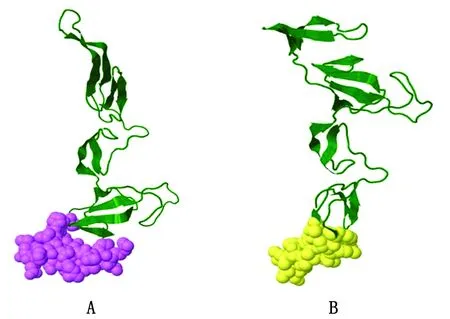
图4 B细胞表位作图 A.紫色表示评分最高的线性表位;B.黄色表示评分最高的不连续表位
2.10 用于疫苗稳定性二硫化物设计为了稳定最终疫苗构建体的模型结构,使用DbD2进行二硫化物工程,发现共17对残基可用于二硫化物工程。但对能量和Chi3值进行评估后(能量值小于2.2,Chi3在-87到+97度之间),最终确定3对残留物:15CPI-54CIT、15CPI-54CIT和15CPI-54CIT,可以进行半胱氨酸残基突变,红色表示可以进行二硫化物的二硫键(图5)。
2.11 疫苗构建体与免疫受体的分子对接使用ClusPro 2.0进行多表位疫苗蛋白和TLR-3受体分子对接,产生共10个模型,其中2号模型的最低能量分数为-1 097.5,在预测的所有模型中最低能量分数最少,为最佳对接复合体,具有最高的结合亲和力(图6)。
2.12 密码子优化和silico克隆JCAT服务器根据大肠杆菌 K12菌株调整密码子,发现改良序列的GC含量为52.69%,密码子适应性指数(CAI)为0.95,没有EcoRⅠ和HandⅢ限制性酶切位点,优化后的密码子为465个碱基对。将优化序列连同EcoRⅠ和HandⅢ限制性位点插入pET28a(+)载体中(图7A),得到5 815碱基对克隆,所需区域在pET28a(+)载体序列之间以红色显示(图7B)。
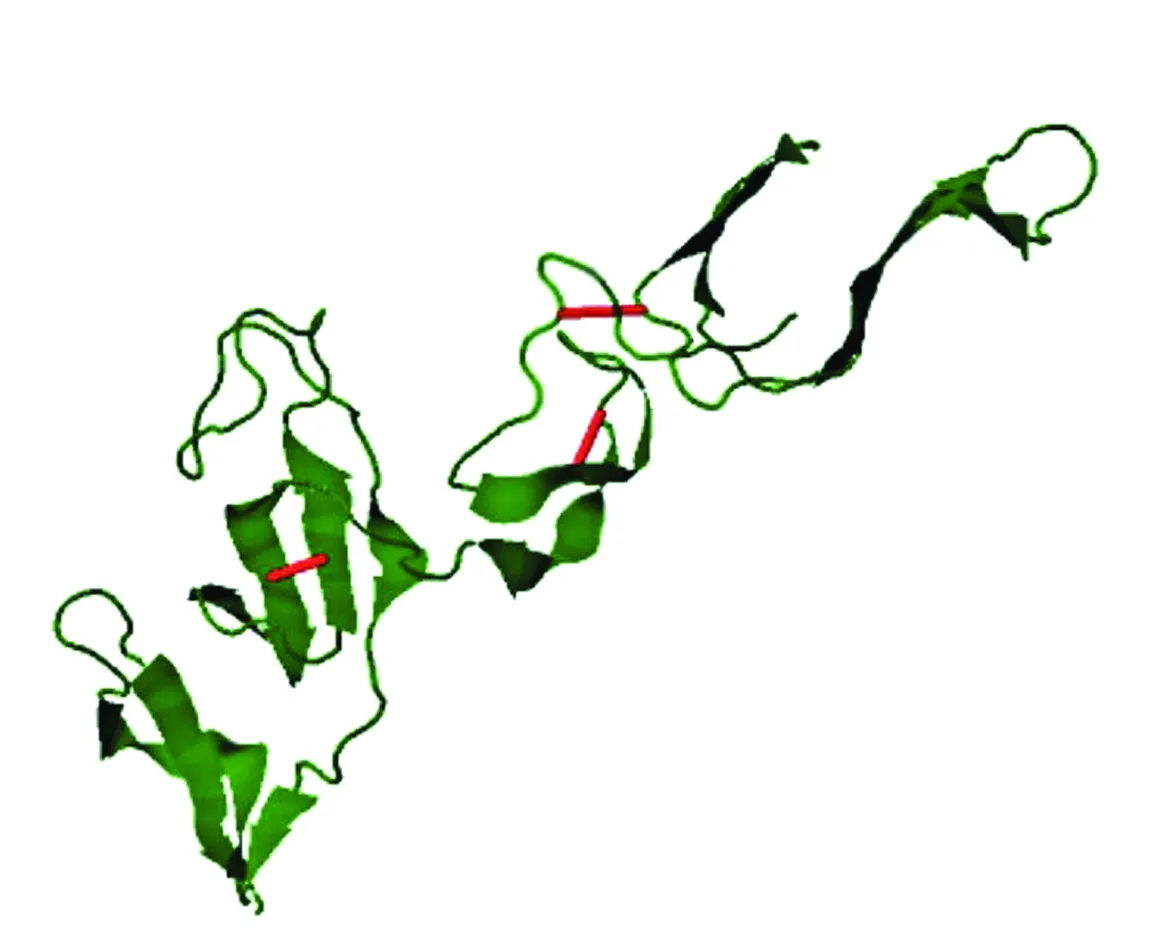

图7 多表位疫苗的限制性克隆和线性连接 A.优化疫苗序列克隆到pET28a(+)载体(红色.筛选序列并克隆至酶切位点EcoRⅠ(192)和HandⅢ(173)之间;黑线.载体);B.silico克隆
3 讨论
在生物信息学快速发展的今天,设计多表位亚单位疫苗已经成为一种新的方法来引发体液和细胞免疫,增强宿主保护性免疫应答[15-16]。而且设计开发的多表位嵌合抗原用于候选疫苗和诊断剂,不仅成本较低,且刺激强烈的免疫应答[17-18]。本研究使用生物信息学方法从E2蛋白中筛选出高免疫原性片段,通过柔性肽连接成多表位疫苗,运用免疫信息学的方法进行进一步验证。
目前已有多种B细胞表位预测方法[19],本研究使用4种预测软件(Immunomedicine Group、ABCpred、BepiPred、SMVTriP)进行B细胞表位预测,发现预测结果不同,但包含重叠肽,最终从重叠肽中筛选出8个B细胞优势表位。以往研究表明,使用NetBoLApan对牛的MHC-Ⅰ分子T细胞表位进行预测具有非常高的准确性[20],本研究选用等位基因BoLA-1*02301、BoLA-3*00201和BoLA-4*02401预测CD8+T细胞表位,然而在预测CD4+T细胞表位的过程中,由于现有的预测方法不包括MHCⅡ类(BoLA-DRB3)等位基因[21],本试验选用等位基因HLA-DRB1*0301、HLA-DRB1*0401和HLA-DRB1*0801预测,从CD8+T和CD4+T细胞表位中筛选出2个重叠肽作为T细胞优势表位。多表位蛋白的设计中,需要用链接肽将不同功能的蛋白进行连接融合[22],本研究选用柔性肽 GS将优势表位连接构建成多表位疫苗。
过敏是免疫系统对先前遇到的通常无害的物质的过度反应,其导致打喷嚏、喘息、皮疹和黏膜肿胀[23]。因此,预测的疫苗构建体必须没有过敏性质[24]。抗原性决定了抗原与B细胞和T细胞受体结合能力,导致免疫应答和记忆细胞形成,VaxiJen服务器可以预测疫苗构建体的抗原性确保其与免疫受体相互作用[25]。结果表明构建的多表位疫苗是非过敏性的良好抗原,可供人们安全使用。
疫苗接种的主要目的是在将疫苗注射到体内后诱导免疫应答,本研究使用ProtParam服务器确定疫苗的物理化学参数[26]。结果表明,E2多表位疫苗相对分子质量约为17 000,理论等电点为8.66,脂肪指数为69.10,亲水性平均值为-0.211,在大肠杆菌体内半衰期大于10 h。糖基化在蛋白的稳定性中起着重要的作用[27],NetNGlyc结果表明多表位疫苗具有一个潜在的N-糖基化位点。这些参数帮助在今后的研究中分离、纯化和提取蛋白质。
蛋白质的主要生物学功能取决于它们的空间结构,理解蛋白质的结构并实现结构和功能之间的联系是非常重要的[28],PSIPRED服务器[29]结果表明,α螺旋占约3.2%,β折叠占约43.2%,无规卷曲占约53.6%,α螺旋和β折叠维持了结构的稳定,而高比例的无规卷曲表明了多表位疫苗具有很强的抗原潜力。疫苗构建体的三维结构由RaptorX服务器建模,之后用GalaxyWEB模型进行了细化。最初,88.2% 的残留物位于favored区域,而在精制后,favored区域的残留数量达到93.5%。B细胞是体液免疫的关键参与者,B细胞表位产生的相应抗体在疫苗设计中起重要作用[30]。本研究从疫苗构建体的3D模型预测了B细胞表位,高概率分数证实了设计的亚单位疫苗具有良好免疫原性。
接下来的一个重要目标是增强模型疫苗的稳定性,二硫化物工程是一种用于在目标蛋白质结构中产生二硫键的新方法[31]。本研究通过DbD2筛选出三对残留物(15CPI-54CIT、15CPI-54CIT和15CPI-54CIT)可以进行二硫化物工程。分子对接是检查配体和受体分子之间结合亲和力的计算方法,本研究使用ClusPro[32]评估多表位疫苗与TLR-3免疫受体结合能力,结果显示构建的多表位疫苗具有很高的结合亲和力。最后将多表位疫苗进行密码子优化,使用SnapGene克隆到大肠杆菌载体,确保疫苗构建体在表达载体内能够准确翻译并且表达效率。本研究应用一系列免疫信息学工具,以找到可以对抗BVDV的有效疫苗。仍需试验验证来证明设计合成的亚单位疫苗免疫原性和安全性。

