敲低DCLK1抑制神经胶质瘤细胞增殖、迁移与侵袭
余杰,杨锋,邓健,胡林旺
0 引言
神经胶质瘤是常见的以快速转移和侵袭性浸润为特征的颅内恶性肿瘤。根据2016年提出的《世界卫生组织中枢神经系统肿瘤分类》,胶质母细胞瘤(GBM)是最常见的恶性神经胶质瘤类型,即使经过系统治疗,GBM患者的平均生存时间也只有15个月[1-2]。证据表明,神经胶质瘤的恶性程度可能归因于影响肿瘤进展中的各种癌基因表达和细胞间的分子转导途径[3]。探索胶质瘤侵袭性发展的分子机制可能为其治疗提供新的治疗靶点。
双皮质素样激酶1(doublecortin-like kinase 1,DCLK1)是一种微管相关激酶,在多种肿瘤中均过表达[4-6]。有研究表明,DCLK1的高表达能促进肝癌、结直肠癌和胰腺癌等恶性肿瘤细胞的生长、上皮间质转化和转移[5-7],但DCLK1对神经胶质瘤细胞增殖活性、迁移和侵袭能力的作用尚不清楚。因此,本实验探讨下调DCLK1对胶质瘤细胞增殖、迁移和侵袭的影响,并对其机制进行了初步研究。
1 材料与方法
1.1 材料
1.1.1 试剂 胎牛血清(FBS)、Dulbecco改良版Eagle培养基(DMEM )购自美国Life Technologies公司;LipofectamineTM2000和Trizol试剂购自美国Invitrogen公司;DCLK1抗体购自英国Abcam公司;MTT细胞增殖试剂盒和免疫组织化学试剂盒购自广州赖德生物技术有限公司;RIPA缓冲液、BCA蛋白定量试剂盒和β-actin抗体购自上海碧云天生物科技有限公司;TGF-β1、p-Smad2、p-Smad7、Smad2和Smad7抗体购自美国Cell Signaling Technologies公司;PrimeScript RT和SYBR Green PCR Master Mix试剂盒购自日本Takara公司。
1.1.2 组织样本收集 本研究共纳入25例经病理检查确诊为成人胶质母细胞瘤患者(WHO Ⅱ~Ⅲ级),胶质母细胞瘤组织和相应的癌旁组织均在接受肿瘤切除术中获取。组织分为两部分,一部分组织用于制作石蜡包埋,另外一部分组织保存在-80℃冰箱。在组织收集之前,患者均未接受过放化疗。本研究获得湖南省人民医院伦理委员会的批准,且所有纳入研究的受试者均签署了知情同意书。
1.2 方法
1.2.1 免疫组织化学染色 取胶质瘤和相应癌旁组织的石蜡组织,制作5 μm的石蜡切片。切片经脱蜡和水化后,根据免疫组织化学试剂盒说明书步骤,通过链霉亲和素-过氧化物酶(SP)的免疫组织化学染色评估DCLK1表达。孵育DCLK1抗体稀释度为1:200。DAB显色,光学显微镜随机拍摄5个视野。根据以下标准对染色结果评分:0:<5%;1:5%~25%;2:25%~50%;3:50%~75%;4:≥75%。得分<1为阴性染色,≥1为阳性染色。
1.2.2 细胞培养和转染 人神经胶质瘤细胞U87、A172和正常神经胶质细胞HEB购自上海生物科学研究所细胞库。将细胞接种在含有10%FBS的DMEM中,并置于37℃、5%CO2培养箱中进行培养。每2~3天更换一次细胞培养基。sh-DCLK1和相应阴性对照(sh-Con)序列由中国吉凯基因公司合成。将获得的序列克隆到pLV-shRNA质粒中,使用LipofectamineTM2000转染至U87和A172细胞48 h 后,Western blot检测DCLK1的相对表达以评估转染效果。
1.2.3 MTT检测 将已转染sh-DCLK1或sh-Con的U87和A172细胞接种到96孔板中。37℃、5%CO2下分别孵育0、24、48和72 h,每孔分别添加20 μl MTT试剂(5 mg/ml),并室温孵育4 h,然后加入150 μl DMSO溶解结晶,通过酶标仪(TECAN,奥地利)读取各孔450 nm处的吸光度值。
1.2.4 细胞迁移和侵袭实验 取已转染sh-DCLK1或sh-Con的U87和A172细胞,用无血清培养基调整细胞浓度至5×105个/毫升,并取100 μl细胞悬液加入Transwell板上室上表面中(其中Transwell室包被基质胶用于侵袭测定,无包被基质胶用于迁移测定);取600 μl含10%FBS的培养基加至下室。将细胞在37℃、5%CO2培养箱中孵育24 h后,然后将转移至Transwell上腔室的下表面的细胞用甲醇固定并结晶紫染色。在光学显微镜下,对6个随机视野中染色的细胞计数。
1.2.5 Western blot实验 RIPA缓冲液从组织或细胞中提取蛋白质样品,并用BCA蛋白定量试剂盒对提取的蛋白样品定量。取等量的蛋白质在10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳中分离,并将分离的蛋白转移至PVDF膜。室温下,用5%牛血清白蛋白(BSA)封闭膜2 h,加入一抗(DCLK1、TGF-β1、p-Smad2、p-Smad7、Smad2和Smad7;均1:1 000稀释)后孵育1.5 h;TBST洗膜后,室温孵育二抗(1:2 000)1 h。用ECL化学发光法曝光目的蛋白条带。β-actin作内部对照,Image J软件测定目的蛋白相对灰度值。
1.2.6 RT-qPCR实验 TRIzol试剂提取组织和细胞标本的总RNA。使用NanoDrop 1000分光光度计(Thermo Scientific,美国)检测RNA样品的浓度。使用PrimeScript RT试剂盒通过反转录反应合成cDNA。cDNA和引物通过SYBR Green PCR Master Mix试剂盒在7900 Real-time PCR System(Applied Biosystems,美国)中进行RT-qPCR反应。引物序列:DCLK1 F:5'-AGGCAGGTTACCATCACTGG-3',R:5'-CATTGTTCTAGCTGCTCCCC-3'。GAPDH被用作内部对照,其引物序列如下:GAPDH F:5'-TGCACCACCAACTGCTTAGC-3',R:5'-GGCATGGACTGTGGTCATGAG-3'。使用2-ΔΔCt方法计算DCLK1 mRNA的相对表达水平。
1.2.7 裸鼠肿瘤形成 8只6周龄SPF级雄性BALB/c裸小鼠(18~20 g)来源于长沙市天勤生物技术有限公司[SCXK(湘)2019-0014],饲养于湖南省人民医院SPF级动物房[SYXK(湘)2015-0013]。适应性饲养3天后,将已转染sh-DCLK1或sh-Con的U87细胞(100 μl,1×107个/毫升)注射至颈部皮下,待可见瘤体(约100 mm3;游标卡尺测量,按照公式V=0.5×长×宽2计算)时,计为第0天,此后,每周测量一次瘤体体积,待第4周(28天)测量瘤体体积后麻醉并处死小鼠,收集瘤体并称重。
1.3 统计学方法
采用GraphPad Prism 6软件进行统计分析。数据用均数±标准差()表示,两组之间比较采用t检验,多组之间比较采用单因素方差分析;P<0.05为差异有统计学意义。
2 结果
2.1 DCLK1在胶质瘤细胞系U87和A172及胶质瘤组织中的表达情况
RT-qPCR结果显示,胶质瘤组织中DCLK1 mRNA表达明显高于癌旁组织(P=0.000),见图1A,胶质瘤细胞系U87和A172中DCLK1 mRNA均显著高于正常神经胶质细胞HEB(P=0.000),见图1B;免疫组织化学结果显示,胶质瘤组织中DCLK1呈弥漫阳性,见图1C;Western blot结果表明,与癌旁组织相比,胶质瘤组织中DCLK1蛋白表达明显增加(P=0.000),见图1D。
2.2 敲低DCLK1表达抑制神经胶质瘤细胞增殖
Western blot结果表明sh-DCLK1转染的神经胶质瘤细胞U87和A172中DCLK1蛋白表达均下调(P=0.000),见图2A。MTT法检测了sh-DCLK1转染对神经胶质瘤细胞增殖的影响,结果表明,敲低DCLK1表达可明显抑制神经胶质瘤细胞的增殖(P=0.000),见图2B。
2.3 敲低DCLK1表达抑制神经胶质瘤细胞迁移和侵袭
Transwell结果显示,与sh-Con组相比,敲除DCLK1的胶质瘤U87和A172细胞迁移能力(P=0.003;P=0.006)和侵袭能力(P=0.005;P=0.002)均显著降低,见图3。
2.4 敲低DCLK1表达抑制U87细胞中TGF-β/Smads信号活性
Western blot结果表明,与sh-Con组相比,DCLK1敲除后的U87和A172细胞中TGF-β1蛋白表达、p-Smad2/Smad2和p-Smad7/Smad7比值均显著降低(P=0.000),见图4。
2.5 敲低DCLK1表达可抑制U87细胞在小鼠体内的生长
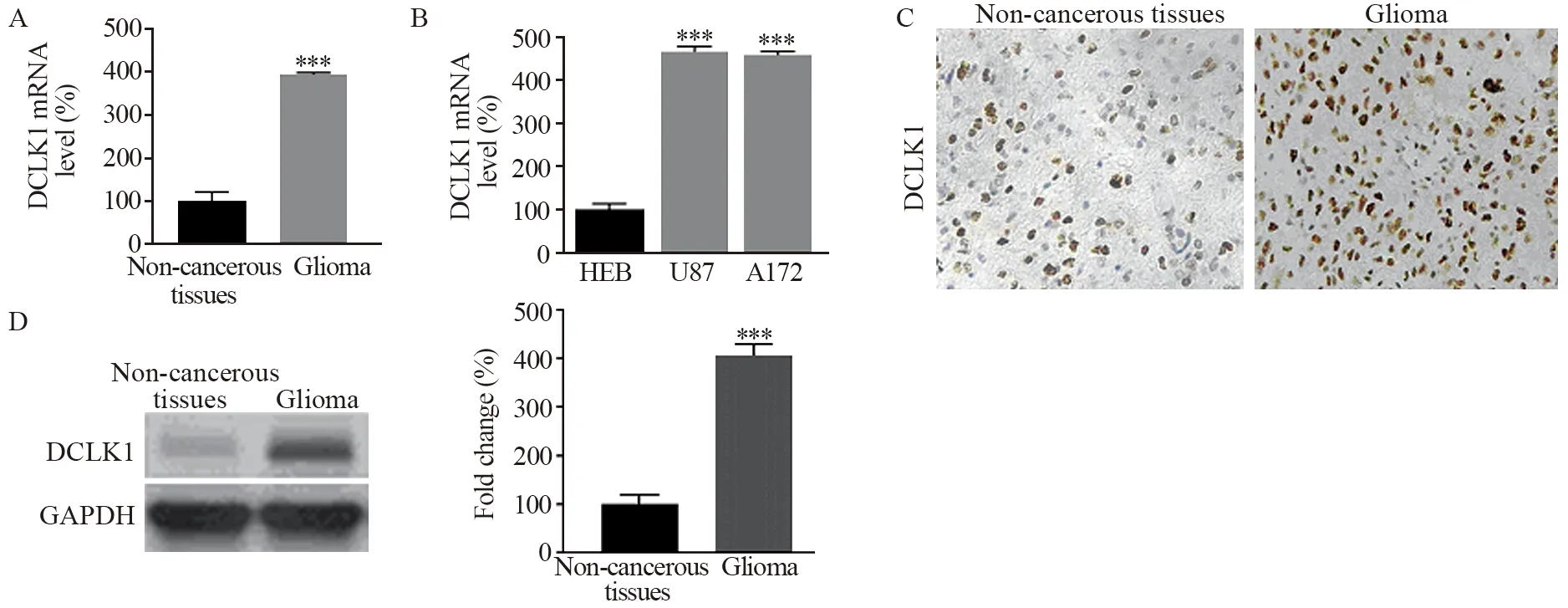
图1 DCLK1在胶质瘤癌组织(A,C和D)和胶质瘤细胞系(B)中表达升高Figure 1 DCLK1 expression were upregulated in glioma tissues(A,C and D) and cell lines(B)

图2 敲低DCLK1表达(A)抑制神经胶质瘤细胞增殖(B)Figure 2 Knockdown of DCLK1 expression(A) inhibited proliferation(B) of glioma cells
体积测量结果显示,与sh-Con组相比,sh-DCLK1组瘤体体积明显变小(P=0.000),见图5A;在第28天收集瘤体并称重,结果显示,sh-DCLK1组瘤体质量明显小于sh-Con组(P=0.000),见图5B、5C。
3 讨论
胶质瘤约占原发性脑癌的80%[8]。大多数成人神经胶质瘤确诊时已是中晚期,预后差[9]。探索胶质瘤肿瘤进展的分子机制,有助于为神经胶质瘤的诊断和治疗新策略的制定提供可行的靶点。
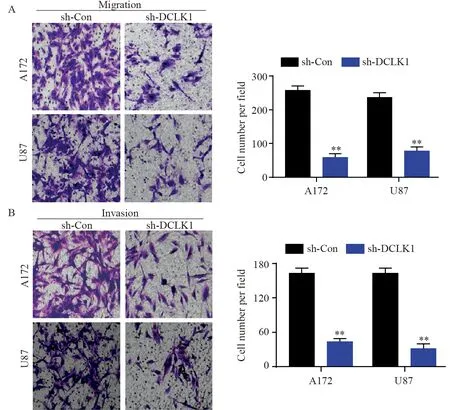
图3 敲低DCLK1表达抑制神经胶质瘤细胞迁移(A)和侵袭(B) (×200)Figure 3 Knockdown of DCLK1 inhibited migration(A) a n d invasion(B) of glioma cells (×200)
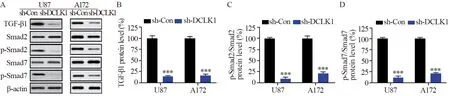
图4 敲低DCLK1表达抑制U87和A172细胞中TGF-β/Smads信号活性Figure 4 Knockdown of DCLK1 expression inhibited TGF-β/Smads signaling activity in U87 and A172 cells

图5 敲低DCLK1表达可抑制神经胶质瘤在小鼠体内的生长Figure 5 Knockdown of DCLK1 expression could inhibit glioma growth in mice
DCLK1属于神经元微管相关双皮质素家族成员,既往研究[10]认为DCLK1在皮质神经元的径向迁移和轴突生长等神经发育的多个阶段发挥重要作用。因DCLK1具有调节微管相关蛋白(microtubule associated proteins,MAPs)表达和驱动微管聚合的功能,而MAPs表达失调和微管聚合与癌症的发生和进展密切相关[11],故推测DCLK1可能在肿瘤的发生与进展中发挥重要的调节作用。近来研究[4-7,12]也证实了DCLK1与多种恶性肿瘤转移和不良预后有关,过表达DCLK1可促进这些肿瘤细胞增殖和转移;抑制DCLK1表达可降低肿瘤细胞侵袭性及转移能力。本研究发现,DCLK1在胶质瘤组织和细胞中高表达,sh-DCLK1转染沉默胶质瘤细胞中DCLK1的表达能抑制胶质瘤细胞增殖、迁移与侵袭;此外,通过移植瘤模型证实了敲低DCLK1能在体内抑制胶质瘤细胞的生长。结果提示,靶向抑制胶质瘤细胞DCLK1的表达可能是潜在的抗胶质瘤的有效策略。
TGF-β/Smads信号异常激活可促进包含胶质瘤在内等多种肿瘤细胞增殖和EMT[13-14]。EMT是肿瘤细胞发生侵袭和转移的关键步骤之一,且其能赋予肿瘤细胞自我更新和远端转移的能力。有研究[15]显示,柠檬酸杆菌可通过诱导TGF-β/Smads介导的EMT途径促进DCLK1结肠隐窝细胞转移至基质并导致结肠肿瘤结节的发生。本研究结果显示,敲低DCLK1能抑制U87和A172细胞中TGF-β/Smads信号通路的关键信号因子TGF-β1、p-Smad2和p-Smad7的表达,提示敲低DCLK1可导致胶质瘤细胞中TGF-β/Smads信号活性降低。有研究[16-17]表明抑制TGF-β/Smads信号活性能抑制神经胶质瘤细胞增殖、EMT、迁移与侵袭。因此,该结果提示,敲低DCLK1对胶质瘤细胞增殖迁移与侵袭的抑制作用可能与其抑制TGF-β/Smads信号相关。
目前本研究有一定的局限性,如患者样本量相对较小、未进一步探讨DCLK1直接作用靶点、未研究DCLK1与其他基因之间的相互作用及可能在癌症发展中发挥潜在作用的相对信号通路。胶质瘤的进展由各种促癌基因、抑癌基因、非编码RNA及各种信号途径组成的复杂的网络调节的过程。为解释DCLK1对神经胶质瘤的发生和进展的影响,需要进一步探索DCLK1参与的众多神经胶质瘤的调控网络。
综上所述,DCLK1在神经胶质瘤中表达上调,而下调DCLK1表达可抑制神经胶质瘤细胞增殖、迁移和侵袭,以及小鼠移植瘤的生长,其机制可能是通过TGF-β/Smads信号通路参与神经胶质瘤的发展。

