急性非早幼粒细胞白血病患者早期颅内出血预警评分系统的建立及应用
章俏雷 ,叶琇锦,方炳木,江锦红,刘永华,王晓丽,江妤,金伟媚,曾玉晓
0 引言
颅内出血(intracranial hemorrhage,ICH)作为一种急性脑血管疾病,是常见致死病因之一[1]。最近研究表明,ICH的风险在癌症患者中较高,说明癌症本身可以直接或间接导致脑出血的发展,通常是由于癌症相关的凝血功能障碍[2]。在成人恶性血液疾病中,感染是最常见的并发症,ICH是第二常见并发症,死亡率高[3-8]。有研究显示,急性白血病(acute leukemia,AL)患者的ICH发生率高于其他血液恶性肿瘤患者,急性髓细胞性白血病(acute myeloid leukemia,AML)患者有出血倾向者显著多于急性淋巴细胞性白血病(acute lymphoblastic leukemia,ALL)患者[6]。本研究通过对1 281例急性非早幼粒细胞白血病(acute nonpromyelocytic leukemia,ANPL)患者资料进行回顾性分析,筛选出早期ICH的独立危险因素,本着简单方便的目的,建立适合ANPL早期ICH预警评分系统。
1 资料与方法
1.1 临床资料
选取2010年1月—2016年4月在浙江大学医学院第一附属医院及丽水市人民医院血液科诊断为ANPL的住院患者共1 281例(模型组),其中确诊90例ICH患者为ICH组,随机抽取同期139例无颅内出血(NICH)的ANPL患者为NICH组。选取2016年5月—2018年8月院内ANPL患者378例(验证组)。纳入标准:诊断均符合WHO(2008年)MICM分型诊断标准;依据临床和神经影像学(计算机断层扫描或磁共振成像)来确认ICH的诊断,在ANPL确诊后30天内发生ICH定义为ICH组,未发生ICH定义为NICH组。排除标准:疑似ICH但未经证实的患者。通过询问或病史采集获得患者性别、年龄、吸烟、既往史(高血压、糖尿病)及家族史。
1.2 治疗方案
对于AML患者,诱导方案包括:年龄<60岁采用IA方案(去甲氧基柔红霉素+阿糖胞苷)或HA方案(高三尖杉酯碱+阿糖胞苷);年龄≥60岁采用CAG方案(G-csf+阿糖胞苷+阿克拉霉素);获得CR患者继续原方案巩固治疗1疗程,而后行大剂量或中剂量阿糖胞苷巩固治疗3~4疗程,年龄≥60岁亦行DA(柔红霉素+阿糖胞苷)或MA(米托蒽醌+阿糖胞苷)等方案巩固治疗。诊断为ALL的患者接受了癌症和白血病组B8811(CALGB8811)[9]或成人ALL研究组2003(GRAALL 2003)化疗方案[10]。
1.3 实验室检查
每周两次血常规、凝血功能、血生化常规检查。酌情输注成份血。
1.4 疗效评价
所有病例根据FAB标准确诊,两个足量联合化疗疗程后评价是否缓解;患者诊断之日起30天内任何原因引起的颅内出血事件定义为早期颅内出血。随访时间为2010年1月—2019年7月31日。每3月随访一次,复查头颅CT。可疑发生ICH患者,随时复查头颅CT。
1.5 模型判别能力评估
分析比较患者诊断时的疾病特征(性别、年龄、WBC、HGB、PLT、FIB、PT、APTT、ALB、Cr、LDH、骨髓原始细胞水平)与早期ICH的关系,用ROC曲线确定最佳临界点。利用ROC曲线下面积(AUC)评估模型判别ICH与NICH两组数据的能力,AUC为0.5~0.7表示模型判别能力低,0.7~0.9表示判别能力中等,0.9~1.0表示判别能力高。
1.6 统计学方法
采用SPSS16.0软件进行统计学分析。计量资料符合正态分布时采用()表示,不符合正态分布时采用M(P25,P75)表示。单因素分析P<0.05的因素纳入Logistic模型进行多因素分析,并建立新的预警评分系统。P<0.05为差异有统计学意义。
2 结果
2.1 ICH与NICH组患者一般临床特征
ICH组患者90例,其中AML 77例(85.6%),ALL 13例(14.4%),M2和M5的ICH的相对发生率最高(61.1%);NICH组患者139例,其中AML 119例(85.6%),ALL 20例(14.4%);除M1外,其他亚型的ICH发病率差异无统计学意义。与NICH组相比,ICH组患者具有初诊时WBC高、HGB高、PLT低、ALB低、FIB低、PT延长、APTT延长的临床特点(均P<0.05),而年龄、性别、骨髓原始细胞水平、肌酐(Cr)水平、乳酸脱氢酶(LDH)水平等指标及既往高血压病史、糖尿病史、高脂血症史、烟酒史、饮酒史两组差异均无统计学意义(均P>0.05),见表1。
2.2 模型组中ICH患者的相关危险因素
结果显示:WBC≥30.00×109/L、FIB<2.92 g/L、PT≥12.91 s的患者早期ICH率明显高于WBC<30.00×109/L、FIB≥2.92 g/L、PT<12.91 s患者(P=0.001、0.029、0.000)。将单因素分析中P<0.05的因素纳入Logistic回归模型进行多因素分析,结果显示:初诊WBC≥30.00×109/L、FIB<2.92 g/L、PT≥12.91 s为ANPL患者早期ICH独立危险因素(P=0.045、0.049、0.010),见表2。
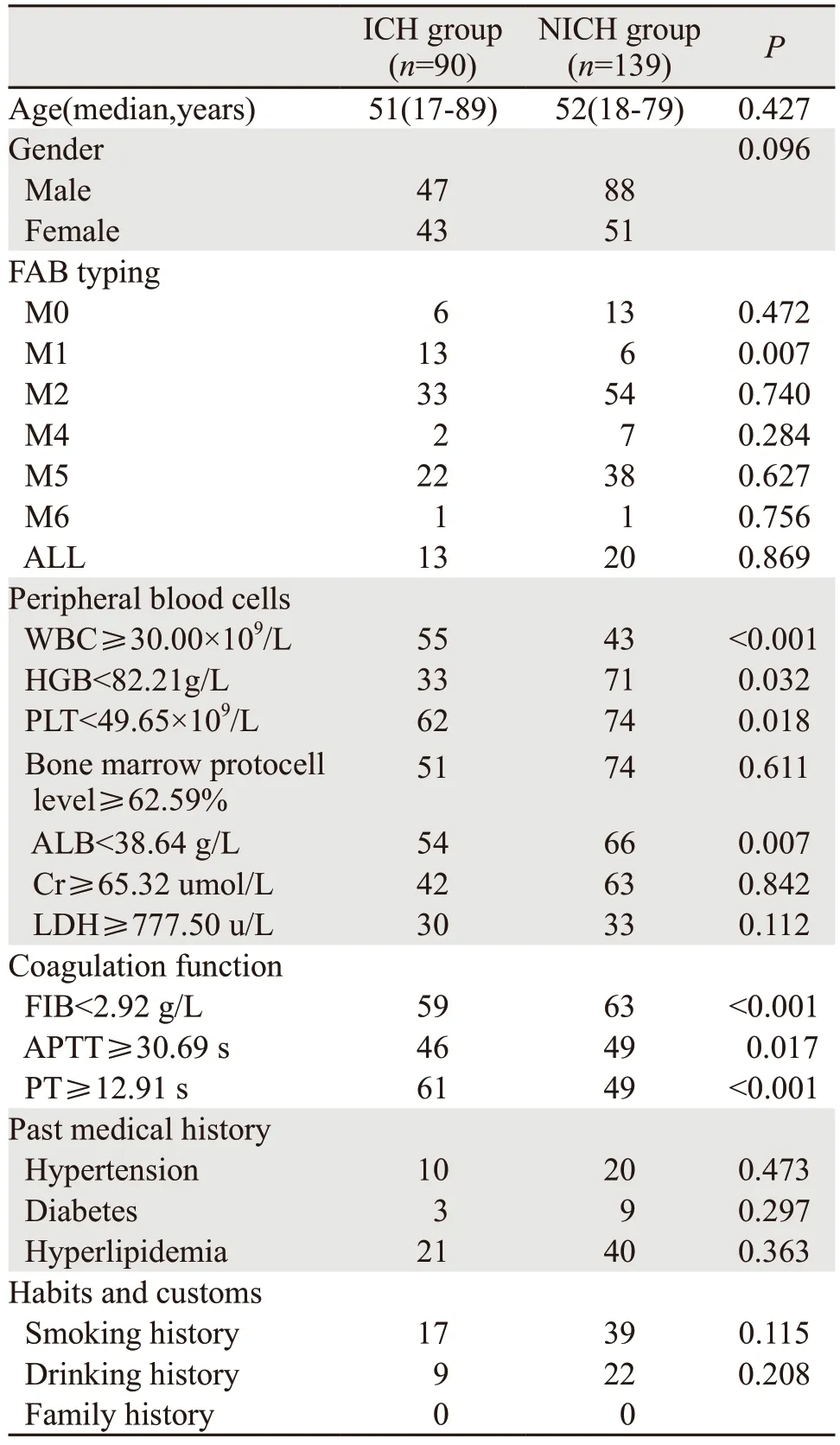
表1 ICH组与NICH组一般临床资料的比较 (n)Table 1 Comparison of general clinical data between ICH group and NICH group (n)
2.3 预警评分系统建立
本研究根据模型组归纳的相关因素,通过OR值进行赋值,得出各因素对应的风险分值,初诊WBC≥30.00×109/L、FIB<2.92 g/L、PT≥12.91 s分值分别为2、1、3分,见表3。将此评分系统应用于验证组,计算验证组中每例患者的风险评分。根据近似三分法,最终确定≤1分为低风险,2~4分为中风险,5~6分为高风险。验证组,得分最高者最终ICH的风险最高(52.0%),各组ICH发生率的差异有统计学意义(P<0.05),见表4。
2.4 预警评分系统验证
为了进一步验证ANPL早期ICH预警评分系统,采用ROC曲线评价评分系统的效能,以患者是否发生ICH为因变量,以模型组和验证组每例患者的风险得分为自变量绘制ROC曲线,得出模型组ROC曲线下面积为0.774(95%CI:0.688~0.859),验证组ROC曲线下面积为0.715(95%CI:0.559~0.872),见图1。两组曲线下面积均介于0.7~0.9,说明该风险评分系统诊断能力较高,能较好地区分ANPL患者早期ICH发病风险的高低。
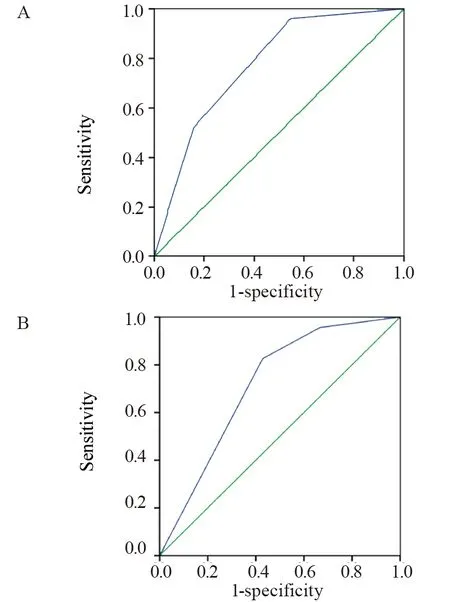
图1 模型组(A)和验证组(B)ROC曲线Figure 1 ROC curves of model group(A) and validation group(B)
3 讨论
有文献报道,急性白血病在诊断后的30天内最容易发生颅内出血[11],因此如何减少急性白血病患者的早期颅内出血是治疗中的重点与难点,目前国内尚无大宗关于ANPL早期颅内出血研究临床数据报道。本研究探讨ANPL患者早期发生颅内出血的临床特征及危险因素,了解对疾病进展和预后有关的不良因素,对于病情的评估、治疗方案的合理拟定、改善患者的预后及提高生存率具有重要意义。
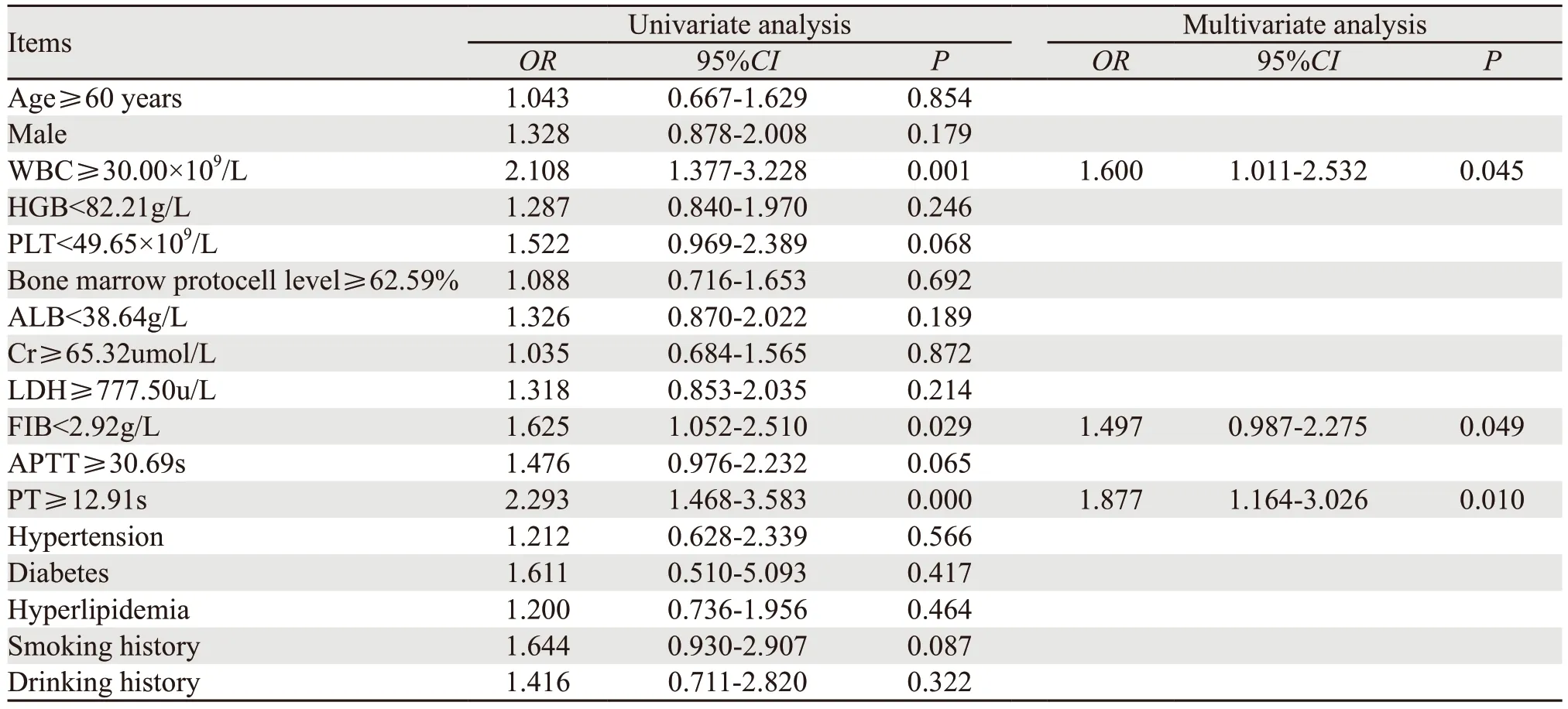
表2 ICH相关危险因素Logistic回归分析Table 2 Logistic regression analysis of ICH-related risk factors

表3 预警评分系统Table 3 Warning scoring system

表4 验证组中不同危险组颅内出血风险Table 4 Risk of intracranial hemorrhage in different risk groups in validation group
目前国内外的文献尚无关于ANPL早期颅内出血预警评分系统的报道,需建立一个被广泛接受且采用的评分系统。本研究多因素分析显示初诊WBC≥30.00×109/L、FIB<2.92 g/L、PT≥12.91 s是影响ANPL患者发生颅内出血的独立危险因素,与相关报道基本一致[2,7,12-13]。以往研究发现低纤维蛋白原水平与颅内出血发生率显著相关[2]。多项研究表明,凝血酶原时间的延长与血液恶性肿瘤患者颅内出血有关[2]。急性白血病患者的凝血功能障碍可能在颅内出血的发病机制中发挥重要作用[14]。另外,白血病细胞可能表达纤维蛋白溶解酶和其他蛋白水解酶,涉及白血病患者的出血机制[7,13-15]。化疗相关的内皮损伤和凝血因子的减少也可能在发病机制中发挥重要作用[3]。白血病往往对神经系统产生间接影响,引起血小板减少、凝血因子缺乏、脓毒症、与治疗相关的并发症和血管壁异常[2-3,8,15],因此可能是造成ANPL患者早期死亡率高,且多以颅内出血为表现的原因之一。本研究将初诊WBC≥30.00×109/L、FIB<2.92 g/L、PT≥12.91 s这三个指标根据其在Cox回归的权重大小进行赋值,建立了临床上较为精确的预测方程。
本研究根据Logistic回归曲线的特点,建立了评价手术难度的相关函数,并通过ROC曲线判断其准确性。验证组ROC曲线下面积为0.715(95%CI:0.559~0.872),评分系统具有一定的准确性,可以用于评估ANPL早期ICH风险。该评分系统符合简单方便的原则,预测能力较好,具有广泛的临床应用前景。
本研究也有局限性:第一,本研究是回顾性队列研究。鉴于血液学领域的快速发展,患者接受了不同的化疗方案。第二,本研究表明,高白细胞、低纤维蛋白原和凝血酶原时间延长是颅内出血独立的危险因素。然而,没有对患者进行尸检来进一步明确死因。所以未来需要进一步收集更多的患者资料进行更详细的分层,以便建立更科学的评分系统为临床服务。

