艰难梭菌感染的实验室诊断技术研究进展 *
袁宝玉,沈芳
(复旦大学附属上海市第五人民医院检验科,上海 200240)
艰难梭菌作为人类肠道正常菌群,是一种专性厌氧革兰阳性芽孢杆菌,由于其较难在实验室中分离和生长而被命名为艰难梭菌。肠道菌群的平衡对于维持人体健康至关重要,而广谱抗菌药物、免疫抑制剂或化疗药物的大量使用会引起菌群失调,导致艰难梭菌感染(Clostridiumdifficileinfection, CDI)及相关性腹泻,严重时可导致伪膜性结肠炎、暴发性结肠炎、中毒性巨结肠甚至死亡[1]。近年来,CDI发病率显著增加,严重威胁公共卫生安全。有数据表明2003年美国出院人群CDI发病率为7.5‰,2012年增加到13.5‰[2],平均每年有453 000人感染、29 000人死亡[3-4],由CDI导致的经济负担为4.36~30亿美元[5]。目前,CDI已成为重要的医院感染之一,及早、正确地根据相关症状及实验室检查结果诊断CDI,不仅有助于临床诊疗和疾病预防,还可降低不必要的医疗费用支出。本文就常用的艰难梭菌实验室诊断方法进行综述,以期为CDI诊断提供方法学参考。
1 目前常规使用的艰难梭菌实验室诊断方法
艰难梭菌的实验室诊断技术一般分为3类:微生物培养、免疫学检测(艰难梭菌毒素、谷氨酸脱氢酶)和分子生物学检测。
1.1微生物培养
1.1.1艰难梭菌的厌氧培养 艰难梭菌是专性厌氧菌,对培养条件要求严格,在常规厌氧培养条件下不易生长,在环丝氨酸-头孢西丁-果糖琼脂(cycloserin-cefoxitin-fructose agar, CCFA)培养基中厌氧培养24~48 h时,可形成白色或淡黄色、边缘不整齐以及典型马粪气味的菌落,在紫外线照射下可见黄绿色荧光,因此使用CCFA进行培养后,可根据菌落形态、荧光特点、气味和革兰染色结果进行鉴定[6]。Kochan等[7]对传统的CCFA培养方法进行一些改进,如在CCFA培养基中加入牛磺胆酸钠或溶菌酶,可以进一步富集芽孢,提高敏感性。此外,显色培养基也被用于艰难梭菌的培养及鉴定,如法国BioMérieux公司先后开发的IDCd培养基、CLO培养基和CDIF培养基[8],艰难梭菌在此类培养基上可形成特征性黑色菌落,更易辨别[9]。
艰难梭菌分离培养作为一种传统方法,不仅敏感性高,而且可获取相应菌株用于分子分型和耐药分析,能更全面地了解其流行病学特征,为临床治疗提供依据。但其缺点也不可忽视,分离培养耗时较长,不能明确区分产毒株和非产毒株[5],因此不能为临床快速诊断提供依据,导致很难在临床实验室广泛开展。
1.1.2细胞毒性试验(cell cytotoxicity assay,CCTA) 艰难梭菌可分泌致病性毒素,CCTA是检测毒素的重要方法。可取患者新鲜粪便标本进行稀释,经离心、过滤后,将滤液滴加到微量滴定板上单层细胞中,培养24~48 h后观察是否出现细胞病变效应(cytopathic effect, CPE),然后通过特异性抗血清中和试验确定CPE的特异性,鉴定CPE是否由艰难梭菌相关毒素引起[10]。CCTA敏感性、特异性高,是检测粪便毒素的金标准[11],但结果易受多种因素影响,如细胞系种类、粪便滤液标本制备质量和工作人员经验等[12],此外,CCTA操作具有一定复杂性,且需要无菌环境和细胞培养设备,目前未在临床实验室中常规开展[13]。
1.1.3毒力生成培养试验(toxigenic culture, TC) TC试验包括艰难梭菌培养和毒素检测两部分,只有培养结果阳性才进行毒素检测,主要有细胞毒性检测、免疫学检测毒素以及分子生物学检测毒素基因等[12]。TC虽然是一种兼具高敏感性和高特异性的检测技术,但由于仅检测艰难梭菌的体外产毒能力,故不能用于反映菌株在高度可变的体内产生毒素情况,不能区分产毒性菌株在体内是否引起真正感染[13]。和CCTA类似,TC也会耗费大量时间,引起治疗延迟,使患者症状加重,甚至死亡。因此,TC主要用于流行病学研究及新方法评估,一般不用于临床[10]。
1.2免疫学检测
1.2.1毒素的免疫学检测 毒素A和毒素B是艰难梭菌发病机制中的关键毒力因子,被视为诊断CDI的重要指标。在美国,90%以上的实验室均采用免疫学检测方法[13-14],包括酶免疫方法(enzyme immunoassays, EIAs)、荧光酶免疫测定(enzyme linked fluorescence assay, ELFA)等。
EIAs是以酶标记抗体作标志物检测样本中毒素A、B的分析技术。目前市面上有多种基于EIAs的商品化试剂盒[6,15],其性能因厂家而异,其中比较常见的是采用ELISA双抗体夹心法。尽管EIAs的敏感性受到标本储存方式、运输途径等多种因素影响,但快速、简单、价廉、设备技术要求不高等特点使其在临床应用中具有独特优势[16]。目前普遍认为EIAs是临床应用频率较高的检测方法。
VIDAS CDAB检测系统由法国BioMérieux公司研发,采用ELFA方法检测毒素A、B[17-18]。VIDAS CDAB检测系统技术成熟,性能稳定,是一种定量检测方法,15 min~2 h可报告结果,与传统培养法相比,具有快速便捷、工作量少等优点,但该检测方法需要特殊仪器[19]。
1.2.2谷氨酸脱氢酶(glutamate dehydrogenase, GDH)的免疫学检测 GDH是艰难梭菌表面大量表达的一种抗原性蛋白质,数量多,稳定性强,敏感性高,在各型艰难梭菌中具有高度保守性,因此GDH也为艰难梭菌检测提供了一个方向。目前可采用胶体金免疫层析法、ELFA、EIAs等对GDH进行检测。
德国Nadal公司研发的即用型检测卡,即采用胶体金免疫层析法[20],将稀释后的样本悬浮液在检测卡上扩散,GDH与胶体金标记抗体反应,当移动至固定在硝酸纤维素膜上的抗体区域时,发生特异性结合而被截留,聚集,显色,实现对GDH的目视化检测。此外,还有采用ELFA的VidasC.difficileGDH Assay(法国BioMérieux公司)以及采用EIAs的Quik Chek-60(美国Techlab公司)[6,21]。
GDH检测的优越性不仅在于其廉价的成本、简单快速的操作流程,还在于其高敏感性和较高的阴性预测值,然而,GDH并不是产毒性艰难梭菌所特有,非产毒性菌株以及梭菌属其他细菌也可产生此酶,检测特异性有待进一步提高,故不能单独作为诊断方法,目前常用作筛查试验[22]。
毒素和GDH检测各有优缺点,毒素检测敏感性偏低,阳性预测值也不足以用于临床诊断,而GDH检测特异性偏低。在此基础上研发出可同时检测GDH和毒素A、B的试剂盒,例如C.difficileQuik Chek Complete(美国Techlab公司)、CERTESTClostridiumdifficileGDH+toxinA+B(法国Theradiag公司)、C.difficileGDH-toxins A-B(德国Orgentec公司)[15,23],具有高敏感性和高准确性,可弥补单一方法的不足,且检测周期短,无需其他检测设备,可作为门、急诊CDI的初筛试剂盒[19]。
1.3分子生物学检测
1.3.1核酸扩增试验(nucleic acid amplification tests, NAATs) 艰难梭菌致病性决定区(PaLoc)内含有编码毒素A和B的tcdA、tcdB基因,以及tcdR、tcdC及tcdE3种辅助基因。在致病性决定区外的二元毒素决定区(CdtLoc)内则含有编码二元毒素的cdtA和cdtB基因[6]。NAATs多是检测毒素A、B及二元毒素的编码基因。NAATs包括PCR、环介导等温扩增技术(loop-mediated isothermal amplification, LAMP)、依赖解螺旋酶恒温扩增技术(helicase-dependent amplification, HDA)等,这些方法均是针对艰难梭菌的毒素基因进行检测。
NAATs方法众多,有采用PCR技术的BD GeneOhm、BD Max、ProDesse ProGastro Cd Assay、Cepheid GeneXpert C.difficile Assay等,采用LAMP技术的Meridian Illumigene等,以及采用HDA技术的Quidel AmpliVue C.difficile、Great Basin Portrait Analyzer等[6]。
这些技术一般先通过高温或解旋酶将模板DNA变为单链,再将引物与模板杂交,然后在聚合酶催化下延伸合成,反复循环,实现目的DNA的扩增。这几种NAATs检测方法虽然基本原理和操作过程等有所不同,但与免疫学检测毒素和GDH相比,其敏感性、特异性更高,且可以快速获取结果。虽然NAATs被认为优于其他方法,但由于不能准确区分艰难梭菌的定植和感染,易导致对CDI的过度诊断和治疗[12],可能高估CDI发病率[24],因此需要结合其他检测方法以及临床症状进行综合判断。
1.3.2分子分型 快速、准确的分子分型对艰难梭菌暴发流行的早期监测和追踪溯源具有重要意义。目前常用的分子分型方法包括限制性内切酶分析分型(restriction endonuclease analysis typing, REA)、聚合酶链反应核糖体分型(polymerase chain reaction ribotypin, PCR RT)、脉冲场凝胶电泳(pulsed-field gel electrophoresis, PFGE)、多位点序列分析(multilocus sequence typing, MLST)、重复序列PCR(repetitive extragenic palindromic-polymerase chain reaction, rep-PCR)分型、多位点可变数目串联重复序列分析(multiple-locus variable-number tandem-repeat analysis, MLVA)和全基因组测序分析(whole-genome sequencing, WGS)等。
这些方法各有利弊,REA稳定性好,PCR RT和PFGE分辨力强,但三者费时费力,且结果受实验条件影响较大,不易推广到各级医院;MLST具有数字化优势,使不同实验室之间的结果具有可比性,但较高的成本限制了MLST在临床方面的应用;rep-PCR、MLVA和WGS分型能力强大,但前两者较难进行室间数据交流,后者对生物信息分析能力要求较高,暂未被推荐常规使用[25]。随着分子生物学技术不断发展,艰难梭菌分子分型方法在分辨能力、可重复性、成本效益以及操作简便程度上都会有更大的进步。依据艰难梭菌分子分型结果,能够更快速地识别CDI暴发,更有效地制定CDI防控措施,更合理地指导临床用药。
1.4检测策略——二步法成三步法 自艰难梭菌被发现以来,检测该细菌的方法层出不穷,但每种方法都存在着优缺点,不建议将任何一项检测方法作为诊断CDI的独立方法。综合考虑各种方法的敏感性、特异性、费用、报告时间等因素,目前许多专家和一些指南支持采用二步法或三步法进行CDI诊断。欧洲临床微生物学和传染病学会更新的艰难梭菌感染诊断指南文件[23]中推荐二步法,即GDH 和毒素A/B EIAs同步联合检测,二者结果不一致时用NAATs或TC验证。三步法先用GDH EIAs或NAATs初筛,阳性时进行毒素A/B EIAs试验,若免疫学试验阴性再用TC或NAATs确认[15]。2017年发表的我国成人艰难梭菌感染诊断和治疗专家共识[26]推荐的实验室诊断流程也基本如此,见图1。相比其他常规检测方法,二步法或三步法具有较高的敏感性、特异性和准确性,有助于减少NAATs引起的艰难梭菌过度诊断[27],在整体效益上可明显缩减医疗费用,有较大临床应用前景。
目前用于CDI诊断的主要检测方法的敏感性、特异性、费用、报告时间、检测对象和应用评价的比较见表1。
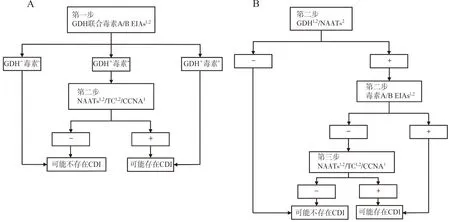
注:A,艰难梭菌感染推荐检测流程二步法;B,艰难梭菌感染推荐检测流程三步法。1,我国成人艰难梭菌感染诊断和治疗专家共识中推荐方法;2,欧洲临床微生物学和传染病学会更新的艰难梭菌感染诊断指南文件中推荐方法。

表1 目前用于CDI诊断的主要检测方法
2 艰难梭菌实验室诊断技术的发展
目前已有的艰难梭菌诊断技术存在一些不足,寻找更实用、更有效的实验诊断方法仍是目前临床面临的一大难题。当前正研究一些新技术,未来有望应用于临床。
2.1超高效液相色谱-质谱法(ultra-performance liquid chromatography-mass spectrometry, UPLC-MS)与代谢组学 UPLC-MS技术以超高效液相色谱作为分离系统,串联质谱作为检测系统。样品在液相色谱部分和流动相分离,被离子化后,经质谱的质量分析器将离子碎片按质量数和电荷数的比值大小依次排列成谱记录下来,经检测器得到质谱图,实现对复杂混合物准确的定量和定性分析。而物质代谢是肠道菌群的重要功能, CDI伴随着严重的肠道菌群紊乱,势必引起肠道内物质代谢发生改变[28]。因此,研究人员尝试利用UPLC-MS技术进行代谢组学综合分析,以诊断CDI。虽然该方法存在仪器昂贵、操作和维护复杂、样本通量有限等缺点,但分辨率高、敏感性高、特异性高、分析速度快,且进行代谢组学检测性能稳定,结果可靠,通过对相关代谢物及代谢通路进行深入分析,发现能反映机体代谢功能变化的“生物标志物群/谱”,可为研究CDI机制、筛查或治疗提供一种新的思路[29]。
2.2拉曼光谱法(raman spectroscopy, RS) 样品被激光产生的单色光照射,一些入射光子被透射或吸收,其他光子与样品的分子相互作用后被散射;大多数散射光子具有与入射光子相同的能量,这种称为弹性瑞利散射。发射的光子具有比入射光子更高或更低的能量,称为非弹性散射。在106~108个光子中,只有约1个光子在光学频率上与入射光子频率不同(即非弹性散射),产生拉曼光谱。拉曼光谱表明了分子中固有的振动、旋转和其他低频振动模式,被视为物质的“指纹”,可用于确定待测物质的性质及成分[30],已经在疾病诊断和检测等生物医学领域显示出潜在应用价值[31]。虽然这项技术有待完善,如研究对象是人为加入的毒素血清而非原始样本,但快速、廉价、高特异性、高敏感性、无需标记等优点使RS具有较大潜力,有望成为一种监测患者体内艰难梭菌毒素的床旁检测工具[32]。
2.3单分子阵列(single-molecule array, Simoa)分析 研究表明,CDI严重程度与粪便中毒素水平相关,量化粪便中毒素对疾病预后和疗效观察具有一定价值[1]。Simoa技术的基本原理为包被于磁珠上的捕获抗体与样本中抗原结合,而后β-半乳糖苷酶标记的检测抗体再与磁珠上的抗原结合,形成磁珠-抗原抗体复合物,将其转导于单分子阵列微孔板上,保证每个微孔只含有1个复合物,检测酶作用于底物产生荧光信号强度,从而获得样本抗原浓度,量化粪便中的毒素[33]。Simoa技术是一种数字化形式的ELISA,敏感性是ELISA方法的1 000倍[13]。目前,采用Simoa技术研究艰难梭菌还缺乏临床大样本的应用性研究,对低水平毒素的临床意义还需探索(即定植与感染界限不明),但是快速、廉价、高敏感性、高特异性、低样本量、全自动化、高通量等优点使国际上一直没有间断对其研究,这一技术有望促进CDI诊断。
3 结语
综上所述,艰难梭菌常规检测方法为微生物培养、免疫学检测和分子生物学检测,还有UPLC-MS、RS、Simoa等新技术在研发中。这些检测方法均有利弊,应依据行业公认的检测流程(二步法或三步法)严格操作,分层次、多渠道与临床进行沟通交流,为临床CDI诊疗提供实验室依据。

