总25-羟基维生素D磁微粒化学发光免疫分析法的建立及性能评价*
卜玲,姚孝明,张誉严,韩霜,李光
(1. 南京医科大学附属老年医院检验科,南京210024;2. 南京中医药大学附属中西医结合医院 江苏省中医药研究院检验科,南京210028;3. 江南大学生物工程学院,江苏无锡214122)
维生素D是一种人体必需的脂溶性类固醇[1],具有生物惰性,必须经过羟基化步骤去激活。在人体内,其存在2种形式:维生素D3和维生素D2。人体只能合成维生素D3,而维生素D2需要通过外界诸如食品、片剂等来补充。血清中总25-羟基维生素D(25-OH Vitamin D,25-OH VD)浓度为25-OH VD2和25-OH VD3的浓度之和[2-4]。因此,其血液浓度可用于评估总体维生素D的状态。
目前的25-OH VD检测方法学以液相色谱-串联质谱法(LC-MS/MS)和ELISA法为主。ELISA法易实现自动化操作,适合于在常规临床实验室开展,但对基质敏感,容易与其他非目标化合物发生交叉反应,降低检测的特异性,且酶促反应的结果受到反应温度、反应时间及加样准确性等因素的影响[5-6],检测速度相对较慢。LC-MS/MS被公认为检测的金标准[7],也被作为其他检测方法验证校对的参考依据,具有非常高的灵敏度、特异性和准确性,但仪器昂贵、对操作人员专业度要求较高,且需要自行开发检测方法。目前国内大多数医院没有配备相关仪器和专业人员的能力,限制了LC-MS/MS法在临床的应用推广。
化学发光免疫分析是将发光反应与免疫反应相结合,用来检测微量抗原或抗体的新型标记免疫检测技术[8],具有稳定性强,重复性好,灵敏度高,特异性强,检测速度快等优点。因此本研究通过化学发光平台,建立一种检测25-OH VD的磁微粒化学发光免疫分析法。
1 材料与方法
1.1主要仪器与试剂 MULTISKAN FC酶联仪(美国赛默飞世尔公司);SMART 6500全自动化学发光免疫分析仪(重庆科斯迈公司)。比对试剂:25羟基维生素D检测试剂盒[ELISA法,英国Immunodiagnostic Systems(IDS)公司]。
1.2主要原材料 25-OH VD单克隆抗体(英国Bioventix公司),25-OH VD衍生物(厦门同仁心公司),25-OH VD抗原、过碘酸钠、NHS-Biotin、EDC(美国Sigma公司),硼氢化钠(上海麦克林公司),25-OH VD解离液(上海汉尊公司),链霉亲和素磁微粒(美国GE公司),碱性磷酸酶(瑞士罗氏公司),3-(2-螺旋金刚烷)-4-甲氧基-4-(3-磷酰氧基)苯-1,2-二氧杂环丁烷(AMPPD)发光底物液(美国贝克曼公司)。
1.3方法
1.3.1实验流程与原理 用竞争法,首先用25-OH VD解离液90 μL将30 μL样本中的25-OH VD从结合蛋白中解离,震荡反应90 min,形成游离态。与生物素化25-OH VD衍生物共同竞争结合碱性磷酸酶标记的25-OH VD单克隆抗体,37 ℃反应40 min后,再将生物素化25-OH VD衍生物结合至链霉亲和素磁珠上,37 ℃反应30 min后,形成抗体-抗原衍生物-磁珠的复合物,最后在电磁场中对标记抗体-抗原衍生物-磁珠的复合物进行分离洗涤,弃上清,用250 μL洗液洗涤3次后加入AMPPD发光剂200 μL,室温避光放置20 min后,用全自动化学发光免疫分析仪检测发光强度,根据化学发光强度的变化测定25-OH VD浓度,竞争法中样本浓度与发光强度呈反比。
1.3.225-OH VD校准品的溯源 使用商品化的25-OH VD抗原纯品作为原料配制校准品(0 ng/mL、6.5 ng/mL、15 ng/mL、30 ng/mL、60 ng/mL、100 ng/mL),对建立的方法进行溯源。用SMART 6500全自动化学发光免疫分析仪对标准品进行赋值,绘制标准曲线。用校准品配制成已知不同浓度的质控标本,进行结果验证,并对常规标本进行检测,验证检验结果的准确性。
1.3.3碱性磷酸酶标记抗体的制备 参考杜晔等[9]使用碱性磷酸酶标记抗体的方法,并作如下改良:(1)将2 mg碱性磷酸酶溶于1 mL 0.1 mol/L pH 8.0的碳酸氢钠缓冲液中;(2)加入500 μL 0.2 mol/L的过碘酸钠并轻轻混匀,4 ℃避光反应30 min;(3)加入1.5 mL 0.1 mol/L乙二醇,轻轻混匀后4 ℃避光反应45 min,终止氧化反应;(4)加入1 mg抗体,再加入150 μL 0.5 mol/L pH 9.6的碳酸氢钠缓冲液,在0.05 mol/L pH 9.6的碳酸氢钠缓冲液中4 ℃避光透析过夜;(5)加入1 mg NaBH4,4 ℃避光反应2 h;(6)在0.01 mol/L pH 7.2 PBS溶液中4 ℃透析24 h;(7)取出透析物,在4 ℃、3 000×g条件下离心30 min取上清液,用蛋白质浓度测定仪测定其蛋白质浓度为1.1 mg/mL;(8)加入等体积甘油,-20 ℃避光保存。
1.3.4生物素化25-OH VD衍生物的制备 (1)用无水二甲基甲酰胺(DMF)将NHS-Biotin溶解至1 mg/mL,分装保存于-20 ℃备用;(2)取500 μL 2 mg/mL的25-OH VD衍生物溶液,加入5倍于25-OH VD衍生物物质的量的NHS-Biotin(1 mg/mL),并用0.5 mol/L pH 9.6的碳酸氢钠缓冲液将反应总体积补足至1 mL,室温反应1 h;(3)在0.1 mol/L PBS缓冲液透析中4 ℃透析24 h;(4)取出透析物,用蛋白质浓度测定仪测定其蛋白质浓度为5.8 mg/mL;(5)加入等体积甘油,-20 ℃避光保存。
1.3.5试剂最佳工作浓度 用棋盘滴定法,将标记抗体稀释为1.0 μg/mL、2.0 μg/mL、4.0 μg/mL和6.0 μg/mL 4个浓度,将生物素化25-OH VD衍生物稀释为25 ng/mL、50 ng/mL和100 ng/mL 3个浓度,分别交叉测试。用25-OH VD纯品,配制0浓度样本(S0)和91.5 ng/mL的高值样本(S1)进行筛选。
2 实验与结果
2.1校准品的赋值 根据ELISA法已知的线性范围,配制校准品浓度为0 ng/mL、6.5 ng/mL、15 ng/mL、30 ng/mL、60 ng/mL、100 ng/mL,经赋值后的校准曲线见图1。
2.2试剂最佳工作浓度的确定 当S1与S0的信号值之比(抑制率)小于10%,说明该组试剂浓度下的样品可以拉开较大梯度。当标记抗体浓度为1.0 μg/mL、生物素化25-OH VD衍生物浓度为25 ng/mL,标记抗体浓度为2.0 μg/mL、生物素化25-OH VD衍生物浓度为25 ng/mL,标记抗体浓度为1.0 μg/mL、生物素化25-OH VD衍生物浓度为50 ng/mL,标记抗体浓度为2.0 μg/mL、生物素化25-OH VD衍生物浓度为50 ng/mL时,S1与S0的信号值之比(抑制率)小于10%。同时,标记抗体浓度为2.0 μg/mL、生物素化25-OH VD衍生物浓度为50 ng/mL时S1与S0的信号值的绝对值又大于抑制率小于10%的另外3组,样品之间有更宽的信号空间,故选择该组试剂浓度为最佳工作浓度。见表1。

图1 25-OH VD校准曲线

表1 25-OH VD试剂最佳工作浓度确定
2.3性能验证
2.3.1准确度 用25-OH VD纯品配制高值98.75 ng/mL和低值3.17 ng/mL 2个浓度的检测样本,进行连续测定,每天对高水平和低水平样本进行3次重复测定,连续测定5 d。分别取测试结果均值,计算相对偏差。结果显示,相对偏差分别为-2.09%、-0.63%,均在±10%范围内,证明建立的方法准确度符合行业标准要求。
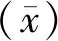
2.3.3线性试验 根据NCCLS EP6-A2文件[11],用25-OH VD纯品配制高值98.75 ng/mL和低值3.17 ng/mL 2个浓度的检测样本,按体积比1∶5、2∶4、3∶3、4∶2、5∶1混合成5个浓度梯度,作为预测值。将每个浓度样本重复测定3次,计算其平均值作为实测浓度,将平均值(X)和预测值(Y)作线性回归分析。建立的方法在3.17~98.75 ng/mL内实测值与预测值之间线性关系良好(Y=0.975 8X+0.517 7,r2=0.999 9)。见表2。

表2 25-OH VD线性试验结果
2.3.4干扰试验 根据CLSI EP7-A2[12]文件实验方案,将配制好的同稀释浓度干扰测试样本重复检测2次,用低、中、高3个浓度水平的样本作为基础样本,将每个基础样本分为5份,其中一份加入不含干扰物的样本稀释液为对照样本,另外4份中加入等体积的不同浓度干扰物质作为分析样本,每份样本重复测定3次取平均值,计算干扰率。干扰率=(分析样本测定浓度平均值-基础样本测定浓度平均值)/基础样本测定浓度平均值×100%。计算添加干扰物后与无干扰物时的干扰效应,以偏倚≤10%为判断标准。结果显示,当生物素浓度为250 nmol/L、三酰甘油浓度为1 500 mg/dL、血红蛋白浓度为1 500 mg/dL、胆红素浓度为200 mg/dL时,干扰率均小于8%,说明本方法的抗干扰能力较强。见表3。

表3 25-OH VD干扰试验结果
2.3.5稳定性 将生物素化25-OH VD衍生物-20 ℃避光保存,碱性磷酸酶标记的25-OH VD单克隆抗体4 ℃避光保存,3个浓度的检测样本(浓度分别为6.5 ng/mL、30 ng/mL、60 ng/mL)-20 ℃保存。首次测定后,分别于7、14、21、30 d进行测定,每个样品重复测定3次,求得平均值。以首次测定结果(0 d)为标准,计算稳定性,以90%~110%作为试剂稳定的评价标准。25-OH VD化学发光法检测试剂在4 ℃条件下21 d内稳定性均在90%~110%内,具有较好的稳定性,21 d后25-OH VD稳定性明显下降。见表4。

表4 25-OH VD稳定性(%)
2.3.6准确度方法学比对 根据NCCLS EP9-A2[13]文件实验方案,由江苏省省级机关医院提供200例临床样本,同时使用比对方法(ELISA法)和建立的方法进行测定,以ELISA法所测结果为X轴,本文方法所测结果为Y轴,进行回归分析。回归方程为Y=1.006 2X-0.166 3,r2=0.9792。对截距a和斜率b分别作t检验,由200例样本数查得95%置信区间t0.05/2=1.972,ta=-0.3542<1.972,说明截距a无限接近于0,无统计学意义;tb=94.310 7>1.972,说明斜率b不等于0,有统计学意义。说明两者的测定结果有良好的一致性。
3 讨论
维生素D是人体必须的脂溶性维生素。在儿童中,严重缺乏会导致佝偻病;在中老年人中,缺乏维生素D会导致骨质疏松,易引发骨折等问题。此外,有研究表明,25-OH VD还与糖尿病、癌症、心血管疾病和自身免疫性疾病有关[14-16],大剂量补充维生素D的维生素D匮乏人群来说,更需要定期监测体内25-OH VD的含量以防过量导致中毒[17],因此准确监测25-OH VD的总量至关重要。
本文建立的方法采用全自动化学发光免疫分析仪,且使用生物素-链霉亲和素信号放大体系,使25-OH VD的测定更便捷、快速,灵敏度更高。本研究对准确度、精密度、线性、干扰、稳定性和方法学比对进行了系统研究。其中,准确度偏差和批内、批间精密度均小于10%,满足临床需求,具有较好的重现性及可靠性;在3.17~98.75 ng/mL之间测量值与靶值之间线性良好;在生物素浓度不大于250 nmol/L、三酰甘油浓度不大于1 500 mg/dL、血红蛋白浓度不大于1 500 mg/dL、胆红素浓度不大于200 mg/dL等干扰下,不产生明显干扰作用。研究表明,分别用ELISA法和金标准LC-MS/MS法进行25-OH VD的方法比对,结果发现LC-MS/MS法测定的25-OH VD数值明显低于ELISA法,表明ELISA法低估了体内维生素D的缺乏,但保证严格实验条件下,ELISA法可作为筛查25-OH VD的方法,且ELISA法与LC-MS/MS法具有较好的相关性,可经公式方程互换[18]。鉴于ELISA法在常规临床实验室的广泛使用,因此,我们将本文建立的方法与英国IDS公司开发的25-OH VD检测试剂盒(ELISA法)同时测定200例临床样本,比对结果表明2种方法结果具有较好的相关性。磁微粒化学发光免疫分析法具有稳定性强,重复性好等优点,克服了ELISA法结果受反应温度、反时间及加样等因素影响的缺陷,并且省时、快速。
综上所述,本研究建立的25-OH VD磁微粒化学发光免疫分析法可应用于临床定量检测人血清中25-OH VD的含量,其准确度、精密度、线性、抗干扰能力以及稳定性均满足临床要求。

