吉富罗非鱼TCP-1-eta基因多态性及其与耐寒性状的相关性分析
许艺兰,钟丹丹,杜雪松,谢炎东,刘晶洁,孙 悦,宾石玉*
(1.珍稀濒危动植物生态与环境保护教育部重点实验室(广西师范大学),广西 桂林 541006;2.广西水产科学研究院,广西 南宁 530021)
罗非鱼是我国水产养殖的主要品种和出口优势品种[1],其耐寒能力较差,低温影响罗非鱼消化酶活性、生理生化指标及肝、脾、鳃细胞形态[2-4]。在我国罗非鱼的主要养殖区,每年冬春季节低温造成罗非鱼大量死亡,经济损失惨重[5]。低温成为制约罗非鱼产业持续发展的重要因素之一,因此,罗非鱼耐寒品种选育至关重要。利用分子标记技术筛选罗非鱼耐寒相关候选基因及其与耐寒性状相关的分子标记,在辅助罗非鱼耐寒品种的选育方面具有重要的意义[6-7]。
TCP-1-eta基因属于热激蛋白60(heat shock protein 60,HSP60)家族成员,存在于细胞质和线粒体中,由60 ku单体组成的低聚物而形成,主要功能是参与机体热应激反应,帮助多肽正确折叠和线粒体蛋白质的运输,参与DNA的代谢等[8]。研究发现:TCP-1基因与生物体的耐寒能力有关,并证实可能对生物体的耐寒能力有一定影响[9-10];南极抗冻鱼的TCP-1基因在其低温耐受性方面发挥作用[11];低温诱导下鲤鱼TCP-1-eta基因的表达量增多[12]。因此,本文研究以罗非鱼TCP-1基因作为耐寒性状的候选基因,拟开展PCR-SSCP多态性分析及其与耐寒性能的相关性分析,为辅助罗非鱼耐寒品种的选育提供基础依据。
1 材料与方法
1.1 材料、仪器及试剂
1.1.1 实验材料
试验鱼为体质量5.5 g左右的吉富品系罗非鱼,从国家级广西南宁罗非鱼良种场采购。
1.1.2 主要仪器
上海海圣制冷水循环系统(50 cm×50 cm ×50 cm)、厦门和谱仪器有限公司Centrifuge 5418离心机、格兰仕WP800TL23-K3微波炉、北京六一仪器厂DYY-6C型电泳仪、24-17-PR凝胶成像系统、海尔BCD-250TF冰箱、三印(SANYWUN)探针笔式防水水温电子温度计等。
1.1.3 主要试剂
组织基因组DNA提取试剂盒、Taq DNA聚合酶、pBR322/Msp I Maker均由天根生化科技有限公司提供,琼脂糖、丙烯酰胺、显色剂、EDTA-Na2、Tris Base等购自Sigma公司。
1.2 方法
1.2.1 实验罗非鱼的筛选
选取2 000尾体质量(5.5±0.5) g吉富罗非鱼,分别随机放入50 cm×50 cm ×50 cm编号为A、B、C、D的自动制冷水循环水族箱中,每箱500尾为1组,进行低温胁迫实验:从水温25 ℃开始,4个水族箱以0.33 ℃/h分别降温到8、10、12和14 ℃,停止降温并维持该温度,仔细观察并记录实验鱼的行为表现、昏迷和死亡情况。根据鱼的死亡时间筛选实验罗非鱼:不耐低温组为死亡最快的16尾;耐低温组为死亡最慢的16尾。分别取每箱不耐低温组和耐低温组16尾实验鱼背鳍和尾鳍之间的肌肉,肌肉样品用无水乙醇处理后-80 ℃保存备用。
1.2.2 基因组DNA的提取
采用组织基因组DNA提取试剂盒,按照使用说明书的方法和步骤,从罗非鱼肌肉提取基因组DNA。
1.2.3 引物设计与合成
根据Gen Bank数据库(登录号JQ797421)提供的TCP-1基因序列设计4对引物(表1),交由上海生工生物工程技术服务有限公司合成。

表1 罗非鱼TCP-1-eta基因PCR-SSCP分析所用引物Tab.1 Primers for PCR-SSCP analysis of TCP-1-eta gene of tilapia
1.2.4 PCR-SSCP扩增的反应体系及反应程序
PCR反应总体积50 μL,其中上下游引物(10 μmoL/L)各0.9 μL,样品DNA 3.0 μL,2×Taq MasterMix(含染料) 30.0 μL,dH2O 13.5 μL。PCR反应程序为:95 ℃预变性4 min;95 ℃变性30 s,退火30 s,72 ℃延伸30 s,32个循环;最后72 ℃终延伸10 min。反应后保存于4 ℃无菌水中。
1.2.5 PCR产物的SSCP分析
PCR扩增产物用8%聚丙烯酰胺凝胶电泳检测,具体检测步骤参照文献[3]的方法:首先量取3~4 μL PCR产物进行点样,接着300 V高压电泳10 min,然后170 V恒定电压电泳16 h检测,最后染胶并拍照保存。
1.2.6 数据处理与分析
TCP-1-eta基因的等位基因数、等位基因频率、基因型频率及Hardy-Weinberg平衡检验计算均使用Popgene 1.32软件。基因型与耐寒性状的关联性分析使用SPSS 15.0软件,P>0.05表示差异性不显著,P<0.05表示显著性差异,P<0.01表示极显著性差异。
2 结果与分析
2.1 PCR扩增与SSCP分析
用所设计的4对引物TCP1-1、TCP1-2、TCP1-3、TCP1-4,以罗非鱼基因组DNA为模板进行 PCR扩增,产物用8%聚丙烯酰胺凝胶电泳检测,进行SSCP分析。结果分析表明:引物TCP1-1、TCP1-2、TCP1-3均无带型多态性,引物TCP1-4在10 ℃样本无带型多态性。只有引物TCP1-4在8、12、14 ℃样本电泳结果呈现带型多态性,详见图1。
2.1.1 引物TCP1-4在不同低温胁迫样本扩增的电泳结果
引物TCP1-4在8、12和14 ℃样本的电泳结果中均有2种不同带型(图1),根据每个条带呈现数目的不同分别命名为基因型 AA和基因型AB,统计样本的基因型频率及等位基因频率结果见表2。
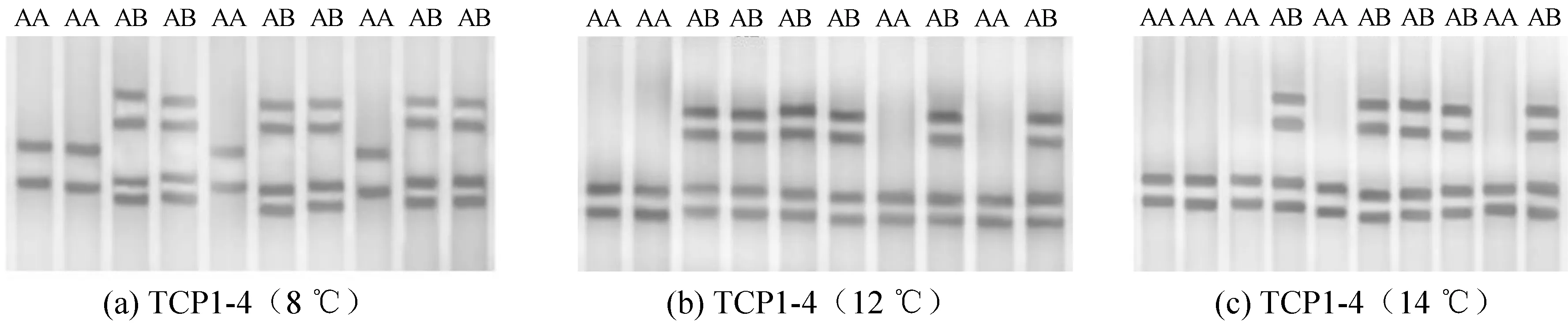
根据每个条带呈现数目的不同分别命名为基因型 AA、AB图1 引物TCP1-4在8、12和14 ℃样品扩增的电泳结果Fig.1 Amplified electrophoresis diagram of TCP1-4 primer in 8 ℃,12 ℃ and 14 ℃ sample
从表2可知,在8 ℃不耐低温组样本中基因型AA、AB的基因型频率分别为81.25%和18.75%,AA的基因型频率显著高于AB基因型频率,在不耐低温组中占优势地位。耐低温组中基因型AA、AB的基因型频率均为50.00%。2组对比发现,不耐低温组的AA基因型频率和等位基因A的频率均高于耐低温组。
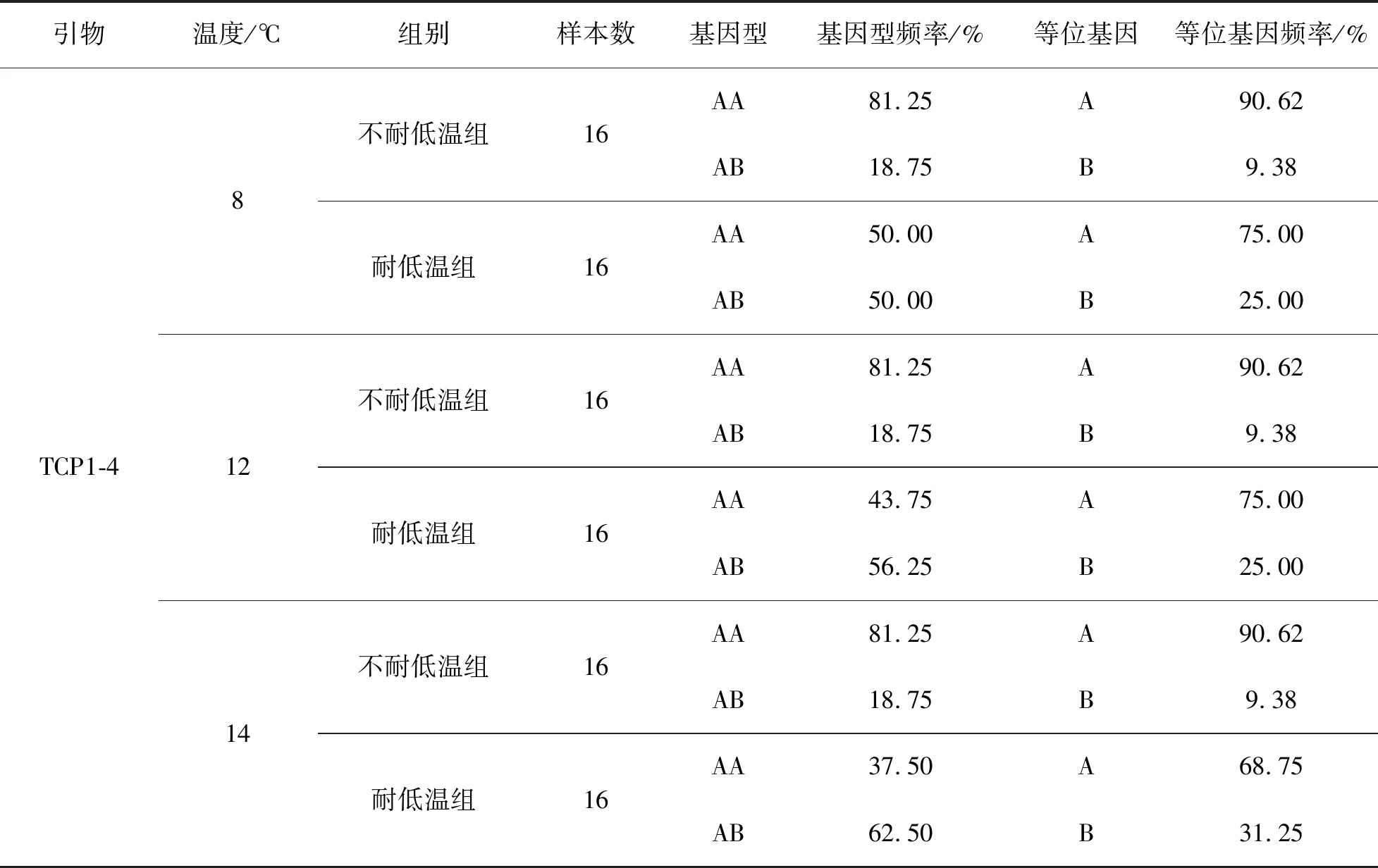
表2 不同低温样品引物TCP1-4的基因型频率及等位基因频率Tab.2 Genotypic frequency and allele frequency of TCP1-4 primer on low temperature sample
在12 ℃和14 ℃样本中:不耐低温组基因型AA、AB的基因型频率均为81.25%和18.75%;等位基因A的频率为90.62%,显著高于等位基因B的频率9.38%,占优势地位。耐低温组样品中AB的基因型频率分别为56.25%和62.50%,等位基因A的频率分别为75.00%和68.75%;2组中基因型AB的频率均高于基因型AA的频率,等位基因A的频率均处于优势地位。
2.2 TCP-1-eta基因多态性与罗非鱼耐寒性状的相关性分析
罗非鱼TCP1-4引物PCR扩增片段SSCP分析的多态性与耐寒性状的相关性结果表明:不耐低温组和耐低温组均处于Hardy-Weinberg平衡状态(P>0.05),引物TCP1-4在8 ℃(不耐低温组和耐低温组)样品的位点,AA、AB基因型的分布与罗非鱼耐寒性状的相关性不显著(χ2=3.463,P=0.063)。同时,不耐低温组中AA基因型频率81.25% 比AB基因型频率18.75%高62.50%,处于优势地位;耐低温组中AA、AB基因型频率相同,均为50.00%。引物TCP1-4在12 ℃(不耐低温组和耐低温组)样品的位点,AA、AB基因型的分布与耐寒性状有显著的相关性(χ2=4.800,P=0.028)。此时,在不耐低温组中AA基因型频率为81.25%,等位基因A的频率90.62%高于等位基因B的频率9.38%,AA基因型处于优势地位;在耐低温组中 AB基因型频率为56.25%,占优势地位。引物TCP1-4 在14 ℃(不耐低温组和耐低温组)的位点,基因型AA、AB的分布与耐寒性状有显著的相关性(χ2= 6.348,P=0.012),等位基因A和基因型AB的频率在耐低温组中占优势地位。
3 讨论
3.1 吉富罗非鱼TCP-1-eta基因的PCR-SSCP多态性分析
近年来,有关鱼类耐寒能力的研究已经广泛展开,主要集中在2大方面:一方面是探究鱼类的低温耐受分子机制;另一方面是鱼类低温耐受的相关功能基因研究[13]。目前,针对罗非鱼耐寒性状的基因与机制的报道也有不少,文献[14]通过鉴定与罗非鱼耐寒性状相关的数量性状位点和相关基因,发现基因 PAKLIP、LOC100697261、LOC100696456 的表达对其温度有影响。Zerai等[15]研究发现Delta-9-Desaturase基因对尼罗罗非鱼急慢性寒冷应激相关。但至今,关于罗非鱼TCP-1-eta基因与其耐寒能力之间相关性的研究报道较少。本文对罗非鱼TCP-1-eta基因的多态性与耐寒性状之间的相关性研究发现:引物TCP1-1、TCP1-2、TCP1-3、TCP1-4(10 ℃)的结果均显示无带型多态性。引物TCP1-4在8、12、14 ℃时均呈现带型多态性,而且2组(耐低温组和不耐低温组)均处于Hardy-Weinberg平衡状态,说明种群处于遗传平衡状态。
3.2 TCP-1-eta基因多态性与耐寒性状的相关性分析
对不耐低温组与耐低温组TCP-1-eta基因PCR-SSCP分析的基因型、基因型频率、等位基因频率进行统计,结果发现:TCP-1-eta基因中引物TCP1-4最终恒定温度降为12、14 ℃的位点,其基因型AA、AB的分布与耐寒性状之间的相关性显著(P<0.05),而在温度降为8 ℃的位点,2种基因型的分布与耐寒性状之间的相关性不显著(P>0.05)。AA基因型频率在不耐低温组中处于优势地位,AB基因型频率在耐低温组中处于优势地位,由此可推测,AB基因型在处于低温环境时有优势地位,与罗非鱼的耐寒能力有关,TCP-1-eta基因可推断为罗非鱼潜在的耐寒基因。谢建丽等[16]研究发现,在低温诱导情况下,随着低温胁迫程度加强,尼罗罗非鱼TCP-1-eta基因表达上调幅度增大,说明TCP-1-eta是低温诱导下上调表达的基因,并推测出TCP-1-eta基因是尼罗罗非鱼潜在的耐寒相关基因,与本文的推测一致,说明TCP-1-eta 基因与罗非鱼低温耐受能力相关。
4 结论
罗非鱼TCP-1-eta基因序列设计的特异性引物TCP1-4在8、12、14 ℃时样本电泳结果呈现多态性,而且12、14 ℃样本的AA、AB基因型分布与耐寒性状有显著的相关性(P<0.05)。据此推测,TCP-1-eta基因是潜在的罗非鱼耐寒相关基因。研究结果为分子标记耐寒性状和辅助罗非鱼耐寒品种选育提供了理论依据。

