例谈化学题中各类信息的挖掘与利用
东国花
(青海省海东市互助县第一中学 810599)
一、根据题干文字和表格信息发掘隐蔽条件
例1 已知常温下浓度为0.1mol·L-1的下列溶液的pH见下表:

溶质NaFNaClONaHCO3Na2CO3pH7.59.78.211.6
下列有关说法不正确的是( ).
B.加热0.1mol·L-1NaClO溶液测其pH大于9.7
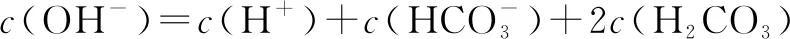
D.pH=2的HF溶液与pH=12的NaOH溶液以体积比1∶1混合,则有:c(Na+)>c(F-)>c(H+)>c(OH-)

点评本题通过题干所提供的信息,考查了学生对盐类水解规律的运用和影响水解平衡的几个因素,如,温度、浓度等等.同时,又考查离子浓度大小比较规律和溶液中三个守恒的运用,这也是教学重点、难点之一.
二、依据实验装置图及现象描述发掘隐蔽条件
例2 验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3% NaCl溶液).

①②在Fe表面生成蓝色沉淀试管内无明显变化③试管内生成蓝色沉淀
下列说法不正确的是( ).
A.对比②③,可以判定Zn保护了Fe
B.对比①②,K3[Fe(CN)6]可能将Fe氧化
C.验证Zn保护Fe时不能用①的方法
D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼
解析从题干信息和结合实验装置及现象进行对比分析:对比①②得出K3[Fe(CN)6]可能将Fe氧化为Fe2+;对比②③,Zn、Fe为电极的原电池中Fe为正极,受到了保护,故A、B、C项均正确;D中将Zn换成Cu,因K3[Fe(CN)6]可能将Fe直接氧化成Fe2+,也有蓝色沉淀生成,故不能用①的方法证明Fe比Cu活泼,D项错误.
点评本题考察了学生对原电池形成的条件和金属的防护等方面的知识,虽说该题难度不太大,但学生对实验现象理解不够深入,对隐含化学反应原理认识不清楚、不到位,会导致判断失误的.
三、解读表格中相关信息发掘隐蔽条件

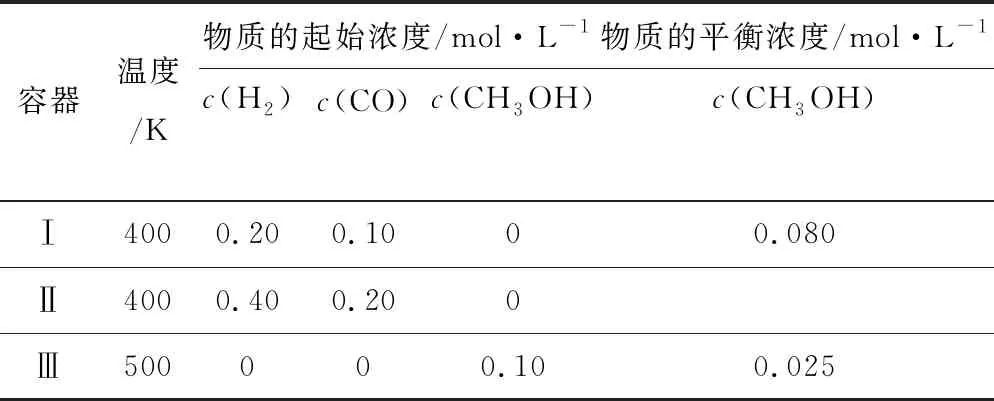
容器温度/K物质的起始浓度/mol·L-1物质的平衡浓度/mol·L-1c(H2)c(CO)c(CH3OH)c(CH3OH)Ⅰ4000.200.1000.080Ⅱ4000.400.200Ⅲ500000.100.025
①该反应的正反应放热
②达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
③达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
④达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的大
A.①② B.②③ C.③④ D.①④
解析本题中关键信息隐藏在题干和表格中,需进行挖掘,分析:Ⅰ、Ⅲ中加料比相同,为等效平衡,若不考虑温度的影响,达到平衡时的c(CH3OH)应相等,但实际上Ⅲ中CH3OH平衡浓度低于Ⅰ中,说明升高温度,平衡逆移,正反应放热,①正确;Ⅱ中的投料比是Ⅰ中的2倍,则Ⅱ中压强比Ⅰ中大,此反应正向为气体体积减小的反应,故平衡正移,致使达到平衡后,容器Ⅱ中反应物转化率比容器Ⅰ中的大,②错误;由表中数据可知,达平衡时,求得Ⅰ中c(H2)=0.04mol·L-1,由于Ⅱ中压强大于Ⅰ,故Ⅱ中c(H2)<0.08mol·L-1,计算出Ⅲ中c(H2)=0.15mol·L-1,③错误;容器Ⅰ、Ⅲ中物质的浓度等效,但Ⅲ中的温度高,故Ⅲ中无论是正反应速率还是逆反应速率均比①中大,④正确.因此D项正确.
点评本题通过一组数据,考查学生灵活运用已学的知识来判断影响化学平衡移动因素,形式新颖灵活,充分考查了学生分析问题与解决问题的能力,本题关键在于分析题干和表格的数据信息,挖掘本质问题,得出正确结论.
四、剖析概念、定义发掘隐蔽条件

A.X2为0.2 mol·L-1B.Y2为0.1 mol·L-1
C.Z2为0.4 mol·L-1D.Y2为0.6 mol·L-1
解析由于该反应为可逆反应,则反应物或生产物的浓度不可能是0,A选项中,若X2为0.2 mol/L,则需要消耗0.2 mol/L的Z2,此时生成物Z2的浓度为0,不可能,故A选项错误;B选项中,Y2为0.1 mol/L,反应消耗1/3×0.2 mol/L的X2,由于X2为0.1 mol/L,有可能,故B选项正确;C选项中,Z2为0.4 mol/L,需要消耗0.1 mol/L的X2、0.3 mol/L的Y2,此时反应物浓度都为0,是不可能的,故C选项错误;D选项中,Y2为0.6 mol/L,需要消耗0.2 mol/L的Z2,此时生成物Z2的浓度为0,不可能,故D选项错误.
点评本题通过剖析概念,训练学生的思维,提高思维的含金量,让学生深刻理解可逆反应具有一定的限度,无论反应向哪个方向进行都不会进行到底的这一特点.

