CAG多肽修饰磁性四氧化三铁纳米颗粒及其对内皮细胞的影响
卞齐豪,孙文聪,曾 峥,王焕然,王 倩,翁亚军,陈俊英
(1. 西南交通大学 生命科学与工程学院,成都 610031;2. 西南交通大学 材料科学与工程学院,成都 610031)
0 引 言
内皮细胞(endothelial cells, ECs)位于血管壁的最内侧,是血管壁内膜层重要的功能性细胞(图1(a))[1]。血管受损导致ECs功能障碍乃至被结构性破坏,是引发一系列疾病的关键诱因[2]。因此,通过促进血管损伤处周围正常的ECs增殖迁移,实现快速内皮化是血管修复的关键所在。此外,由于体内复杂的生理病理环境,具有良好靶向性的材料是修复血管受损处ECs的基础。
不同于非磁性纳米颗粒,Fe3O4-NP在外加磁场的作用下可定向朝目标移动(图1(b))。因此,在生物材料领域,研究者们通过在Fe3O4-NP上搭载特定的药物或者生物因子,使其应用于生物传感器[3]、磁共振成像[4-6]、示踪成像标记[7]、药物靶向运输[8-9]及基因传递[10]等领域。但研究者[11-12]发现,通过将一定浓度的Fe3O4-NP和ECs共培养24h后,纳米颗粒会诱发ECs功能障碍,降低ECs的一氧化氮(NO)水平以及内皮一氧化氮合酶(eNOS)的活性,同时引起氧化应激反应并伴有炎症的发生,进而导致ECs凋亡和坏死。这严重阻碍了Fe3O4-NP应用于心血管及ECs修复领域(图1(c-1)。此外,由于表面能高以及相互间的磁性作用,Fe3O4-NP易发生团聚现象,这不利于纳米颗粒在体内进行靶向运输的目的。因此,需要对Fe3O4-NP进行表面改性,以改善其性质[13]。
将功能性物质引入纳米颗粒进行表面改性是当前主要的改性手段[14-20]。其中,蛋白质修饰纳米颗粒可显著提高其生物相容性,然而引入后不可避免地会影响蛋白功能的稳定(图1(c-2))[21]。多肽作为一类由蛋白质水解而成的生物活性小分子,具有更简单稳定的结构。通过多肽修饰,纳米颗粒能获得更稳定的功能(图1(c-3))。2012年,Kanie[22]从细胞外基质中的Ⅳ型胶原中筛选出三肽分子,半胱氨酸-丙氨酸-甘氨酸 (Cys-Ala-Gly,CAG) 多肽。Kanie通过将CAG多肽引入到材料表面,发现CAG多肽对ECs具有很强的亲和性。Kuwabara[23]也通过将CAG多肽引入人工血管,并用其替代SD大鼠的颈动脉。在移植到体内1周后,CAG多肽改性后的材料表面即可达到64.4%的内皮化,6周后比例上升至97.4%,并且发现在相同时间点上,改性后的材料内皮化程度均明显高于未改性的材料。
本研究以Fe3O4-NP为基础,通过表面改性手段,将CAG多肽引入到纳米颗粒表面,获得Fe3O4-CAG(图1(d-1))。对改性的Fe3O4-CAG进行材料学表征,通过多种手段对颗粒的大小、电位、分散性、磁性性能及多肽的含量进行测定。通过细胞学实验探究改性前后纳米颗粒对于细胞活性、增殖及迁移的影响,从而为Fe3O4-NP进一步应用于心血管治疗领域提供参考(图1(d-2))。
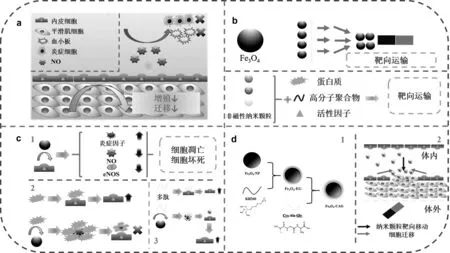
图1 ECs在维持血管壁稳态中发挥的作用(a);磁性与非磁性纳米颗粒进行靶向运输的不同(b);Fe3O4-NP对ECs的影响及其表面改性手段的对比(c);CAG多肽修饰Fe3O4-NP的设计及其在体内的靶向治疗(d)Fig 1 Role of ECs in maintaining homeostasis of blood vessel walls (a); difference of targeted transport of magnetic and non-magnetic nanoparticles (b); effect of Fe3O4-NP on ECs and comparison of surface modification methods (c); design of CAG peptide-modified Fe3O4-NP and targeted therapy in vivo (d)
1 实 验
1.1 材料及设备
Fe3O4-NP(aladdin)、3-缩水甘油基氧基丙基三甲氧基硅烷(KH560,aladdin)、CAG多肽 (吉尔生化(上海)有限公司)等。
DLS激光粒度仪、傅里叶变换红外光谱、酶标仪、倒置荧光显微镜、恒温水浴锅等。
1.2 CAG多肽修饰Fe3O4-NP
原理如图2所示。取一定量Fe3O4-NP加入乙醇溶液,超声分散后按1∶2.5(g/mL)比例将Fe3O4-NP和KH560混合,70 ℃环境下机械搅拌,冷凝回流反应5 h后除去未参与反应的KH560,收集制备好的纳米颗粒。修饰前后的纳米颗粒分别标记为Fe3O4和Fe3O4-EG。
取一定量的Fe3O4-EG,加入无水乙醇中超声分散。按环氧基与CAG多肽的摩尔比1∶2的比例,向溶液中加入CAG多肽,混合后向溶液中加入NaOH溶液,调节pH值至8.5。在80℃条件下机械搅拌,冷凝回流反应5 h后除去上述实验中未参与反应的CAG多肽,得到的颗粒加入无水乙醇中保存。样品标记为Fe3O4-CAG。
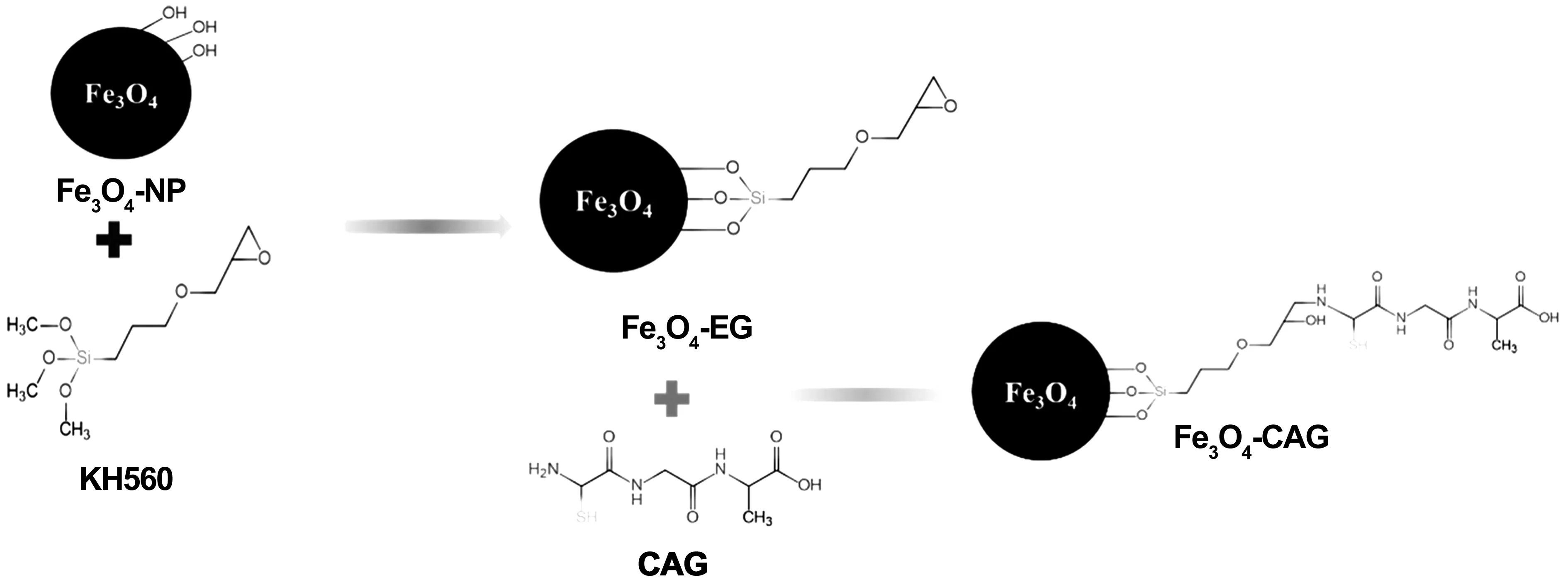
图2 纳米颗粒环氧基化及CAG多肽修饰Fe3O4-NPFig 2 Nanoparticle epoxylation and CAG peptide modified Fe3O4-NP
1.3 CAG修饰前后的Fe3O4的傅里叶变换红外光谱
取Fe3O4、Fe3O4-EG和Fe3O4-CAG进行干燥,干燥完毕后与溴化钾研磨压片。压片后进行傅里叶变换红外光谱检测。
1.4 Fe3O4-CAG表面CAG多肽的含量
图3为5,5'二硫代双(2-硝基苯甲酸)(DTNB)检测巯基的原理示意图。采用文献[24]的方法,依次配制标准CAG多肽溶液、DTNB标准溶液及DTNB分析溶液。向6个离心管中各加入2 mL DTNB分析溶液,置于25 ℃中水浴。另取5个离心管,按体积为100、140、220、300、380 μL分别向其中加入CAG多肽标准液,并用缓冲液稀释2 mL,计算每个离心管中CAG多肽的浓度。之后取各离心管中稀释的溶液400 μL,分别加入DTNB分析溶液中,空白对照组则加入400 μL的缓冲液,反应1 0min后,用酶标仪检测其在412 nm处的吸光度值,计算出CAG多肽的标准曲线;
称量一定质量m(g)的Fe3O4-CAG分散溶于缓冲液中,之后稀释至2 mL液体,取400μL加入处理后的DTNB分析溶液中,反应10 min,测量其在412 nm处吸光度,并依据式(1)计算Fe3O4-CAG中CAG多肽的含量。
(1)
C为Fe3O4-CAG中CAG多肽的含量(mol/g);n为CAG多肽物质的量(mol);m为Fe3O4-CAG的质量(g)
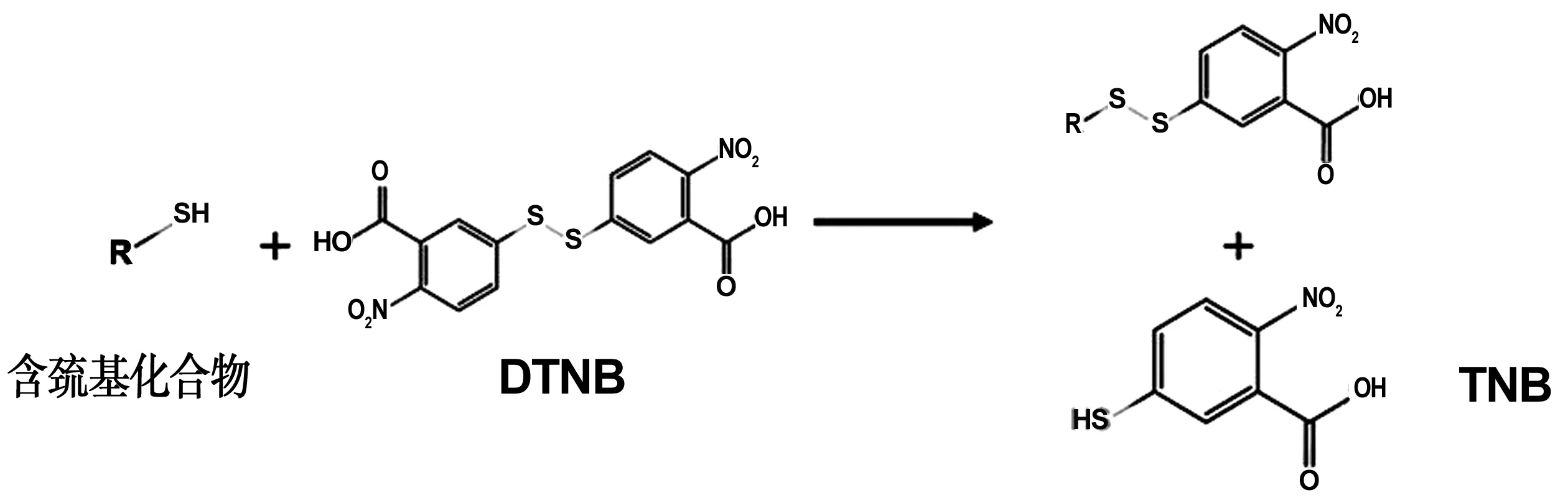
图3 DTNB检测巯基原理Fig 3 Principle of DTNB detection of thiol group
1.5 CAG修饰前后的Fe3O4的水合粒径及Zeta电位
取等量的Fe3O4、Fe3O4-EG和Fe3O4-CAG溶于RO水中,在DLS激光粒度仪中检测3组样品的水合粒径和Zeta电位。
1.6 CAG修饰前后的Fe3O4的磁性变化
取等量的Fe3O4和Fe3O4-CAG,加入到RO水中进行超声分散10 min后用磁铁对溶液中的颗粒进行吸附,观察溶液中纳米颗粒的吸附情况。
1.7 CAG修饰前后的Fe3O4对内皮细胞活性的影响
1.7.1 样品的准备
用磁性分离除去Fe3O4-CAG中的无水乙醇。取等质量的Fe3O4和Fe3O4-CAG进行紫外灭菌。之后将Fe3O4和Fe3O4-CAG各自加入细胞培养基进行稀释至相同浓度。
1.7.2 细胞培养
向24孔板中每孔加入1万单位数量的ECs,再按100、200、400 μg/mL的颗粒浓度,分别加入Fe3O4和Fe3O4-CAG,空白对照组加入等体积的细胞培养基。在5% CO2和37 ℃条件下培养1天。
1.7.3 细胞活性检测及染色
培养1天后,去掉旧培养基,加入新培养基(n(CCK-8) ∶n(细胞培养基)=1∶9),在37 ℃和5% CO2条件下孵育4 h,在酶标仪中检测450 nm处的吸光度值。用0.9%NaCl生理盐水洗掉残留的培养基和样品,加入5%戊二醛固定过夜。加入工作浓度为5 μg/mL的罗丹明染色15 min,染色完毕后干燥,用倒置荧光显微镜观察细胞形貌及数量,并统计其单位面积内细胞数量的增长率。
1.8 外加磁场下的细胞迁移实验
实验如图4所示,在孔板上培养ECs 1~2天,待细胞长满后,用无血清的培养基固定1天。用自制的1mL枪头垂直在孔板中划出一条直线,用0.9% NaCl生理盐水清洗未贴壁的细胞后,在明场显微镜下观察各划痕并标记。之后按照(M:Magnetic、N:Nanoparticles;1-存在、0-不存在)M0-N0、M1-N0、M1-N1分别加入细胞培养基、外加磁场和颗粒浓度为200 μg/mL Fe3O4-CAG。在5% CO2和37 ℃条件下培养1天。培养1天后,用0.9% NaCl生理盐水洗掉培养基和颗粒,在明场显微镜下观察各组标记处划痕,并统计细胞迁移距离。

图4 ECs迁移实验Fig 4 ECs migration experiment
2 结果与讨论
2.1 CAG修饰前后的Fe3O4的傅里叶变换红外光谱
图5为CAG修饰前后的颗粒表面结构特征变化的红外光谱。由图可见,584 cm-1为Fe3O4的特征吸收峰,3 440 cm-1处为-OH的伸缩振动峰,这表明Fe3O4上存在-OH,可与硅烷偶联剂发生反应,1 635cm-1处为C=O的伸缩振动峰,说明Fe3O4还存在羧基等杂质基团。在1 097 cm-1处出现明显的Si-O的特征吸收峰,1 465 cm-1出现C-H的特征吸收峰,而Fe3O4上无这类特征峰的出现,这类特征峰是来源于KH560。这说明硅烷偶联剂KH560成功引入到纳米颗粒表面。
通过对比Fe3O4-EG和Fe3O4-CAG的红外光谱图发现,3 440和1 635 cm-1处的峰明显加强,这说明Fe3O4-CAG中羧基含量上升。1 313 cm-1处出现-SO2-的特征峰,此为CAG多肽上的巯基被氧化所致。在1261 cm-1处,出现新的-OH特征峰,以及在1 398 cm-1处出现C-N的伸缩振动峰,表明Fe3O4-EG表面的环氧基成功开环,并与CAG多肽上的氨基进行共价结合。综合上述结果,可以证明CAG多肽已成功引入到纳米颗粒表面。
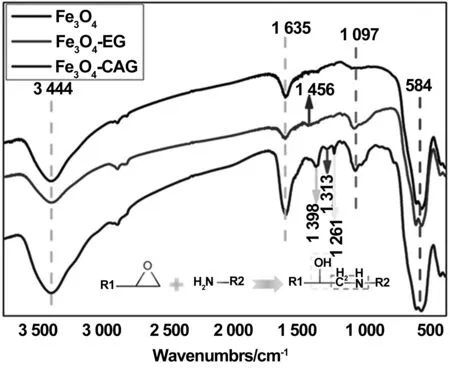
图5 Fe3O4,Fe3O4-EG和Fe3O4-CAG的红外光谱(R1: Fe3O4-EG;R2:CAG多肽)Fig 5 FT-IR of Fe3O4, Fe3O4-EG and Fe3O4-CAG (R1: Fe3O4-EG; R2: CAG peptide)
2.2 Fe3O4-CAG表面CAG多肽的含量
图6为通过实验及数据的拟合,得到的CAG多肽的标准曲线。该拟合方程为Y=0.0887+3.5080X,其中Y代表的是412 nm处吸光度值的大小,X代表的是CAG多肽浓度的多少。其拟合度R2=0.997,R2越接近1,说明该拟合曲线的拟合度越好,所得到的拟合方程越为可信。通过测定Fe3O4-CAG的吸光度值,代入到拟合方程中进行计算,得到CAG物质的量,再根据式(1)计算出结果,得到Fe3O4-CAG上多肽的含量为8.77·10-5mol/g。
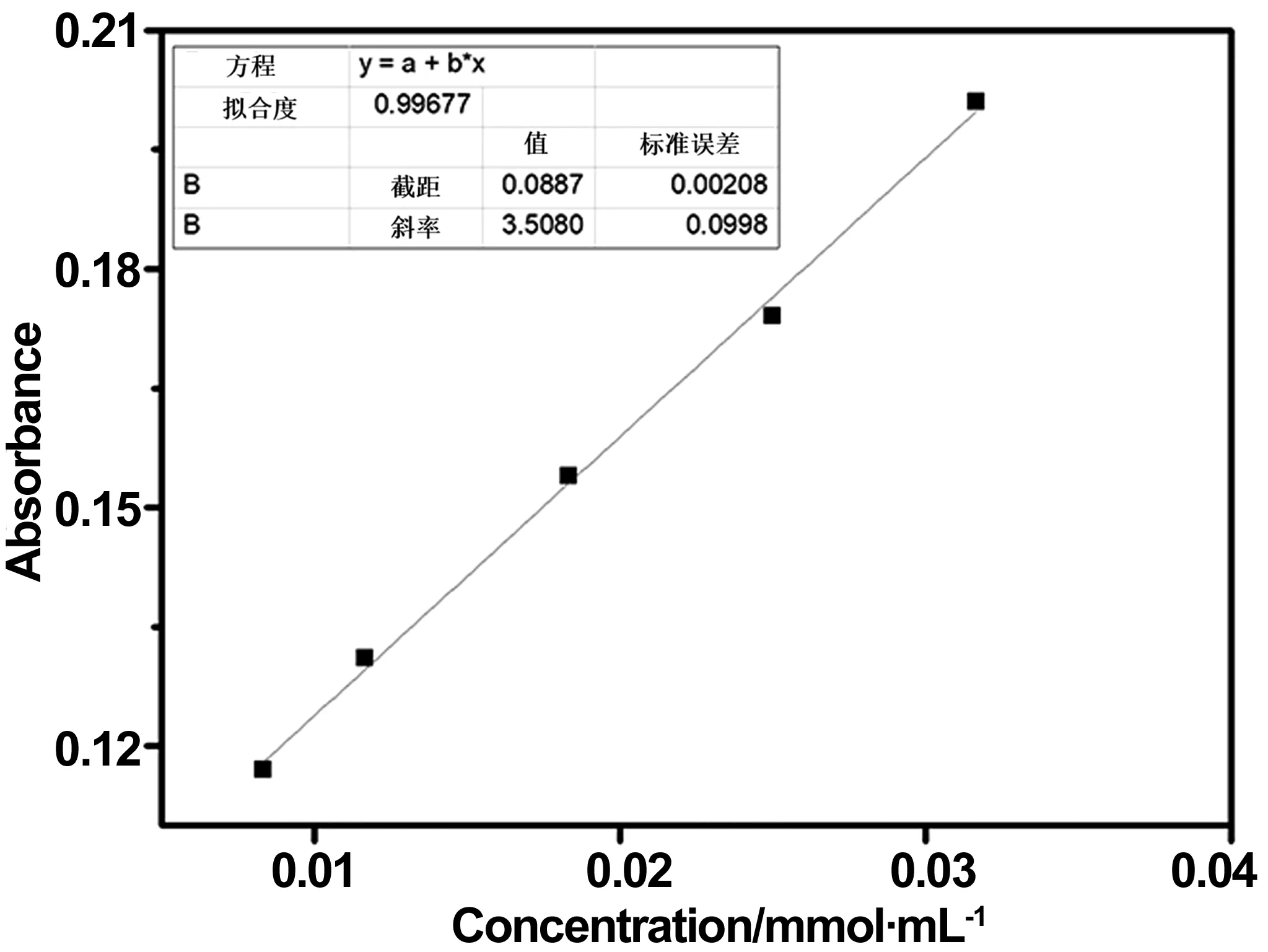
图6 CAG多肽标准曲线Fig 6 CAG peptide standard curve
2.3 CAG修饰前后的Fe3O4的水合粒径及Zeta电位
三组样品的水合粒径分别为559、453.6和384 nm(图7)。Fe3O4由于表面能较高以及磁性纳米颗粒间相互的磁性作用,在水溶液环境中很容易发生团聚,因而其水合粒径偏大。随着KH560和CAG多肽的引入,纳米颗粒间距增大,降低了纳米颗粒相互的影响,使得分散性有所提高,水合粒径有所下降。
三组纳米颗粒表面均带负电,Zeta绝对值低, Fe3O4-EG和Fe3O4-CAG相对于Fe3O4,Zeta电位的绝对值有所下降。Fe3O4表面含有-OH,但颗粒分散性较差,因而测得的Zeta绝对值相对较低。在引入CAG多肽的过程中,一方面过量消耗了颗粒表面的负电基团,另一方面颗粒表面未反应的负电基团被覆盖。从而造成Fe3O4-CAG的Zeta绝对值降低。

图7 Fe3O4,Fe3O4-EG和Fe3O4-CAG的水合粒径及Zeta电位Fig 7 Hydration particle size and Zeta potential of Fe3O4, Fe3O4-EG and Fe3O4-CAG
2.4 CAG修饰前后的Fe3O4的磁性变化
通过观察分散后的溶液状态(图8),发现Fe3O4分散性较差,短时间内会发生团聚、沉降。而CAG多肽修饰后,Fe3O4-CAG分散性有所提高,未有明显的团聚沉降。与水合粒径结果相对应,进一步说明了由于CAG多肽的引入,一方面纳米颗粒间距加大,另一方面颗粒间磁性相互作用降低,从而增加颗粒的分散性。

图8 外加磁场对Fe3O4和Fe3O4-CAG的影响Fig 8 Effect of Fe3O4 and Fe3O4-CAG under external magnetic field
外加磁场后,Fe3O4发生定向移动,溶液变得清澈。而Fe3O4-CAG在外加磁场作用下也能定向移动,但溶液浑浊,说明其中存在分散的Fe3O4-CAG。该结果说明,CAG多肽的引入仍能保留纳米颗粒的磁性性能,但会造成磁性下降。
2.5 CAG修饰前后的Fe3O4对ECs活性及其增殖率的影响
培养一天后的ECs荧光图(图9(A))结果显示,随着颗粒浓度的提高,Fe3O4组细胞数量明显少于空白组,ECs未铺展。Fe3O4-CAG组的细胞数量先上升后下降,ECs铺展较好。随浓度的提高,Fe3O4组的ECs活性呈明显下降趋势,而Fe3O4-CAG组则是先上升后下降(图9(B))。Fe3O4直接与ECs接触,诱导细胞功能障碍,从而影响ECs细胞活性。浓度为100~200 μg/mL时, Fe3O4-CAG组的细胞活性明显高于Fe3O4组的,该结果具有极显著性差异。引入CAG多肽后,一方面避免Fe3O4与ECs直接接触,另一方面CAG多肽的内皮细胞亲和性,提高了Fe3O4-NP的细胞相容性。在两方面作用下,Fe3O4-CAG组的ECs活性有显著的上升。但400 μg/mL浓度下,Fe3O4-CAG组活性却有明显下降。这可能是因为在高浓度环境下,颗粒所呈现的细胞毒性对ECs的影响超过CAG多肽的作用,从而导致细胞活性下降。
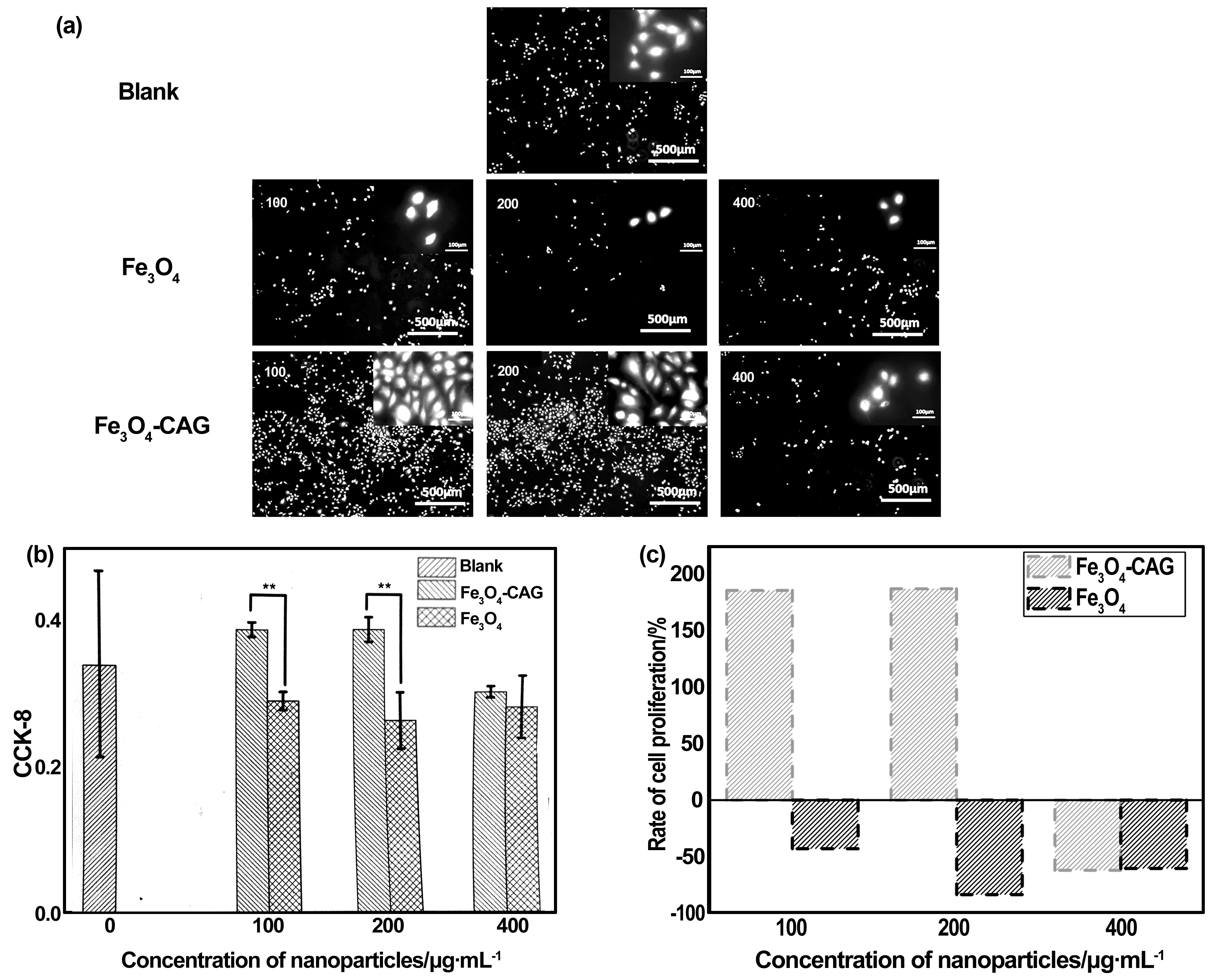
图9 不同浓度下,Fe3O4和Fe3O4-CAG与ECs培养一天后的细胞荧光图(a)、细胞活性(b)和ECs增殖率(c)(**P<0.01 表示与Fe3O4有极显著性差异)Fig 9 ECs cell fluorescence, CCK-8 values and proliferation rate of culture with Fe3O4 and Fe3O4-CAG at different concentrations after one day (** P<0.01 represents a very significant difference compared with Fe3O4)
统计单位面积内的细胞数量,计算各浓度下,各组样品对ECs增殖率的影响(图9(C))。两组样品在100 μg/mL浓度下的ECs增殖率分别为185.9%和-42.9%,200 μg/mL浓度下的增殖率分别为187.4%和-83.3%,在400 μg/mL浓度下的增殖率分别为-62.1%和-60.5%。该结果表明,CAG多肽修饰后的磁性纳米颗粒具有良好的促进ECs增殖的能力。
2.6 外加磁场作用下,Fe3O4-CAG对ECs迁移的影响
图10(a)为各组划痕模型以及培养1天后的划痕图。对于划痕迁移距离的界定,选取各组划痕两侧最外侧和最内侧。24 h后,在同一位置,划定24 h细胞迁移虚线,计算最外侧和最内侧的迁移距离,取平均值即代表各组样细胞的迁移距离(图10(b))。
M0-N0组的迁移距离为238.9 μm,而M1-N0组的迁移距离下降到97.3 μm,下降的比率达59.3%(图10(b))。有文献表明[25], 外加恒定磁场对ECs会产生不利影响,暴露在恒定磁场下24 h的ECs增殖受到影响,其活性抑制达32.9%~65.8%。M1-N1组的迁移距离达到319.0 μm,与M0-N0组相比,迁移距离上升33.5%,相较于M1-N0组有显著性差异。一方面,在CAG多肽环境下,ECs细胞活性加强,细胞增殖加快;另一方面,在外加磁场作用下,Fe3O4-CAG朝划痕中心处聚集,CAG多肽吸引划痕两侧的ECs朝聚集处黏附迁移。使得M1-N1组的细胞迁移距离和迁移增长率明显上升。

图10 划痕24 h前后细胞迁移图(a)和细胞迁移距离及其增长率(b)(*P<0.05,与M1-N0组有显著性差异)Fig 10 Cell migration map, cell migration distance and growth rate before and after scratching in each group for 24 h (* P <0.05, significantly different from the M1-N0 group)
3 结 论
(1)本文借助与硅烷偶联剂反应将环氧基引入到磁性纳米颗粒表面,通过环氧基开环与CAG多肽的氨基进行共价结合,成功地将CAG多肽接枝到纳米颗粒表面,制备出CAG多肽修饰的磁性Fe3O4纳米颗粒,即Fe3O4-CAG。
(2)Fe3O4-CAG在磁性性能未受显著影响的同时提高了分散性。
(3)CAG多肽修饰明显改善了纳米颗粒的细胞相容性。同时在外加磁场作用下,Fe3O4-CAG可促使ECs朝目标位置定向迁移。
(4)由于CAG多肽发现较晚,国内外均无CAG多肽对ECs影响机制的研究,因此本研究仅针对CAG多肽的效果和功能进行设计和探索,未对机制进一步地探讨。
(5)本研究为磁性纳米颗粒在心血管系统及血管修复中的研究与应用提供了一种新的思路及手段。

