Fe3O4@SiO2@C14mimBF4磁性固相萃取技术用于水中磺胺类药物分析
叶学敏,董丹琪,邵 华,曹小吉,莫卫民
(1.浙江工业大学 分析测试中心,浙江 杭州 310014;2.浙江工业大学 化学工程学院,浙江 杭州 310014)
磺胺类药物(SAs)是一类具有对氨基苯磺酰胺结构的人工合成药物,作为广谱抗菌剂被广泛用于兽医临床和家畜养殖。然而,磺胺类药物可在生物体内残留,并以母体及代谢产物的形式通过尿液和粪便排泄进入环境中造成一定的污染。近年来,我国的珠江、海河、长江、太湖、巢湖等流域水体均发现不同程度的磺胺类抗生素污染[1],尽管SAs含量不高,但由于其在环境中不易发生降解,会长期存在并累积,因此会对水体中生态系统平衡构成威胁,扰乱水中生物链,若存在抗生素的生活饮用水长期被人类所饮用,会对人群健康产生危害风险[2-3]。因此,有必要建立水体中磺胺类药物的检测方法,通过了解水体的污染状况,及时采取有效的措施进行控制,从而减少环境污染和降低对生态的破坏程度。
由于环境水体中磺胺类药物含量极低,且基质复杂,在检测前需要对其进行分离富集。目前环境水样中磺胺类药物的净化富集技术主要有固相萃取[4-7]、磁性固相萃取[8-10]等。磁性固相萃取技术在一定程度上弥补了传统固相萃取技术的不足,具有有机试剂消耗少、前处理步骤简单、待测物质回收率较高、精密度较好且样品不易损失等优点[11]。磁性混合半胶束固相萃取技术是基于磁性固相萃取的新型固相萃取方法,它借助静电作用力、疏水作用力等相互作用力,将十二烷基磺酸钠(SDS)[9,12]、十六烷基三甲基溴化铵(Cetyltrimethylammonium bromide,CTAB)[13]或离子液体(Ionic liquid,IL)[14-16]等离子型表面活性剂吸附到磁性金属氧化物或二氧化硅表面,形成半胶束和全胶束的混合物,并以该混合物作为吸附剂,对待测组分进行富集、净化和浓缩的技术,对有机污染物萃取能力强,且仅需几毫升有机溶剂即可完全洗脱,具有分析物范围广、易洗脱、萃取效率高、操作简便、绿色环保、低成本等优点[14,17],在富集萃取不同极性的分析物方面显示出广泛的应用前景。本研究旨在通过构建磁性离子液体混合半胶束体系,建立水中痕量磺胺类药物的离子液体混合半胶束磁性固相萃取-液相色谱检测方法。
1 实验部分
1.1 材料和试剂
磺胺噻唑(Sulfathiazole,STZ)、磺胺甲二唑(Sulfamethizole,SMTZ)、磺胺苯甲酰(Sulfabenzamide,SBA)、磺胺氯吡嗪(Sulfaclozine,SCZ),4 种磺胺类药物的结构信息见表1,纯度均大于98.0%,购于上海阿拉丁试剂有限公司;由甲醇配制为5 000 μg/mL的标准储备液,-4 ℃避光保存,根据需要再用甲醇逐级稀释成不同质量浓度的系列混合标准工作溶液。甲醇、乙腈为色谱纯试剂,购自Merck公司(Darmstadt,德国)。超纯水由Milli-Q水纯化系统(18 MΩ,Millipore,Bedford,MA,USA)制备。
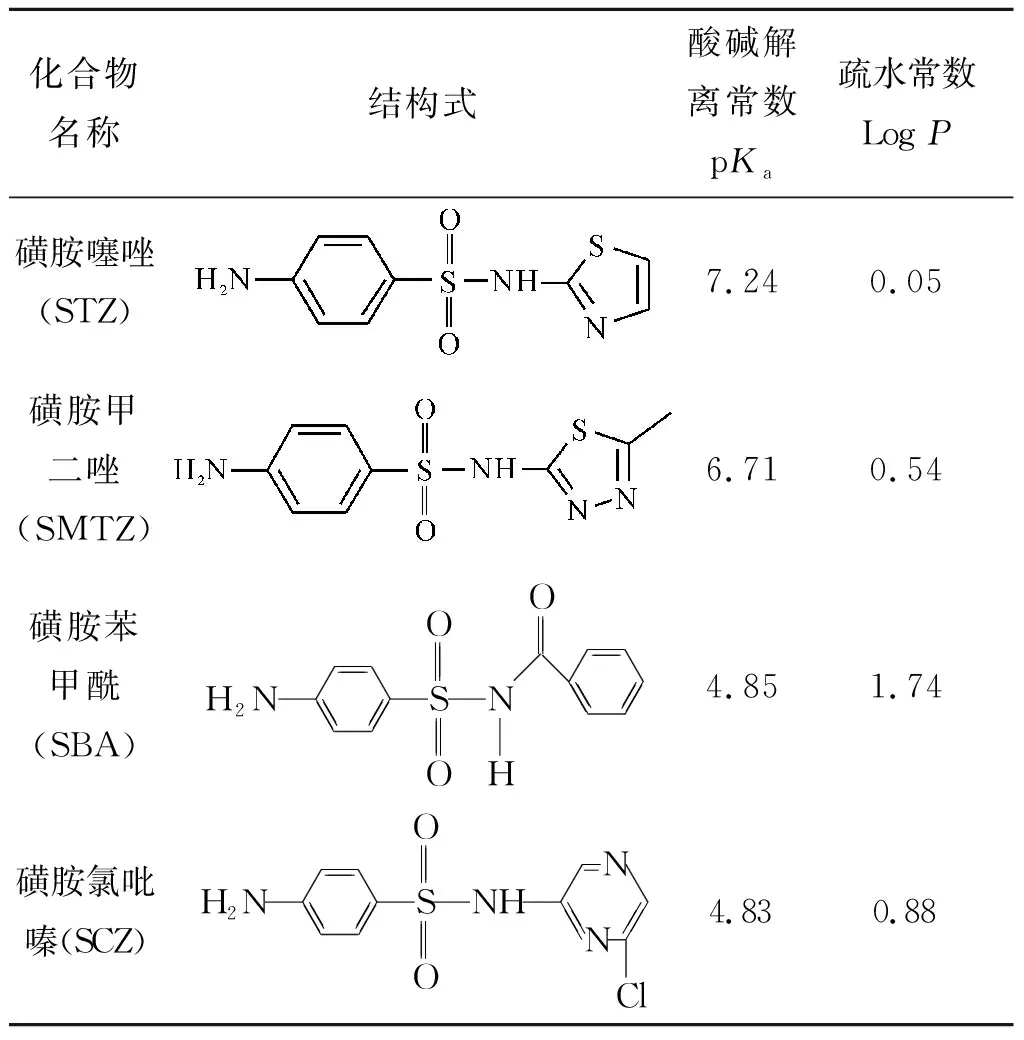
表1 4 种磺胺类药物的结构信息Table 1 Structures of four sulfanilamides compounds
离子液体[C14mim][BF4]购自上海成捷化学有限公司。用于合成磁性二氧化硅(Fe3O4@SiO2)的(NH4)2Fe(SO4)2·6H2O、(NH4)Fe(SO4)2·12H2O、25%氨水和正硅酸乙酯(TEOS)均为分析纯,购自上海阿拉丁试剂有限公司。N50级的铁钕硼强磁铁(50 mm×50 mm×10 mm)购自鄞州冠能磁业有限公司(宁波,中国)。
1.2 Fe3O4@SiO2的合成与表征
根据文献[18]的方法制备Fe3O4@SiO2。首先采用化学共沉淀法制备Fe3O4磁核,其次采用Stober法在Fe3O4磁核外包裹上SiO2,然后用磁铁将Fe3O4@SiO2从悬浮液中分离出来,分别用超纯水和无水乙醇洗涤3 次,50 ℃真空干燥5 h。
Fe3O4@SiO2的结构经过红外光谱(Nicolet 6700,Thermo,USA)、X’Pert PRO型X射线衍射仪(PANalytical,Netherlands)确证,并采用S-4700扫描电子显微镜(Hitach,Japan)分析形貌,采用振动样品磁强计(Lake shore 7410,USA)表征磁场强度。通过测量在不同pH条件下Fe3O4@SiO2悬浮液的Zeta-电位(DelsaTM Nano C,Beckman Coulter,USA)来表征Fe3O4@SiO2纳米颗粒的表面带电状态。
1.3 磁性固相萃取过程
10 mL水样中加入5 mg Fe3O4@SiO2和C14mimBF4,使C14mimBF4的最终质量浓度为300 μg/mL,用NaOH调节pH值为10,然后将此悬浊液超声20 min分散,静置10 min。然后将N50的NdFeB磁铁静置于瓶壁外一段时间,当悬浮液变得清澈时(约1 min后),弃去上清液,并用4 mL(每次2 mL)1%的甲酸乙腈溶液在超声作用下对吸附了磺胺类化合物的吸附剂进行洗脱,收集洗脱液,在40 ℃下用氮气吹干,并用1 mL含5%的乙腈水溶液溶解后过0.22 μm尼龙滤膜,注入UPLC系统进行分析。
1.4 磺胺类药物的UPLC检测方法
磺胺类药物采用Waters Acquity超高效液相色谱仪检测,色谱柱型号为CSHTMC18(100 mm× 2.1 mm,1.7 μm)。流动相线性梯度洗脱条件见表2,其中流动相A为0.1%甲酸水溶液,流动相B为乙腈。流速0.4 mL/min;柱温25 ℃;进样体积10 μL;检测波长270 nm。洗脱液经过色谱柱后直接进入PDA检测器。
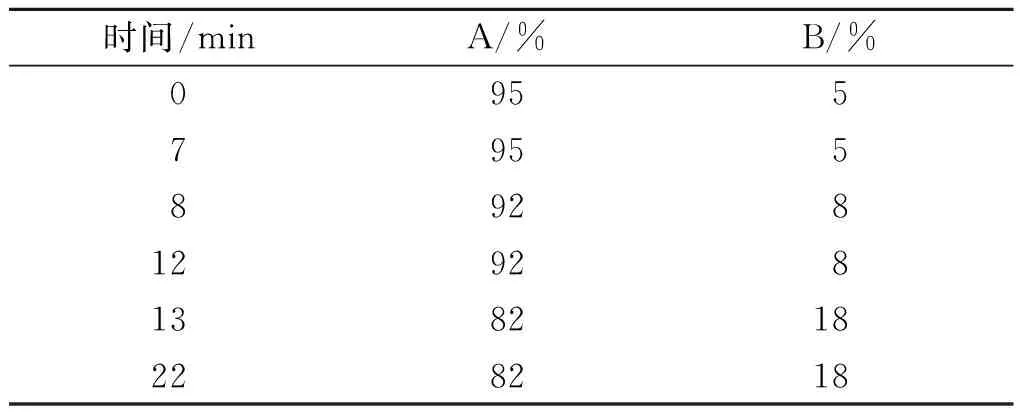
表2 磺胺的高效液相色谱洗脱梯度条件
2 结果与讨论
2.1 Fe3O4@SiO2纳米颗粒的合成与表征
图1(a)为Fe3O4@SiO2的红外光谱图,图中588.9 cm-1的峰对应磁核的Fe—O—Fe伸缩振动,1 088.9 cm-1的峰对应Si—O—Si基团的面内伸缩振动,1 634.5,3 435.0 cm-1分别对应Si—OH的弯曲振动和伸缩振动。图1(b)为Fe3O4@SiO2的X-射线衍射图,图中2θ=30.2°,35.6°,43.3°,53.6°,57.2°,62.8°处的衍射峰分别对应纯立方尖晶石晶系Fe3O4的220,311,400,422,511和440晶面(JCPDS卡,03-065-3107)的特征吸收峰,而无定型SiO2在XRD图中则不显示。图1(a, b)的结果表明Fe3O4@SiO2纳米颗粒已经成功制备。图1(c)为Fe3O4@SiO2的扫描电镜图,从图中可以看出,制备的Fe3O4@SiO2纳米颗粒外观近似呈球形,直径为50~70 nm。如图1(d)所示,Fe3O4@SiO2没有磁滞现象,表现出了良好的超顺磁性特征,其最大饱和磁化强度为37.0 emu/g,说明该材料在外加磁场的作用下很容易被分离出来。图1(e)为不同pH条件下Fe3O4@SiO2悬浮液的Zeta电位,由图可知Fe3O4@SiO2纳米颗粒的等电点为3.2,与文献报道的二氧化硅的等电点为3.0的结果[19]基本一致。当pH高于3.2时,Fe3O4@SiO2纳米颗粒表面带负电荷,可以与离子液体的阳离子部分产生静电吸附作用。而当pH高于8时,体系的zeta电位基本维持在-32 mV,说明pH大于8是Fe3O4@SiO2纳米颗粒呈负电最稳定的区域,能吸附离子液体的阳离子部分形成稳定的磁性混合半胶束体系。
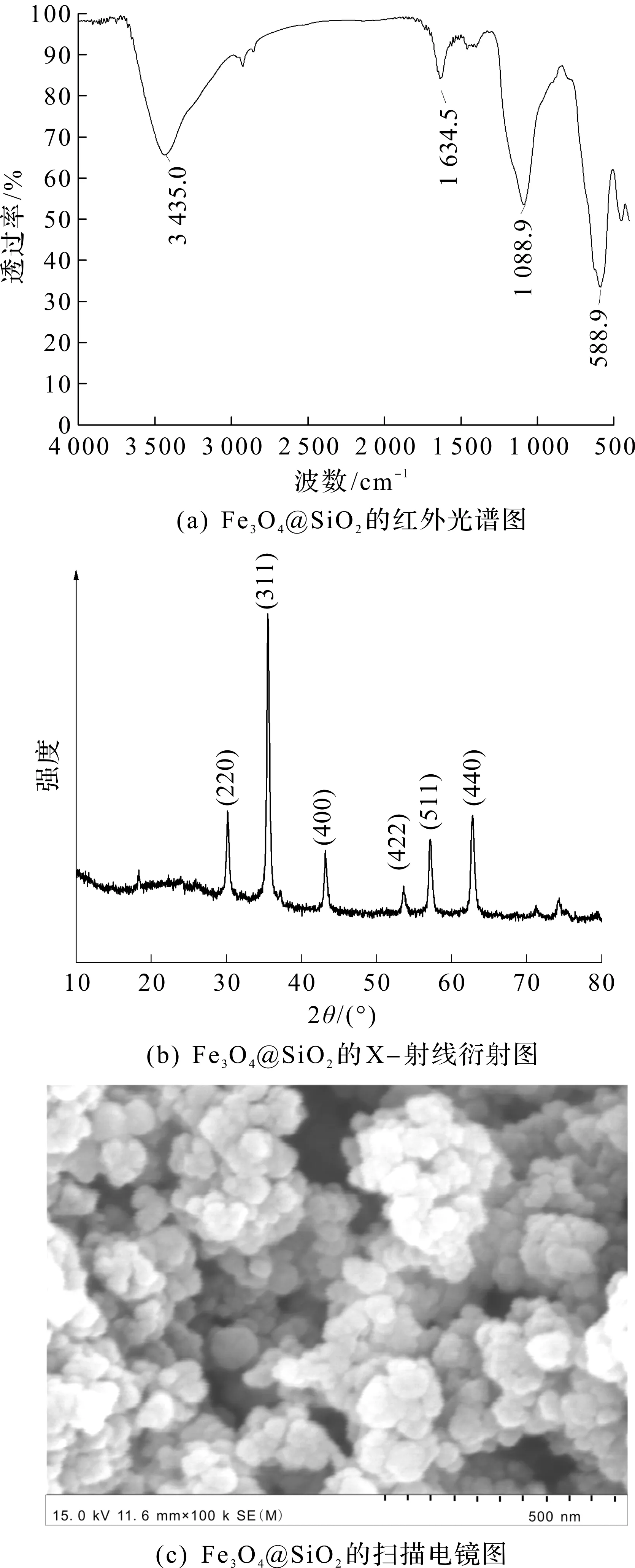
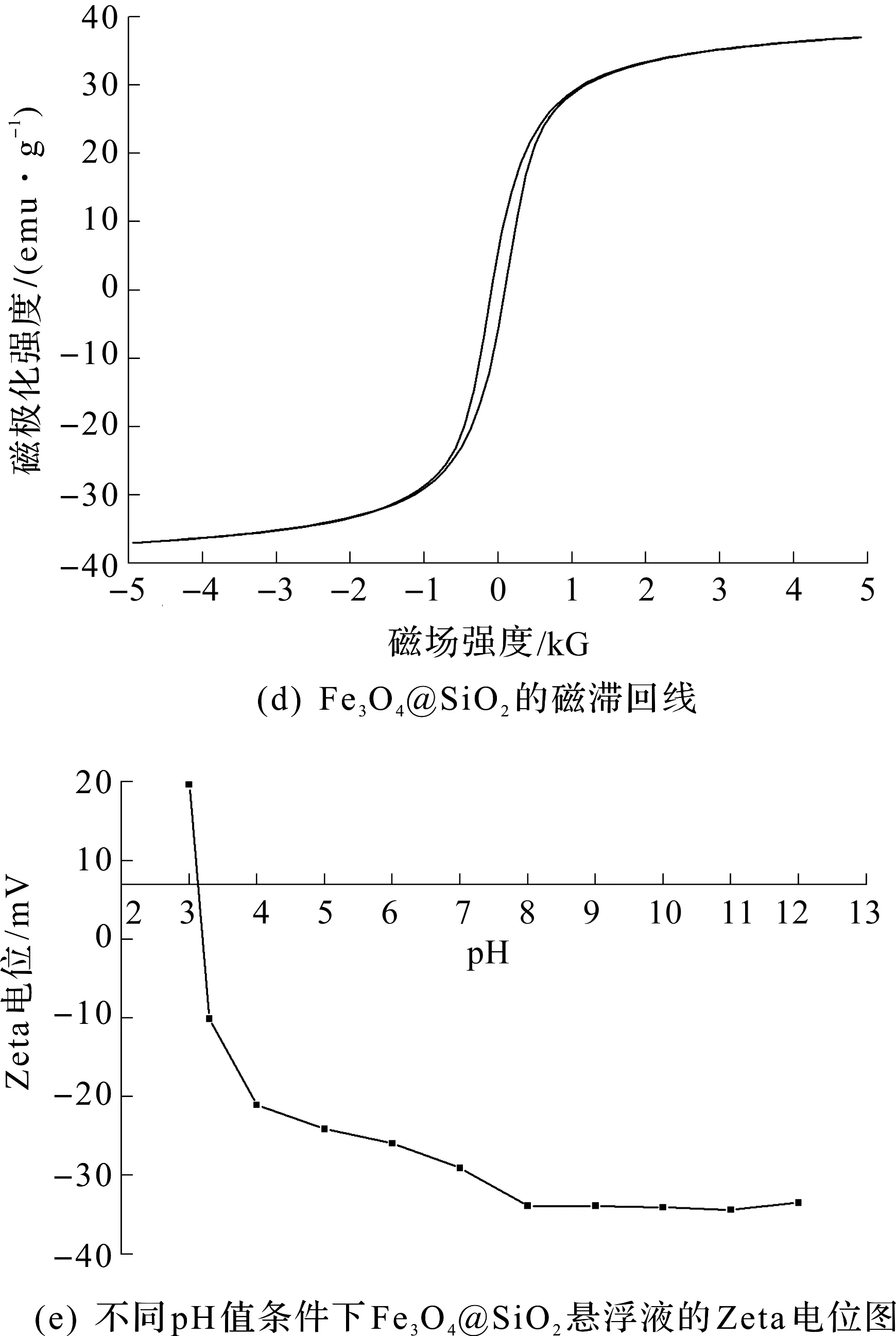
图1 Fe3O4@SiO2的表征结果Fig.1 Characterization of Fe3O4@SiO2 nanoparticles
2.2 Fe3O4@SiO2@C14mimBF4混合半胶束体系的构建
为了构建Fe3O4@SiO2@C14mimBF4混合半胶束体系,考察了离子液体C14mimBF4在Fe3O4@SiO2纳米颗粒表面的吸附情况。图2为pH值为10时C14mimBF4质量浓度对体系Zeta电位的影响。由图2可知:当C14mimBF4的质量浓度为0~45 μg/mL时,Zeta电位从负值增加至零。此时,由于静电吸引力的作用,[C14mim]+阳离子逐渐被吸附在带负电荷的Fe3O4@SiO2纳米颗粒表面,直至正负电荷完全抵消,形成Fe3O4@SiO2纳米颗粒表面单层吸附满C14mimBF4的半胶束(hemimicelles)体系;当C14mimBF4质量浓度为45~300 μg/mL时,Zeta电位由零逐渐增大到最大值。此时,由于疏水作用和静电排斥力的共同作用,C14mimBF4的长链烷基尾端朝内,极性咪唑环朝外,吸附在半胶束的外层,由于此时体系中单层半胶束和双层胶束共同存在,因此该区域称为混合半胶束(mixed hemimicelles)区域,混合半胶束体系的外层既有极性较大的正电咪唑环,又有极性小的疏水烷基链,因此既可以通过静电作用与极性分析物相互作用,又可以通过疏水作用与疏水性分析物相互作用,为不同类型的分析物提供了两种不同的保持机制;当C14mimBF4质量浓度高于300 μg/mL时,Zeta电位基本不变,说明双层吸附达到饱和,该区域为胶束区域(admicelles)。由于过量的C14mimBF4也会在溶液中自聚集形成胶束,吸附部分目标分析物,因此会导致分析物在磁性胶束体系上的吸附量减少,因此该区域不适合磁性固相萃取。综上所述,当C14mimBF4的质量浓度为45~300 μg/mL时,形成的混合半胶束体系适合作为磁性固相萃取吸附剂。
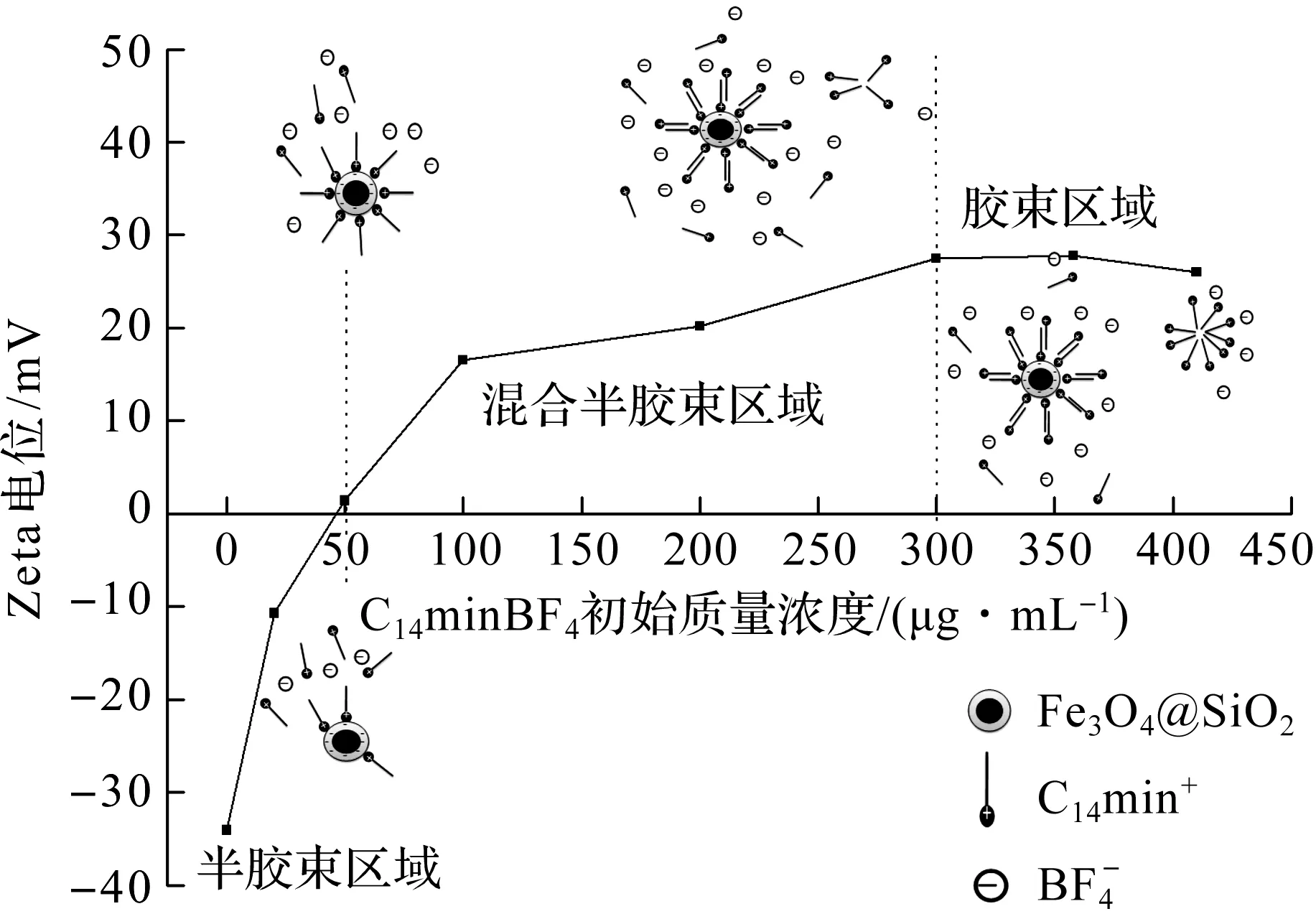
图2 C14mimBF4在Fe3O4@SiO2上的Zeta电位等温线Fig.2 Zeta-potential of Fe3O4@SiO2 nanoparticles by adsorption of C14mimBF4
2.3 C14mimBF4浓度对磺胺类化合物萃取效率的影响
对比了pH为10的情况下,不加离子液体C14mimBF4以及C14mimBF4质量浓度分别为50,300 μg/mL时,吸附剂体系对磺胺类化合物的吸附效果,结果如图3所示。当不加离子液体C14mimBF4时,磺胺类化合物几乎不吸附在Fe3O4@SiO2纳米颗粒的表面;而加入C14mimBF4后,体系对SAs的吸附率显著提高,在C14mimBF4质量浓度为300 μg/mL时,吸附率最高。分析原因为,在pH值为10时,Fe3O4@SiO2纳米颗粒呈负电荷状态,磺胺类化合物由于去质子化也呈负离子的形式(4 种磺胺类化合物的pKa值介于4.83和7.24之间)。当不加离子液体时,SAs和Fe3O4@SiO2之间存在静电排斥力,导致吸附效率较低;当C14mimBF4质量浓度为50 μg/mL时,由Zeta电位等温线可知此时C14mimBF4静电吸附在Fe3O4@SiO2纳米颗粒表面使混合半胶束体系带正电,因此吸附剂对SAs的静电排斥力已转变为静电吸引力,因此吸附率增加明显;当C14mimBF4的质量浓度达到300 μg/mL时,吸附剂对SAs的静电吸引力达到最大值,因此吸附效率也最强。所以最终选定C14mimBF4的质量浓度为300 μg/mL。

图3 C14mimBF4质量浓度对磺胺类化合物萃取效率的影响Fig.3 Effect of the concentration of C14mimBF4 on the extraction of SAs
2.4 Fe3O4@SiO2用量对磺胺类化合物萃取效率的影响
如图4所示,考察了不同用量(3,5,10,15 mg)的Fe3O4@SiO2对水样中磺胺类化合物吸附率的影响。由图4可以看出:随着Fe3O4@SiO2的量从3 mg增加到5 mg,SAs的吸附率也随之增大;继续增大Fe3O4@SiO2用量,SAs回收率基本保持不变。因此,最终选择5 mg的Fe3O4@SiO2作为最终吸附剂用量。
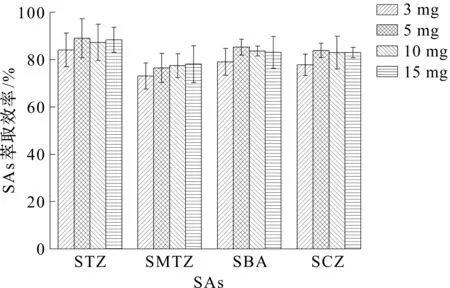
图4 Fe3O4@SiO2量对磺胺类化合物萃取效率的影响Fig.4 Effect of the amount of Fe3O4@SiO2 on the extraction of SAs
2.5 离子强度对磺胺类化合物萃取效率的影响
通过在水样中加入不同质量浓度的NaCl溶液(10~200 mmol/L)来研究离子强度对萃取效率的影响。实验结果如图5所示,随着NaCl质量浓度的增加,磺胺类化合物的吸附效率显著降低。导致这一结果的原因有两种可能:一是溶液中的Na+离子会与[C14mim]+阳离子竞争吸附在Fe3O4@SiO2表面,从而阻碍混合半胶束体系的形成;二是溶液中的Cl-离子会与去质子化的磺胺类负离子竞争吸附在混合半胶束体系的表面,因此吸附磺胺类化合物的量减少。所以最终选定体系中不加盐。
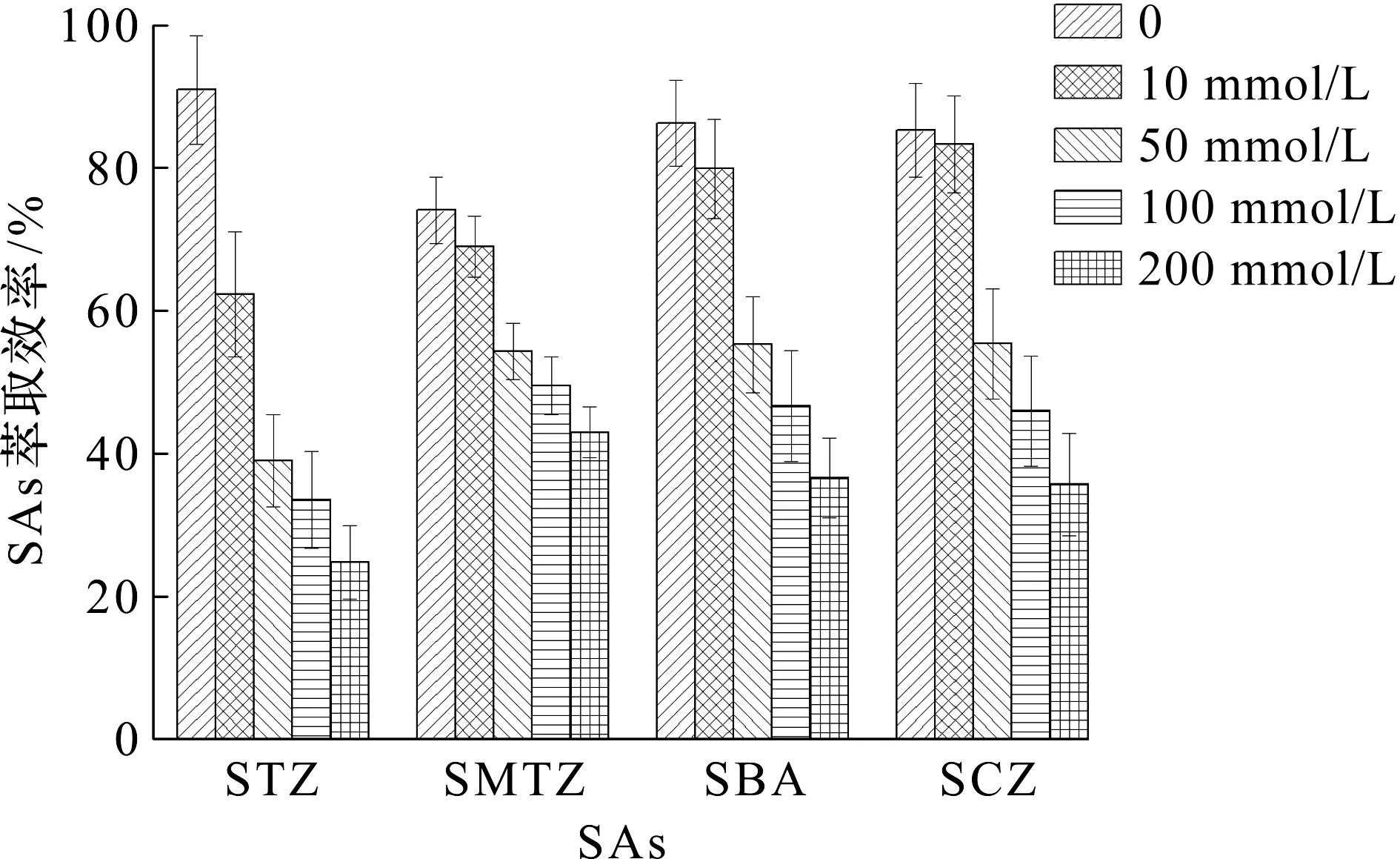
图5 离子强度对磺胺类化合物萃取效率的影响Fig.5 Effect of the ionic strength on the extraction of SAs
2.6 超声时间对磺胺类化合物萃取效率的影响
最佳的萃取时间既保证了分析物和吸附剂有足够的相互作用时间,又最大程度避免了不必要的时间浪费。因此考察了不同超声时间(5,10,20,30 min)对水样中SAs吸附率的影响。结果如图6所示,随着超声时间的增加,SAs的吸附率逐渐增大,当萃取时间为20 min时,SAs吸附率达到最大值,而当超声时间大于20 min时,SAs吸附率反而有所下降。可能的原因为过长的超声时间会导致吸附在Fe3O4@SiO2表面的C14minBF4重新脱落下来。因此,最终选择20 min为最佳的超声萃取时间。

图6 超声时间对磺胺类化合物萃取效率的影响Fig.6 Effect of the ultrasonic time on the extraction of SAs
2.7 方法学评价
在最优的萃取条件和色谱条件下,分别对系列质量浓度为10~200 ng/L的磺胺类标准溶液进行测定,得到4 种SAs的线性回归方程,结果如表3所示。从表3可以看出:4 种SAs的线性相关性良好,相关系数为0.999 1~0.999 9。以3倍信噪比(s/n=3)和10倍信噪比(s/n=10)得到方法的检出限和定量限分别为1.21~2.25 μg/L和4.23~7.89 μg/L。此外,按每个水样平行测定3 次,每天分4 个时段,每个样品连续测定3 d,最后所得的日内相对标准偏差(RSD)为2.2%~5.3%,日间RSD为3.9%~9.2%。由数据可知,此方法重现性和精密度均较为理想、可靠性高。

表3 离子液体混合半胶束磁性固相萃取-超高效液相色谱检测方法评价Table 3 Evaluation of the ionic liquid mixed hemimicelles magnetic solid-phase extraction-UPLC method
2.8 实际水样的测定
采用所建立的混合半胶束固相萃取-UPLC检测方法分别对杭州市上塘河、西湖和钱塘江的水样进行加标回收试验,4 种磺胺类药物的加标质量浓度分别为10 μg/L和20 μg/L,每个浓度平行检测3 组,空白样品为对照,空白样品和加标水样中4 种磺胺类药物的液相色谱图见图7,其平均回收率和相对标准偏差结果见表4。结果表明,在杭州市的3 处水样中均未检出磺胺类药物残留。STZ、SMTZ、SBA和SCZ的回收率为70%~100%,4 种磺胺类化合物的相对标准偏差均小于10%。说明该方法精确度高、重现性好,适用于实际水样中STZ、SMTZ、SBA和SCZ这4 种磺胺类化合物的检测。
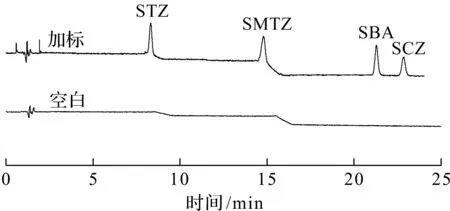
图7 空白样品和加标水样中4 种磺胺类药物的液相色谱图Fig.7 LC chromatograms of 4 SAs in blank and spiked water samples

表4 水样中4 种磺胺类化合物的加标回收率Table 4 Recovery of sulfonamides in water samples
3 结 论
本研究首先制备了具有良好磁性的Fe3O4@SiO2吸附剂,通过考察离子液体在Fe3O4@SiO2表面的Zeta电位,成功构建了基于C14mimBF4离子液体的混合半胶束磁性固相萃取体系,并将其应用于环境水样中的磺胺类药物的磁性混合半胶束固相萃取检测。对影响萃取效率的主要因素,包括C14mimBF4离子液体浓度、Fe3O4@SiO2量、离子强度、超声萃取时间等参数进行了探索与优化,建立了适合磺胺类化合物分析的磁性混合半胶束固相萃取-超高效液相色谱检测方法。与传统的固相萃取方法相比,所建立的方法具有绿色环保(有机溶剂用量少,磁性材料用量少并可重复利用)、简便快速(磁性分离操作简便、分离速度快,避免繁琐的过柱程序)、分析物易洗脱等优点。结果表明,本研究制备的Fe3O4@ SiO2@ C14mimBF4萃取剂能够有效地用于环境水样中痕量磺胺类药物的吸附萃取。

