中华绒螯蟹病原弗氏柠檬酸杆菌的鉴定及其毒力基因检测
苗珍,李席席,高晓建,张双明,姜姿妍,陈启运,童帅旗,张晓君
(扬州大学动物科学与技术学院,江苏 扬州 225009)
中华绒螯蟹(Eriocheirsinensis)俗称河蟹(以下简称河蟹),也称大闸蟹,隶属节肢动物门、甲壳纲、十足目,是一种在淡水中生长育肥、在海水中生殖繁衍的洄游性甲壳类动物。其营养丰富,肉质细嫩、味道鲜美,被誉为水产珍品,深受广大消费者的青睐。随着20世纪80年代河蟹人工育苗和养殖技术的突破,其养殖规模、养殖面积在逐渐扩大,2016年我国成蟹养殖产量高达81.21万吨[1]。然而在河蟹大量养殖过程中也伴随了一些病害的发生,尤其是由某些病原微生物特别是细菌引起的传染病,常具有发病及死亡率高、在特定水环境中传播速度快等特点,已成为制约其发展的不利因素之一。徐海圣等[2]从患病河蟹分离到致病菌副溶血弧菌(VibrioParahemolyticus);姜光明等[3]从患病河蟹体内分离到致病菌维氏气单胞菌(Aeromonasveronii)和弗氏柠檬酸杆菌(Citrobacterfreundii);曹海鹏等[4]从患肠炎的河蟹体内分离到点状产气单胞菌(Aeromonaspunctate);徐海圣等[5]从患病河蟹体内分离到易损气单胞菌(Aeromonastrota)。2017至2018年课题组对江苏省扬州多家河蟹养殖场进行流行病学调查,发病池塘河蟹大量死亡,不摄食、行动缓慢,活力下降,附肢无力,应激能力减弱,个别出现在池塘周边;病蟹体色较健康蟹灰暗,无光泽,病原检测结果表明引起多家养殖场河蟹大批死亡的病原之一为弗氏柠檬酸杆菌。
弗氏柠檬酸杆菌隶属于肠杆菌科(Enterobacteriaceae)柠檬酸杆菌属(Citrobacter)。该菌是一种“人-兽-鱼”共染病原菌,可引起人、哺乳动物、鱼、鳖、虾等感染发病[6]。目前已有研究表明弗氏柠檬酸杆菌对红螯螯虾、中华绒螯蟹、三疣梭子蟹、中华鳖和克氏原螯虾等多种水产动物具有致病性[7-10]。此外,Fernandez等[11]报道弗氏柠檬酸杆菌可导致新生剑吻鲸死亡。
本研究对分离自病蟹体内的菌株LJ1进行了形态特征、理化特性、16S rRNA和gyrB基因序列的同源性分析及致病性检验,确定该病原为致病性弗氏柠檬酸杆菌,该病原菌对河蟹的半数致死量(LD50)为2.1×106CFU/mL,且携带7种毒力基因,旨在为中华绒螯蟹病原学研究积累相关资料,为其相关疾病的防控提供一定的科学参考。
1 材料与方法
1.1 细菌分离与纯培养
从江都某养殖场,随机取6只病蟹用生理盐水多次洗涤后取肝胰腺以及肌肉划线到LB琼脂培养基平板上,28 ℃恒温培养24 h。选取优势生长菌落进一步划线纯化,将纯化后的细菌接种到普通液体培养基中进行扩增,之后置于4 ℃冰箱中保存。
1.2 人工感染试验
对分离菌株LJ1进行人工感染试验以确定其致病性。试验用体长4 cm左右健康幼蟹,购自江苏省金坛一河蟹养殖场。将菌株LJ1接种于普通LB液体培养基,28 ℃恒温培养18 h,4 000 r/min离心5 min后弃上清,沉淀用0.85% NaCl生理盐水重悬,再次离心、重悬后,用生理盐水将菌液制备成2.7×108、2.7×107、2.7×106、2.7×105、2.7×104CFU/mL共5个浓度梯度,分别用不同浓度的供试菌悬液对健康的幼蟹进行肌肉注射感染,每个试验组10只,每只注射0.1 mL;注射相同剂量的生理盐水作对照。对感染后的幼蟹隔离培养,定时观察并记录河蟹的死亡情况,测定分离菌对河蟹的LD50[12]。
1.3 形态与理化特性检验
将上述纯培养菌株分别接种于普通LB液体培养基和固体培养基中,28 ℃培养24 h后观察菌落的表型特征,同时对细菌进行革兰染色,在光学显微镜下观察细菌形态特征,分离菌LJ1经磷钨酸负染后在透射电子显微镜下观察鞭毛等形态。依据文献[13]进行糖(醇和苷)类代谢、有机酸盐利用、硝酸盐还原等理化特性测定。
1.4 16S rRNA和gyrB基因序列测定与同源性分析
1.4.1 PCR模板DNA的制备
将菌株接种于普通液体培养基中,置于摇床中28 ℃培养18 h。取2 mL的菌液12 000 r/min离心1 min;弃上清液,将菌体悬浮于100 μL无菌生理盐水中,100 ℃煮沸10 min;冰浴后12 000 r/min离心10 min;取上清液作为PCR模板。
1.4.2 16S rRNA和gyrB基因序列的PCR扩增与测序
16S rRNA和gyrB基因序列的PCR扩增方法参文献[14]的方法进行,利用生工生物工程(上海)有限公司的DNA快速纯化试剂盒进行PCR产物的回收纯化,纯化产物送上海生工测序。
1.4.3 16S rRNA和gyrB基因序列同源性分析
通过NCBI的BLAST检索系统对分离菌的16S rRNA基因和gyrB基因序列进行序列同源性分析,并使用Clusta1X 2.0软件与从GenBank数据库中获得的序列相似性较高的菌株的序列进行多序列比对,并对16S rRNA和gyrB基因采用MEGA 7软件构建系统发生树,采用邻接建树方法,并通过Bootstrap法(1 000次重复)检验。
1.5 毒力基因检测
为了进一步分析菌株LJ1的致病性,筛选了定居因子(cfa)、尿素酶(ureG、ureF、ureE、ureD)、Vi抗原(viaB)、外膜蛋白(ompX)共7个毒力相关基因。采用Primer Premier 5.0软件,根据弗氏柠檬酸杆菌全基因组序列(GenBank CP016762)设计特异性引物,引物见表1。

表1 PCR扩增产物引物
PCR反应体系共20 μL:2×PowerTaqPCR MasterMix(南京诺唯赞生物科技有限公司提供)10 μL,正反引物各0.5 μL(10 μmol/L),模板DNA 1 μL(29.81 ng/μL),无菌双蒸水8 μL;扩增条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃复性30 s,72 ℃延伸1 min,循环35次;最后72 ℃延伸7 min。扩增后的PCR产物用1.0%琼脂糖凝胶电泳。
2 结果与分析
2.1 分离菌致病性及LD50
供试菌株(LJ1)每组肌肉注射感染健康河蟹幼蟹10尾,供试幼蟹死亡情况见表2。感染后幼蟹表现出活力下降,行动迟缓,对外界刺激反应慢等症状,分离菌LJ1对中华绒螯蟹的LD50为2.1× l06CFU/mL。从人工感染后的病蟹体内再次分离到病原菌,经鉴定与原感染菌株在菌落形态、生理生化特性等方面均一致,试验结果表明分离菌LJ1为本次引起中华绒螯蟹大量死亡的病原菌,且具有较强的致病性。
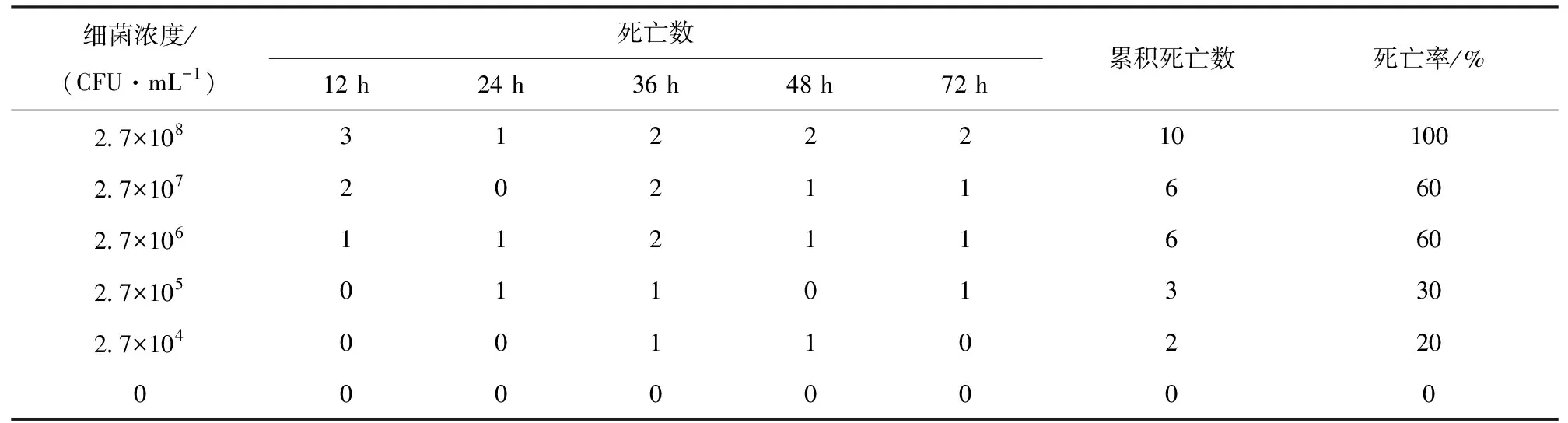
表2 分离菌LJ1对中华绒螯蟹的致病性(n=10)
2.2 分离菌表型特征
菌株LJ1在LB培养基上菌落特征为表面湿润光滑、中央隆起、边缘整齐的淡黄色菌落,培养24 h观察直径多在2 mm左右。革兰染色后观察,菌体为革兰阴性、短杆状、两端钝圆、无芽胞及荚膜,多呈散在分布,大小为0.5~0.8 μm×0.5~1.0 μm。菌株LJ1经透射电子显微镜观察显示,该细菌为周生鞭毛(图1)。其他理化特性见表3。综合分离菌株LJ1理化特性,与弗氏柠檬酸杆菌(Citrobacterfreundii)最接近。

图1 分离菌LJ1电镜下形态

表3 分离菌株的生理生化特性
2.3 16S rRNA和gyrB基因序列的系统发育树构建
分离菌LJ1所扩增的16S rRNA基因序列长度为1 408 bp(GenBank登录号:MK421413);所扩增的gyrB基因序列长度为1 168 bp(GenBank登录号:MK928323)。
将LJ1的16S rRNA基因序列进行同源性分析,结果表明与柠檬酸杆菌属细菌的相似性在99%以上。16S rRNA基因系统发育学分析显示,LJ1与弗氏柠檬酸杆菌(登录号为KR698931、MF254749、MF716687)聚为一分支,系统发育树如图2所示。gyrB基因同源性分析结果显示,LJ1与弗氏柠檬酸杆菌的同源性最高,且与弗氏柠檬酸杆菌(GenBank登录号为AY743920)的同源性在99%以上,结果如图3所示。

•本试验分离菌株

•本试验分离菌株
2.4 弗氏柠檬酸杆菌毒力基因检测
经PCR检测,菌株LJ1可以扩增出cfa、ureG、ureF、ureE、ureD、viaB和ompX等7个毒力相关基因(图4)。

M.DL2000 DNAmarker; 1.cfa(345 bp); 2.ureG(119 bp); 3.ureF(300 bp); 4.ureE(215 bp)、5.ureD(243 bp);6.viaB(516 bp);7.ompX(287 bp)
3 讨论
弗氏柠檬酸杆菌为革兰阴性菌,需氧或兼性厌氧,广泛分布于自然界,土壤、水体、食物都有其分布,此外在哺乳动物、鸟类、爬行动物和两栖动物等体内也可分离。人类可因弗氏柠檬酸杆菌感染而发生腹泻、食物中毒、脑膜炎、脑脓肿、败血症等。近年来,关于弗氏柠檬酸杆菌导致水产动物患病的报道不断增加,该菌可以导致罗非鱼、中华鳖、克氏原螯虾等患病,并造成大量死亡[15-16]。本研究对扬州市江都地区某养殖场患病的河蟹进行病原学研究,从濒死的河蟹肝胰腺、肌肉等病变组织分离大量优势生长细菌,并作纯化培养,通过理化特性和分子鉴定表明分离菌为弗氏柠檬酸杆菌。人工回感试验证实分离菌对健康梭子蟹具有较强的致病性, 而且从被感染死亡的河蟹体内可回收到单一的原感染菌,由此证实引发此次河蟹暴发性疾病的病原是弗氏柠檬酸杆菌。
弗氏柠檬酸杆菌是一种存在水环境中的条件致病菌,但由于养殖环境恶化,弗氏柠檬酸杆菌一旦侵入养殖动物体内,便大量生长繁殖,产生毒力因子,导致疾病的暴发。弗氏柠檬酸杆菌的毒力因子主要包括黏附素、肠毒素、内毒素等[17-18]。其中定居因子是弗氏柠檬酸杆菌重要的黏附素,已有研究表明,当病原菌感染宿主时,主要靠细菌自身定居因子抗原黏附于肠道细胞,经过定居、繁殖产生肠毒素而引发宿主死亡[19]。尿素酶也是弗氏柠檬酸杆菌另外一种重要的黏附素,通过尿素酶分解尿素,在菌体周围形成氨云以抵御酸性外环境对菌体的损伤,使该菌顺利在宿主体内黏附定殖下来[20-21]。外膜蛋白OmpX是肠杆菌科细菌的一种重要毒力因子,OmpX属于具有毒力特性的蛋白家族,有研究发现,OmpX参与细菌对细胞的黏附侵袭以及对抗宿主免疫防御的过程,在细菌的生长、运动、附着等方面有重要作用[22]。Vi抗原是细菌重要的毒力因子,有研究表明,该致病因子在宿主体内存活以及逃避宿主体内各种防御机制中起着广泛作用[23]。因此,本研究对分离鉴定的弗氏柠檬酸杆菌在致病过程中起着重要作用的毒力因子包括cfa、ureG、ureF、ureE、ureD、viaB和ompX进行检测,结果表明LJ1菌株携带上述这7个毒力相关基因,说明强致病性可能与这些毒力相关基因有关。本试验为后续开展河蟹相关疾病防控研究奠定了基础。

