猪轮状病毒NJ2012株VP8基因序列分析及原核表达
常新见,周金柱,范宝超,郭容利,朱琳,赵永祥,牛家强,何孔旺,李彬*
(1.江苏省农业科学院兽医研究所,江苏 南京 210014;2.西藏农牧学院动物科学学院,西藏 林芝 860000)
猪轮状病毒腹泻是由猪轮状病毒(porcine rotavirus)引起的一种以腹泻、厌食、呕吐、脱水为特征的急性传染病。该病多发于寒冷季节,呈地方性流行,各种年龄的猪皆可感染,感染率最高可达90%~100%[1-2]。疫苗接种是目前唯一的防控猪轮状病毒腹泻的方法,因此猪轮状病毒疫苗的研发具有非常重要的意义[3]。轮状病毒(rotavirus)属于呼肠孤病毒科轮状病毒属[4],基因组由11个不连续的双股RNA片段组成,编码6种结构蛋白(VPs)和6种非结构蛋白(NSPs),该病毒粒子由3层衣壳组成,最外层衣壳由VP7和纤突蛋白VP4组成[5-6]。轮状病毒的主要抗原蛋白VP4经胰蛋白酶作用后,可裂解为2条长度不等的肽段VP8*和VP5*,其中VP8*片段具有高度的同型特异性[7]。胰蛋白酶可将VP4切割形成VP8*和VP5*,提高轮状病毒的感染性[8]。尽管外衣壳蛋白VP4是重组轮状病毒疫苗开发的重要靶蛋白,可是完整的VP4蛋白的溶解性差,所以在过去几年科研人员将VP8蛋白作为候选蛋白进行了探索[9]。VP8蛋白具有VP4蛋白的主要抗原表位,且决定着VP4蛋白的特异性血清中和反应[10]。陈思静[11]发现VP8*蛋白可诱导病毒中和抗体和小鼠相关保护,细菌表达的VP8*蛋白可诱导高水平的病毒中和抗体,具有可观的疫苗潜力。目前已经上市的轮状病毒疫苗均为减毒活疫苗,有较高的肠套叠风险,所以研究更加安全有效的轮状病毒亚单位疫苗具有重要意义[12]。Dunn等[13]所做小鼠模型的结果表明,VP4、VP8*和VP5*均能刺激小鼠产生中和抗体。本实验室前期对猪轮状病毒开展流行病学调查,发现G9P7型已经成为临床优势基因型[14]。因此,本文对实验室分离到的G9P7型毒株NJ2012的VP8基因进行了克隆,并在原核系统中进行融合蛋白的重组表达,为进一步研究VP8蛋白的结构功能及开发新型轮状病毒疫苗、诊断试剂和治疗药物奠定基础。
1 材料与方法
1.1 材料
G9P7型猪轮状病毒毒株NJ2012,由江苏省农业科学院兽医研究所人兽共患病防控研究室分离保存。PrimeScript RT reagent Kit、NdeⅠ、BamHⅠ均购自大连宝生物技术有限公司;Trans5α感受态细胞购自TransGen Biotech;DE3感受态细胞购自康为世纪有限公司;pET28a表达载体(卡那霉素抗性)由本实验室保存;HRP标记的羊抗鼠单抗购自Abclonal;抗His-tag鼠单克隆抗体购自Abclonal公司;脱脂奶粉购自伊利;BSA蛋白定量检测试剂盒购自碧云天公司;PVDF膜购自Sigma公司。
1.2 引物设计及PCR扩增
根据NJ2012基因组序列,利用Primer 5.0软件设计引物并将交由南京擎科生物科技有限公司合成。引物序列如下,上游: 5′-GATCCATATGTTATTAGATGGTCCATACC-3′,下游: 5′-CGCGGATCCTATCATCCATGATTGATATACTCAG-3′,并在序列两端分别引入NdeⅠ和BamHⅠ酶切位点。使用Magen公司的RNA提取试剂盒提取NJ2012病毒全基因组并反转录成cDNA。PCR扩增反应参数如下:95 ℃预变性5 min;95 ℃变性30 s,54 ℃退火45 s,72 ℃延伸10 min,共35个循环。1%琼脂糖凝胶电泳检测PCR产物。
1.3 VP8序列同源性分析
选取10株来自不同宿主、常用作疫苗株的轮状病毒的VP8序列作为参考序列(表1),应用软件DNAStar MegAlign中的Clustalw Method与DNAman中的Mulitiple Alignment进行核苷酸序列与氨基酸序列的同源性比对分析。

表1 参考毒株信息
1.4 目的基因原核表达载体的构建
将PCR产物连接到pMD19-T载体,使用热转化方法将重组质粒转化到Trans5α感受态细胞,随后,提取质粒,对其进行PCR和质粒双酶切鉴定,分别收取PCR产物和质粒双酶切产物使用1%琼脂糖凝胶电泳进行检测,将鉴定为阳性的重组质粒命名为pMD19T-VP8,送至南京思普金生物科技有限公司进行测序鉴定。将测序正确的pMD19T-VP8质粒与表达载体共同使用NdeⅠ和BamHⅠ内切酶进行双酶切处理,进行胶回收。将回收的目的基因与表达载体pET28a(+)进行连接,使用热转化方法将连接产物转化到大肠杆菌Trans5α感受态细胞中,提取重组质粒,对其进行PCR和质粒双酶切鉴定,将PCR产物和质粒双酶切产物使用1%琼脂糖凝胶电泳进行检测,将鉴定为阳性的重组质粒命名为pET28a-VP8。
1.5 重组VP8蛋白的诱导表达与纯化
将鉴定成功的阳性重组菌接种于含卡那霉素的LB培养基,每管3 mL,在37 ℃摇床振荡培养,每隔1 h检测菌液的OD600值,当菌液OD600值为0.6~0.8时加入IPTG终浓度为5 mmol/L,37 ℃摇床振荡培养6 h。随后,分别从2个试管中吸取1 mL菌液,4 ℃,12 000 r/min离心3 min,收取沉淀,同时以诱导的空载体全菌作为对照,SDS-PAGE检测重组VP8蛋白是否成功表达。按照1∶100的比例将成功表达纯化培养的菌液接种于100 mL含有卡那霉素抗性的LB液体培养基中,在37 ℃的条件下摇床振荡培养,当菌液OD600值为0.6~0.8时,终浓度为5 mmol/L的IPTG诱导重组蛋白表达,37 ℃摇床低温振荡诱导6 h后收集菌液。将诱导后的菌液8 000 r/min离心30 min,弃上清,用PBS(不含尿素)重悬于冰浴中进行超声破碎(功率:40%,60 min),将超声破碎的菌液4 ℃、8 000 r/min离心30 min,分离上清和沉淀,收取获得沉淀使用2 mol/L尿素吹悬并重悬于冰浴中进行超声破碎(功率:40%,10 min);分别按照4、6和8 mol/L增加溶液尿素含量至最终完全溶解且呈透亮状态,之后离心,收集上清,将获得的溶液放入透析袋中,依次使用6、4、2、1 和0.5 mol/L尿素溶液和1×PBS溶液在4 ℃条件下对其进行透析,每次4 h。将获得的蛋白溶液使用PEG-8000进行浓缩处理即可获得纯化蛋白,使蛋白浓度为1 mg/mL。
1.6 重组VP8蛋白Western blot检测
将经SDS-PAGE检测的蛋白在115 mA的电流下转膜45 min使其转印到PVDF膜上,使用1×PBST清洗3次,每次10 min;使用5%脱脂乳溶液室温封闭2 h,封闭后使用1×PBST清洗3次,每次10 min;抗His-tag鼠单克隆抗体(1∶4 000)作为一抗,室温孵育1 h,孵育后使用1×PBST清洗3次,每次10 min;羊抗鼠HRP-IgG(1∶4 000)作为二抗,孵育1 h,孵育后使用1×PBST清洗3次,每次10 min;在PVDF膜上加入ECL显色液,使用化学发光成像仪拍照。
2 结果与分析
2.1 VP8序列同源性分析
测序结果表明,从NJ2012毒株克隆的VP8基因片段长为480 bp,编码氨基酸160 aa,该序列与参考毒株序列的核苷酸同源性为53.9%~99.2%,氨基酸同源性为42.1%~97.5%,如表2所示。

表2 NJ2012与参考毒株的VP8序列同源性分析 %
2.2 VP8基因PCR扩增
PCR扩增后,产物电泳结果显示(图1),扩增出约480 bp的片段,与VP8基因预期大小一致。
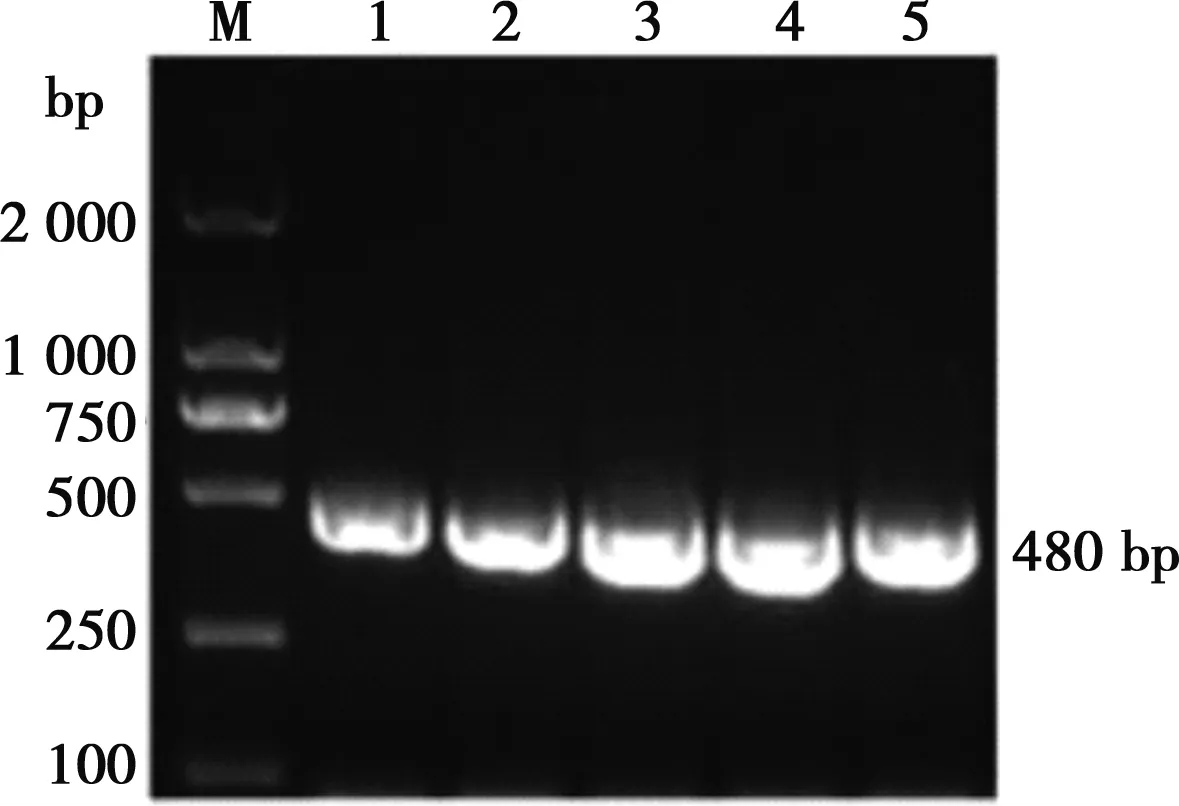
M.DL2000 DNA Marker;1~5.VP8基因
2.3 重组表达质粒双酶切鉴定
对重组质粒进行双酶切鉴定,如图2所示。基因片段大小与预期相符,阳性质粒测序结果与NJ2012-VP8基因测序结果进行比对,两者序列完全一致,表明重组表达质粒构建成功。
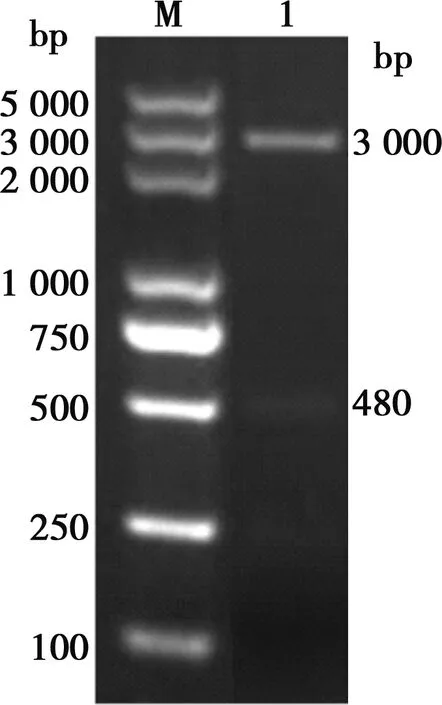
M.DL5000 DNA Marker;1.重组pET28a-VP8质粒双酶切产物
2.4 重组蛋白SDS-PAGE检测
重组表达菌DE3(pET28a-VP8)由IPTG诱导表达经SDS-PAGE检测,如图3所示,裂解菌体和包涵体在17~25 kDa处出现了1条清晰的条带,约为20 kDa,与目的蛋白大小相符。
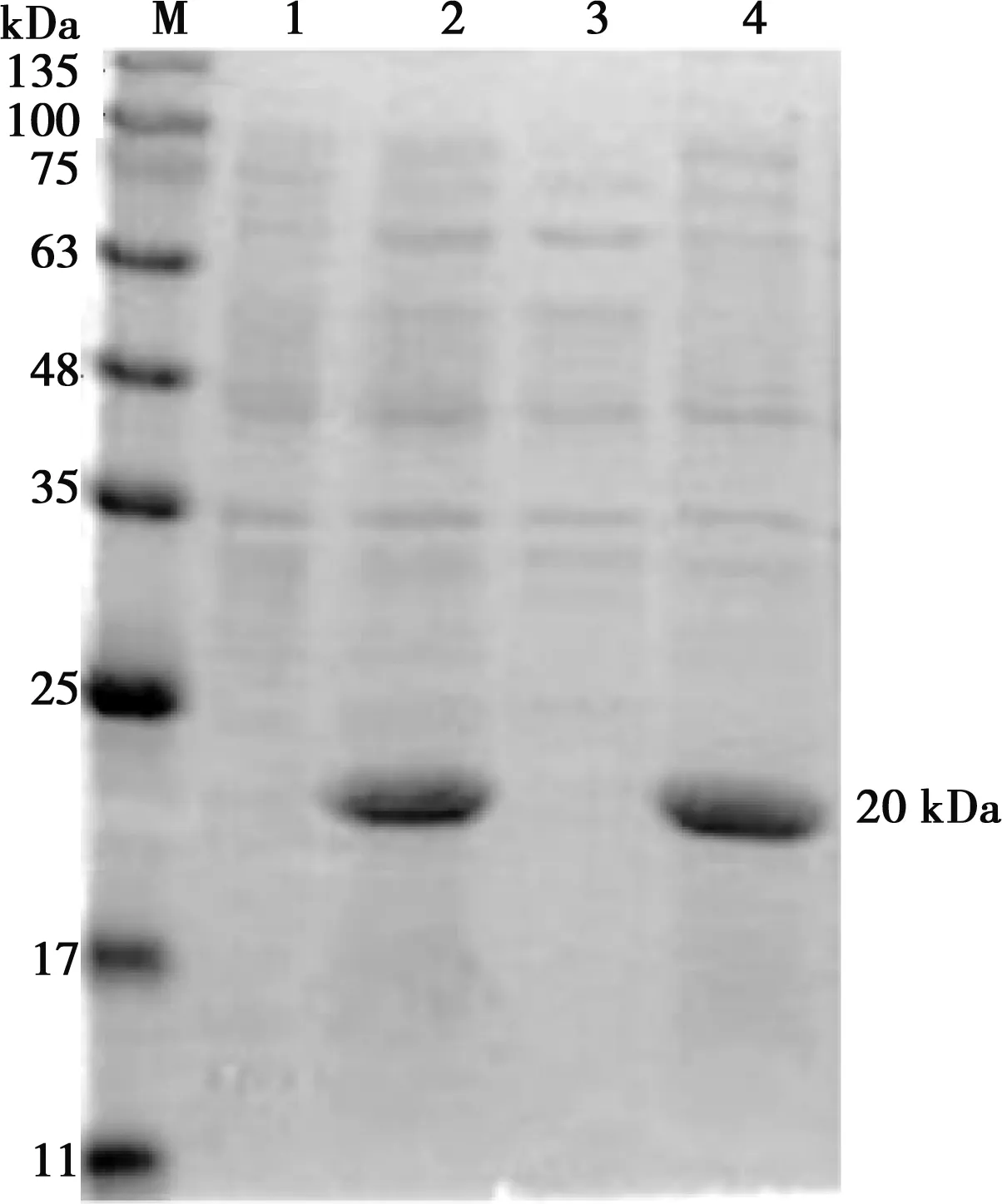
M.蛋白Marker;1.pET28a诱导后;2.pET28a-VP8诱导后全菌;3.pET28a-VP8诱导后上清;4.pET28a-VP8诱导后包涵体
2.5 重组VP8蛋白Western blot检测
Western blot检测表明重组VP8蛋白能够与抗His-Tag鼠单克隆抗体发生结合反应,如图4所示,进一步证实了VP8蛋白在DE3宿主菌得到表达。
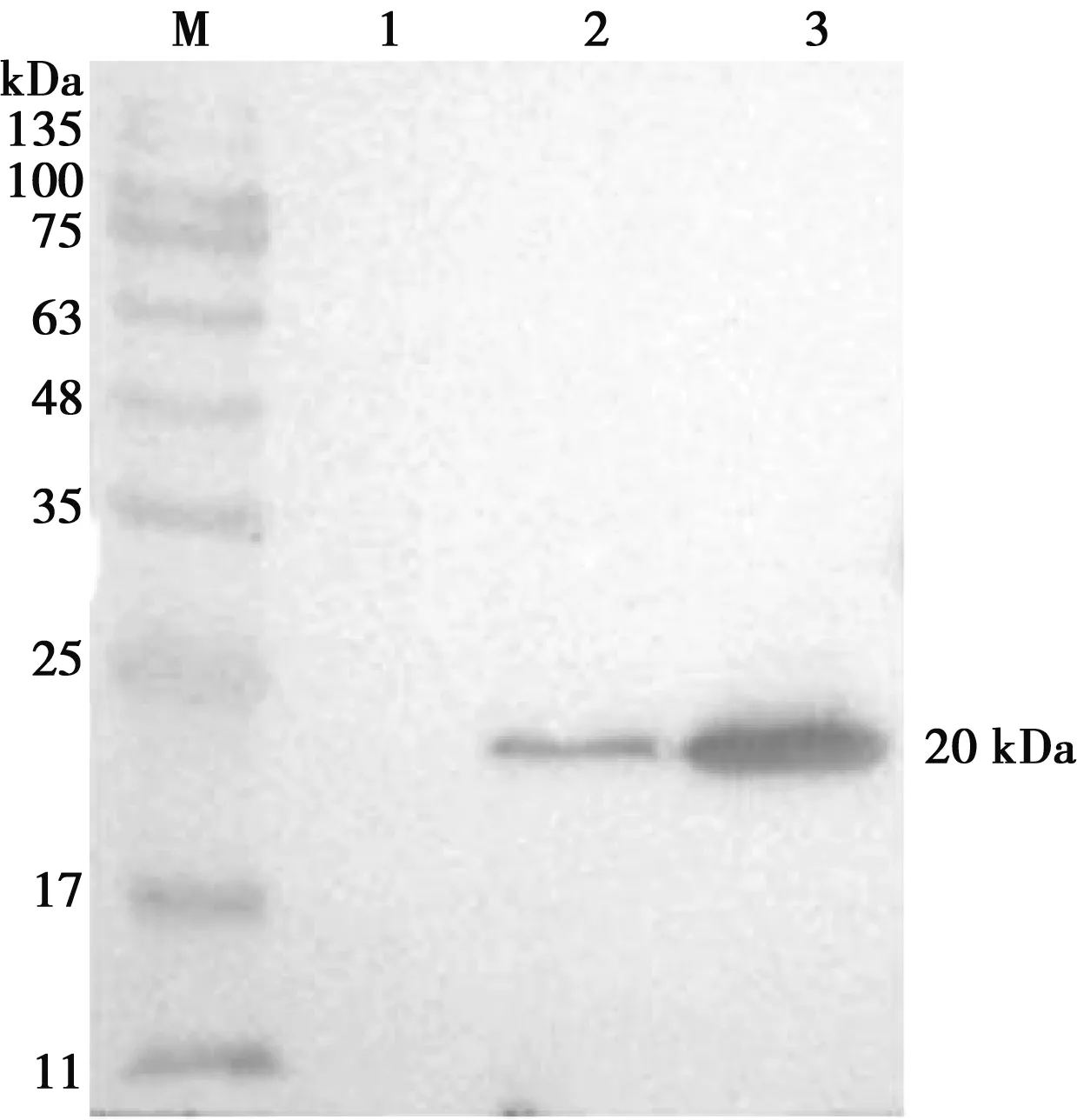
M.蛋白Marker;1.诱导pET28a;2.未诱导pET28a-VP8;3.诱导pET28a-VP8
2.6 重组VP8蛋白纯化后鉴定
包涵体中有大量重组VP8蛋白存在,经尿素溶解,SDS-PAGE检测可知重组蛋白存在于8 mol/L尿素中(如图5A);经Western blot鉴定,在17~25 kDa处出现1条清晰条带(如图5B),与目的蛋白大小一致。
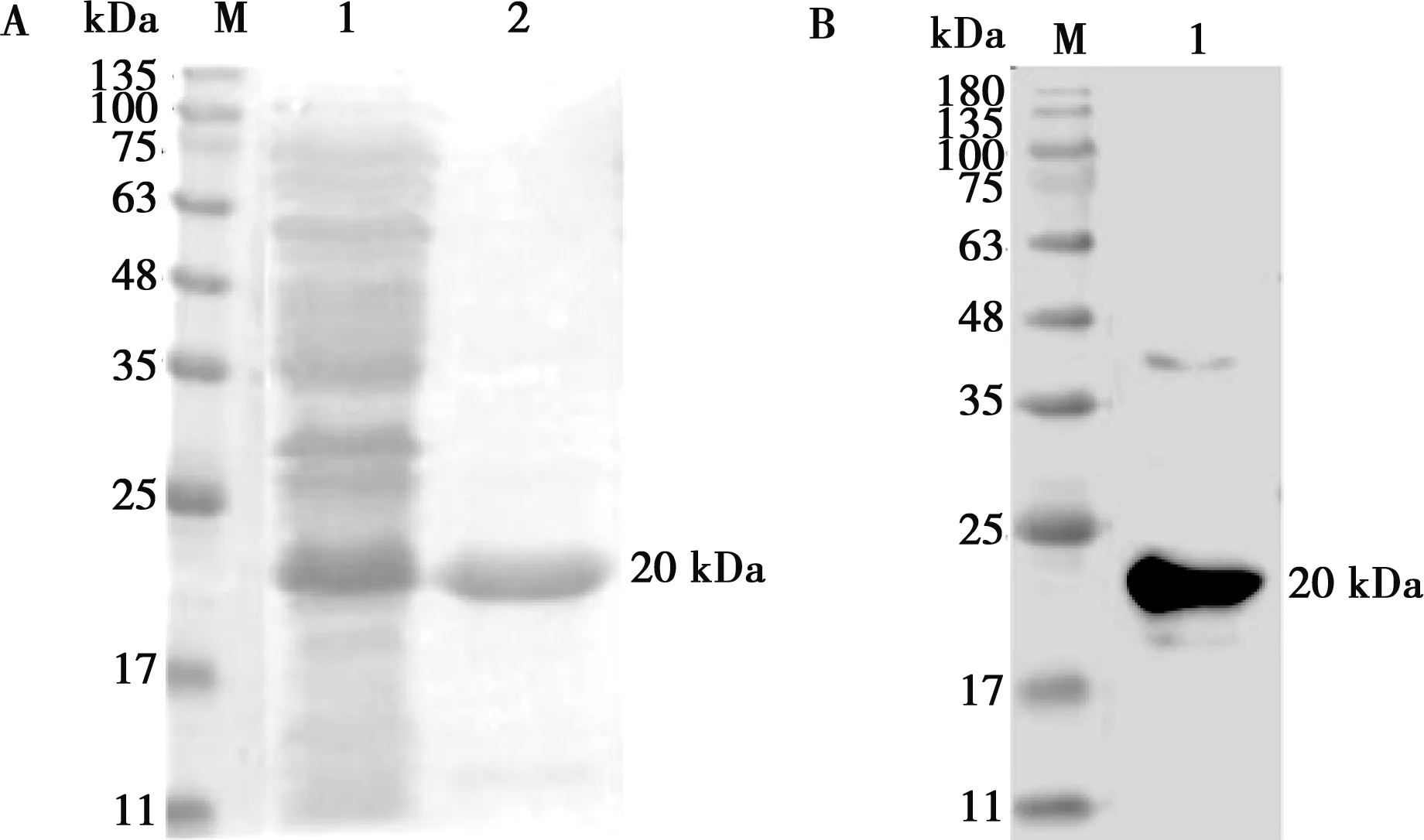
A.重组VP8蛋白纯化后SDS-PAGE检测结果:M.蛋白Marker;1.未纯化VP8蛋白;2.纯化后VP8蛋白
3 讨论
研究表明,猪轮状病毒NJ2012毒株的VP8基因片段大小为480 bp,编码160 aa,与参考毒株的核苷酸序列同源性为53.9%~99.2%,氨基酸序列同源性为42.1%~97.5%。为了提高VP8重组蛋白的表达量,本研究在试验过程中对表达条件进行了优化,结果表明,在37 ℃、IPTG终浓度为5 mmol/L、诱导时间为6 h的条件下VP8蛋白得到最大程度表达。该包涵体在含8 mol/L尿素溶液中可完全溶解,利用尿素梯度透析使其复性,获得的重组蛋白经 SDS-PAGE 鉴定纯度大,蛋白浓度测定为1 mg/mL。毕艳铎等[15]利用原核表达系统所表达的猪轮状病毒VP8*(64~223 aa)具有良好的免疫原性,且产量高可溶,具有极大的商品化潜力。魏晓曼等[16]通过对Gottfried和SB-1A株猪轮状病毒截短VP8*蛋白的免疫原性分析,免疫小鼠后发现蛋白具有较好的免疫原性。本研究获得VP8蛋白存在于包涵体中,蛋白不可溶,考虑到后期蛋白免疫原性及操作简便性,应重新考虑更换表达载体及优化密码子。
本研究室前期经流行病调查发现G9P7型已成为优势基因型,同时本室分离获得的毒株为G9P7型,同类型的毒株相似报道较少。闻晓波等[17]在大肠杆菌中表达轮状病毒株Wa的P8、DS-1的P4和1076的P6,其产量高且高度可溶性,于豚鼠肌内免疫VP8*蛋白(即P8、P4或P6)可产生高水平的中和抗体。2012年,Wen等[18]进一步研究发现,在仅融合6个组氨酸的情况下,VP8核心区也能以可溶形式高效表达,该蛋白在豚鼠模型中可产生高滴度的中和抗体。将VP8蛋白与GST融合表达则可以获得可溶性的VP8蛋白,免疫鸡后可产生高滴度的卵黄抗体[19]。完整的VP8蛋白在大肠杆菌中也以包涵体的形式表达,但其刺激小鼠产生中和抗体的能力与真核表达的VP8蛋白无显著差异,免疫牛和家兔也能产生高滴度的中和抗体[20]。这提示轮状病毒的VP8蛋白是一个重要潜在亚单位疫苗的候选蛋白,需要进一步进行免疫原性的研究。鉴于不同型毒株之间的抗原免疫交叉保护较差,VP8蛋白能否针对临床的毒株产生保护性,需要更为深入的探索。

