重组减毒沙门菌对乳腺癌细胞的抑制作用
蓝肇煜,王小月,李丹,武静桥,范真玮,姚景丽,赵微,何敬文,陈婷,金天明
(天津农学院动物科学与动物医学学院,天津 300384)
起源于乳腺上皮组织的恶性肿瘤称为乳腺癌(breast cancer)。乳腺肿瘤是雌性动物中最常见的肿瘤,特别是小动物的重要临床疾病之一[1]。犬是乳腺肿瘤发病率最高的动物,未绝育的母犬发病率高达71%[2]。采用常规肿瘤治疗方法后,高风险乳腺癌病畜仍会死于肿瘤复发和转移。因此,寻找合适的载体和治疗药物将会极大改善乳腺癌对雌性动物的伤害。
研究显示,实体瘤有一个显著特性,即伴随着肿瘤的快速生长,导致供氧不足,在其内部会出现低氧区(氧含量为1%,正常组织中为3%~15%)。肿瘤低氧区的存在形成了天然的厌氧环境,又由于肿瘤内部的免疫抑制作用,坏死区中细胞裂解产生的营养物质,以及新生血管破裂等原因,为兼性或厌氧菌生长提供了有利环境,使有些厌氧菌或兼性厌氧菌可以靶向肿瘤,并在肿瘤中生长,这一发现预示着某些厌氧菌或兼性厌氧菌有望成为携带抗肿瘤药物的载体,这其中尤以沙门菌为典型代表[3]。减毒菌株鼠伤寒沙门菌LH430(phoP/phoQ基因缺失)在敲除了鼠伤寒沙门菌的phoP/phoQ基因后,菌株毒力与亲本菌株相比大为降低,但仍保留了亲本菌株的侵袭力,是适宜的疫苗及载体候选菌株[4]。
肿瘤靶向肽精氨酸-甘氨酸-天冬氨酸(RGD)是细胞能够识别的最小的蛋白质一级结构上所特有的结构单位,可有效识别肿瘤血管整合素αvβ3[5]。由于乳腺癌细胞表面存在整合素αvβ3,RGD能够高度靶向乳腺癌细胞,进而抑制乳腺癌细胞的增殖和侵袭。
细胞穿膜肽(CPPs)又称蛋白质转导结构域(PTDs),是一组不超过35个氨基酸残基,可有效地内化细胞,携带偶联药物进入细胞的小肽,且不引起细胞毒性反应。TAT是一种11聚体的细胞穿膜肽,来源于人类免疫缺陷病毒1型(HIV-1)编码的转录反式激活蛋白,是保持细胞穿膜能力的最小蛋白,也是自发现细胞穿膜肽以来研究和使用最广泛的肽。
白树毒素(gelonin,简称GEL)是一种Ⅰ型核糖体失活蛋白(RIPs),单链核糖体失活蛋白,具有RNA N-糖苷酶活性,可专一性水解真核细胞核糖体28S rRNA中第4 324位腺苷酸的N-C键,释放1个腺嘌呤(A)使核糖体失活,从而抑制蛋白质生物合成,导致细胞死亡[6-7]。同时,GEL又具有类 DNase 活性,可使细胞核中 DNA降解[8]。
本研究选择GEL基因作为乳腺癌的治疗基因,同时利用LH430和RGD对肿瘤细胞的双靶向作用及TAT细胞穿透作用,构建了携带RGD-TAT-GEL三基因的减毒沙门菌,增强GEL基因的穿透细胞能力,使其更高效地杀伤肿瘤细胞。同时,借助双靶向作用,可进一步降低GEL基因对正常细胞的损伤,从而实现靶向抑瘤的目的。
1 材料与方法
1.1 主要材料
沙门菌LH430由吉林大学基础兽医学实验室惠赠;乳腺癌细胞MDA-MB-231由天津师范大学朱长军教师惠赠;含质粒pMD-RGD-TAT-GEL、pMD-TAT-GEL和pMD-RGD-GEL的重组大肠杆菌由上海捷瑞生物工程有限公司合成;HEK-293细胞和pEGFP-N1质粒由本实验室保存。
TRIzol Reagent购自北京天恩泽基因科技有限公司;SanPrep柱式质粒DNA小提试剂盒、SanPrep 柱式 DNA胶回收试剂盒均购自生工生物工程(上海)公司;限制性内切酶、T4 DNA连接酶购自Thermo Scientific公司。
1.2 引物设计
根据GenBank 中 RGD 基因序列(1FUL_A)、TAT基因序列(ADK70247.1)第47-57氨基酸序列(YGRKKRRQRRR)和GEL基因序列(AAB47013.1)设计RGD-TAT-GEL基因引物;根据RGD基因序列(1FUL_A)和GEL基因序列(AAB47013.1)设计RGD-GEL基因引物;根据TAT基因序列(ADK70247.1)第47-57氨基酸序列(YGRKKRRQRRR)和GEL基因序列(AAB47013.1)设计TAT-GEL基因引物,所有引物均由上海捷瑞生物工程有限公司合成(表1)。
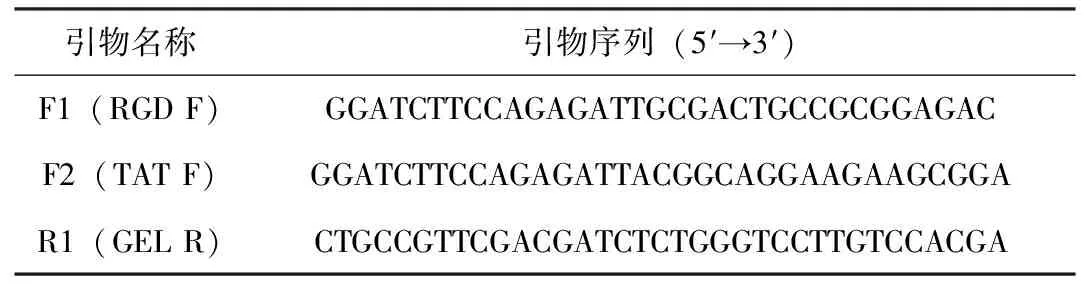
表1 引物信息
1.3 pEGFP-RGD-TAT-GEL、pEGFP-RGD-GEL、pEGFP-TAT-GEL质粒制备与鉴定
根据试剂盒说明书提取大肠杆菌中的pMD-RGD-TAT-GEL、pMD-TAT-GEL、pMD-RGD-GEL和pMD-GEL重组质粒,用限制性内切酶EcoRⅠ/BamHⅠ分别进行双酶切。回收RGD-TAT-GEL基因、RGD-GEL基因、TAT-GEL基因和真核表达载体pEGFP-N1双酶切产物。采用T4连接酶将回收的目的基因与载体16 ℃连接过夜,并测序。
1.4 重组沙门菌的构建
将减毒沙门菌LH430转化为感受态细胞,按照文献[9]方法将质粒pEGFP-RGD-TAT-GEL、pEGFP-RGD-GEL、pEGFP-TAT-GEL和pEGFP-N1分别转化至LH430感受态细胞,通过卡那霉素抗性培养基筛选出阳性菌株,利用引物F1/R1对RGD-TAT-GEL基因和RGD-GEL基因进行PCR鉴定,引物F2/R1对TAF-GEL基因进行PCR鉴定,阳性重组菌分别命名为 LH430/pEGFP-RGD-TAT-GEL、LH430/pEGFP-RGD-GEL和LH430/pEGFP-TAT-GEL,-80 ℃保存备用。
1.5 重组减毒沙门菌侵染MDA-MB-231细胞及外源基因检测
将MDA-MB-231细胞分为5组,每组3孔,每孔1×105个细胞加入6孔板中,并加入2 mL含10% FBS的DMEM完全培养液。待细胞融合度至70%~80%时,PBS洗涤2次,用无血清无抗DMEM培养液培养2 h,每组分别加入50 μL(1×106CFU/mL)LH430/pEGFP-RGD-TAT-GEL、LH430/pEGFP-RGD-GEL、LH430/pEGFP-TAT-GEL 和LH430/pEGFP,置于 5% CO2培养箱,37 ℃孵育3 h,PBS洗涤2次,每孔加入10% FBS的DMEM完全培养液2 mL,于37 ℃培养箱孵育3 h后,换为无血清无抗DEME培养液,培养6~48 h后,利用荧光显微镜观察绿色荧光蛋白表达情况。采用 TRIzol法从侵染 48 h后的MDA-MB-231细胞中提取细胞总 RNA,利用逆转录试剂盒获得cDNA后,以其为模板,分别以 F1/R1、F2/R1为引物,PCR 检测目的基因。反应程序:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,73 ℃ 1 min,35 个循环;73 ℃ 15 min。
1.6 CCK-8法检测重组沙门菌对细胞增殖的影响
将MDA-MB-231细胞、HEK-293细胞各分5组,分别重悬于含10% FBS的DMEM和MEM完全培养液中,调整细胞浓度至5×104个/mL,于96孔板中加入100 μL细胞悬液,37 ℃培养箱培养,待细胞融合度至60%时,换为无血清无抗DMEM培养基,每组加入LH430/pEGFP-RGD-TAT-GEL、LH430/pEGFP-RGD-GEL、LH430/pEGFP-TAT-GEL 和LH430/pEGFP各10 μL,每个重组菌用无血清无抗培养液依次稀释1×108、1×107、1×106、1×105、1×104CFU/μL,置于CO2培养箱中培养24、48和72 h。到达检测时间时,于每孔加入10 μL的CCK-8溶液,在37 ℃孵育1 h,用酶标仪在450 nm波长处检测光吸收值。
使用GraphPad Prism软件绘制抑制率图表,通过SPSS软件用One-way ANOVA方法计算抑制率和标准差,利用SPSS软件中的Probit分析CCK-8结果计算出半数抑制浓度(IC50)值并用One-way ANOVA方法计算其标准差。抑制率计算方法:各重复孔的OD值取“均数±标准差”,用1-(OD值-空白OD值)/(阴性对照孔OD值-空白OD值)×100%获得各种药物的抑制率。
2 结果与分析
2.1 pEGFP-RGD-TAT-GEL、pEGFP-RGD-GEL、pEGFP-TAT-GEL质粒的鉴定
将提取后的pMD-RGD-TAT-GEL、pMD-TAT-GEL、pMD-RGD-GEL和pMD-GEL重组质粒用限制性内切酶EcoRⅠ/BamHⅠ进行双酶切。将胶回收的基因片段经T4连接酶连接后,测序结果与预期相符,表明上述重组质粒构建成功。
2.2 构建重组沙门菌的鉴定
将含质粒pEGFP-RGD-TAT-GEL、pEGFP-RGD-GEL、pEGFP-TAT-GEL的重组减毒沙门菌,进行PCR鉴定,获得857、824和830 bp的预期目的片段(图1),表明成功构建重组减毒沙门菌。
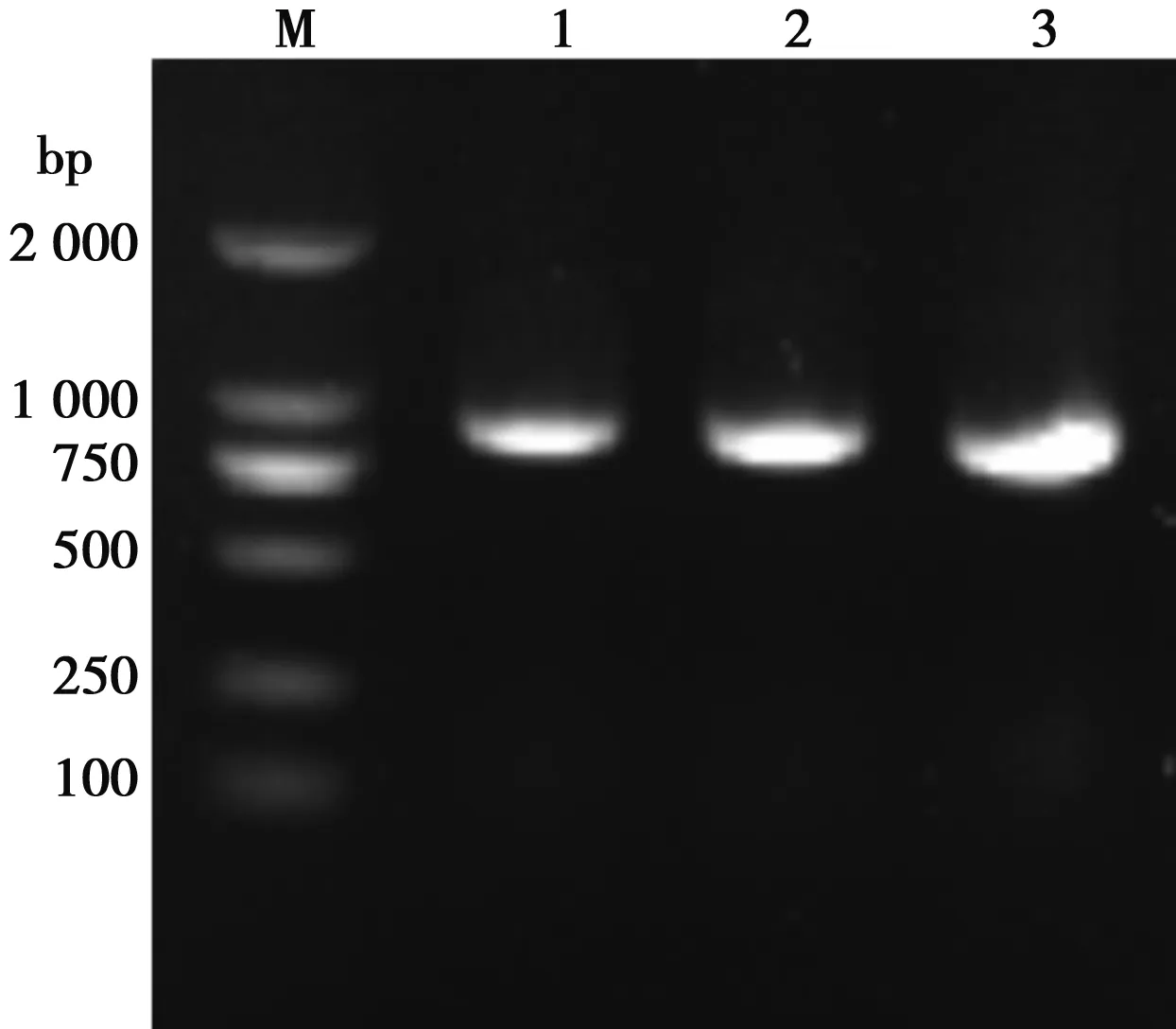
M.250 bp-Ⅰ DNA ladder;1.LH430/pEGFP-RGD-TAT-GEL(857 bp);2.LH430/pEGFP-TAT-GEL(830 bp);3.LH430/pEGFP-RGD-GEL(824 bp)
2.3 重组减毒沙门菌侵染MDA-MB-231细胞检测
重组减毒沙门菌LH430/pEGFP-RGD-TAT-GEL、LH430/pEGFP-RGD-GEL和LH430/pEGFP-TAT-GEL侵染MDA-MB-231细胞24、48和72 h后,荧光显微镜下观察到绿色荧光(图2)。经LH430/pEGFP-RGD-TAT-GEL侵染的细胞表达绿色荧光最明显。

a.LH430/pEGFP-RGD-TAT-GEL; b.LH430/pEGFP-TAT-GEL; c.LH430/pEGFP-RGD-GEL; d.LH430/pEGFP-N1
2.4 RT-PCR检测目的基因
PCR检测重组减毒沙门菌LH430/pEGFP-RGD-TAT-GEL、LH430/pEGFP-RGD-GEL、LH430/pEGFP-TAT-GEL中的RGD-TAT-GEL、RGD-GEL 和TAT-GEL基因,在857、824和830 bp处获得目的片段(图3),表明重组菌在MDA-MB-231细胞中成功表达RGD-TAT-GEL、RGD-GEL 和TAT-GEL基因。
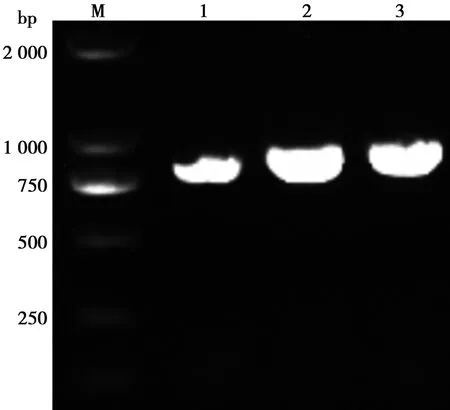
M.250 bp-Ⅰ DNA ladder; 1.RGD-GEL(824 bp); 2.TAT-GEL(830 bp); 3.RGD-TAT-GEL(857 bp)
2.5 CCK-8法检测重组沙门菌对细胞增殖的影响
2.5.1 不同时间浓度重组菌对MDA-MB-231细胞的抑制效果
重组减毒沙门菌对MDA-MB-231细胞的抑制力随剂量增加而增强,但没有出现时间和剂量的依赖性,LH430/pEGFP-RGD-TAT-GEL组48 h时抑制率为68%,显著高于其他组(P<0.05)(图4)。
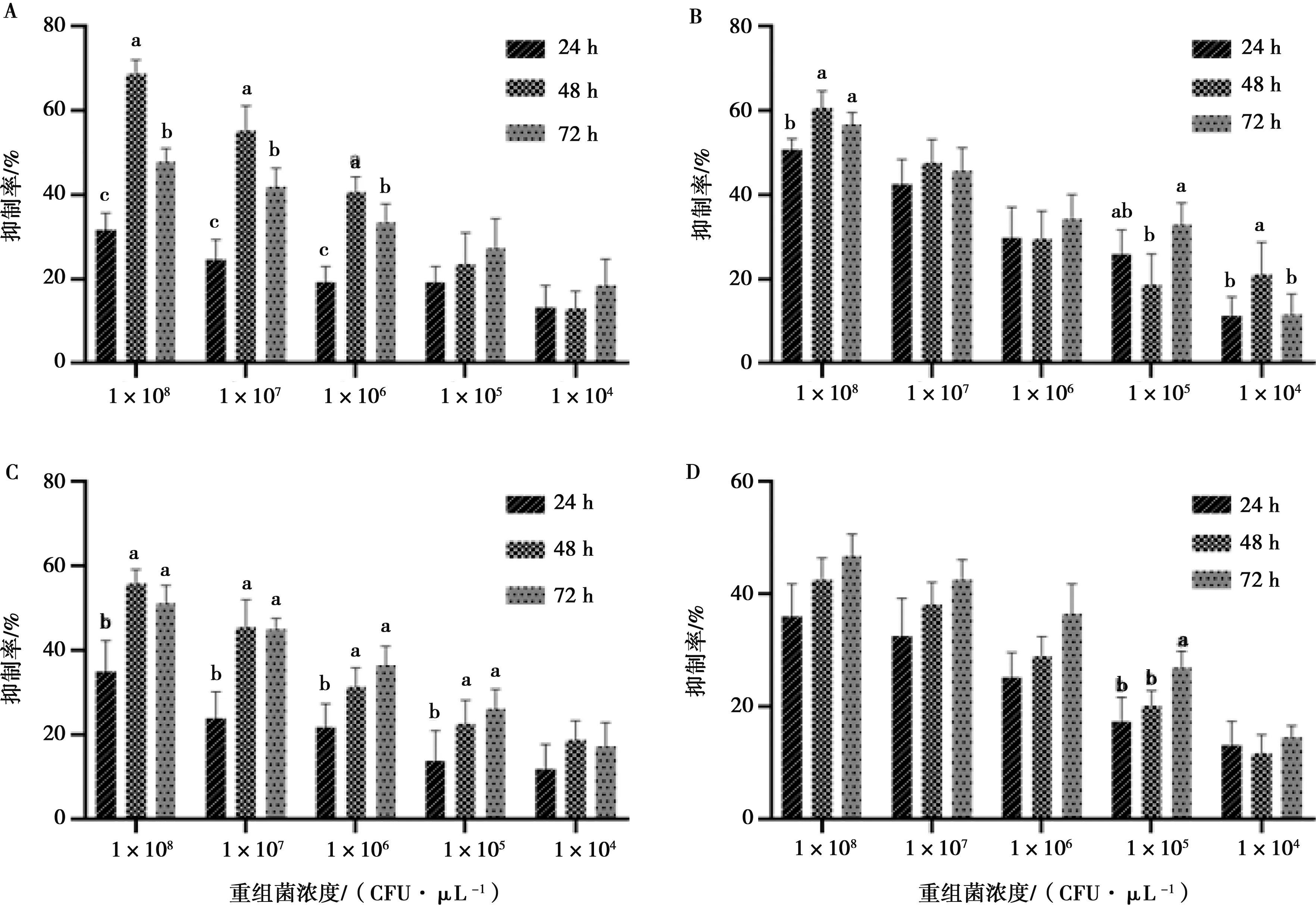
A.LH430/pEGFP-RGD-TAT-GEL;B.LH430/pEGFP-RGD-GEL;C.LH430/pEGFP-TAT-GEL;D.LH430/pEGFP-N1;同一处理组间比较,不同字母表示差异显著(P<0.05),相同字母或无字母表示差异不显著(P>0.05)。下同
2.5.2 不同时间浓度重组菌对HEK-293细胞的抑制效果
重组减毒沙门菌对HEK-293细胞的抑制力普遍较低,明显低于对MDA-MB-231细胞的抑制力,且没有出现时间和剂量的依赖性(图5)。说明重组菌对肿瘤细胞靶向性较好,对正常细胞损伤较小。
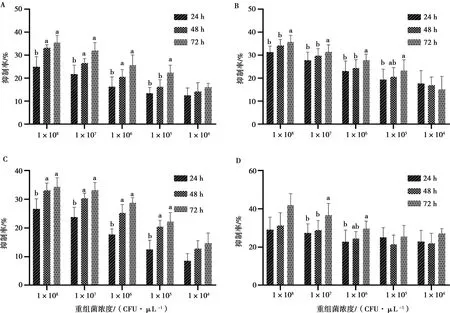
A.LH430/pEGFP-RGD-TAT-GEL;B.LH430/pEGFP-RGD-GEL;C.LH430/pEGFP-TAT-GEL;D.LH430/pEGFP-N1
2.6 各组重组菌对肿瘤细胞及正常细胞的IC50值
将CCK-8数据进行分析并计算各重组菌对MDA-MB-231细胞和HEK-293细胞的IC50值。结果显示LH430/pEGFP-RGD-TAT-GEL组对MDA-MB-231细胞的IC50值最低,为(4.643±0.514)×107CFU/μL,对HEK-293细胞的IC50值最高,为(2.376±0.260)×109CFU/μL,说明其抑瘤效果最佳,且对正常细胞损伤较小(图6)。
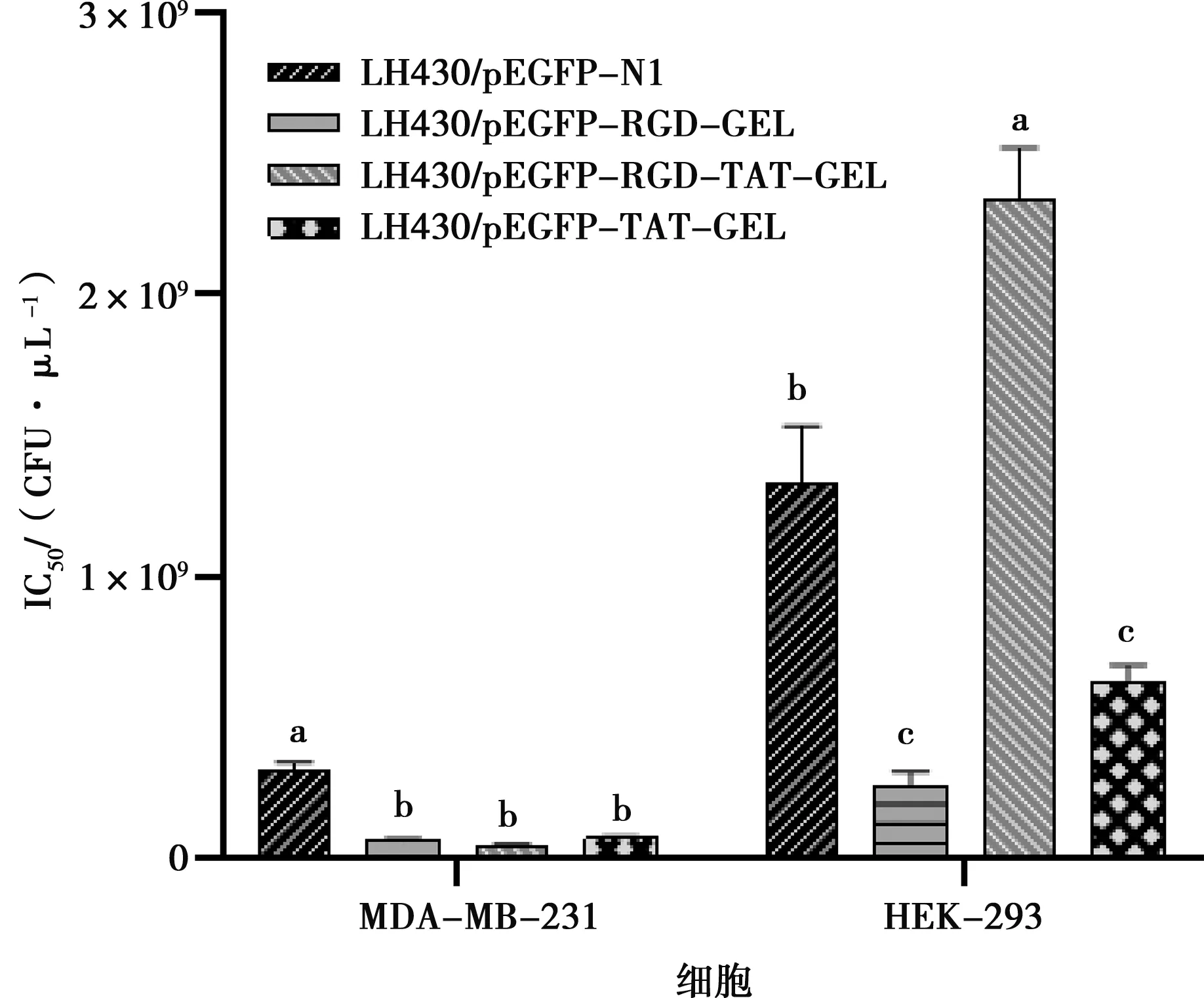
图6 各重组菌对MDA-MB-231细胞和HEK-293细胞的IC50值分析结果
3 讨论
目前,癌症治疗的主要障碍是药物的低效力,因此,人们更多地利用蛋白质或基因开展肿瘤治疗研究,然而,这些大分子却不能穿透细胞膜[10]。研究表明,PTDs是将生物活性大分子传递到完整细胞中最有效的工具,能够将小分子药物、大分子甚至纳米颗粒送入所有类型的细胞中,其转导机制强于其他内化途径[11]。Shin等[12]的研究表明,经穿膜肽TAT修饰后,GEL基因的表达效率与GEL单基因相比提高了177倍,但因缺乏肿瘤特异性,故需其他靶向修饰。Low等[13]和Robert[14]改造出VNP20009和A1-R等拥有抑瘤能力的菌株,由于安全性原因,改造菌的抑瘤效果并不显著,因此,寻找有效的靶向基因和治疗基因显得尤为重要。进一步研究显示,鼠伤寒沙门菌是众多治疗肿瘤细菌中的理想候选[15]。Ham等[16]将穿膜肽F3与GEL基因构建成嵌合肽,对HeLa、LnCaP、9L和U87 MG癌细胞进行靶向性试验,结果显示,在所测癌细胞中观察到F3-GEL表达量都较高,杀伤作用较强,说明GEL基因杀伤力极强,在穿膜肽的协同作用下,可高效率消灭肿瘤细胞。
本研究首次构建出能够高效稳定表达外源基因的重组减毒沙门菌LH430/pEGFP-RGD-TAT-GEL、LH430/pEGFP-RGD-GEL、LH430/pEGFP-TAT-GEL、LH430/pEGFP-GEL和LH430/pEGFP。CCK-8试验结果显示,重组沙门菌没有出现对时间和剂量的依赖性,对于MDA-MB-231细胞,LH430/pEGFP-RGD-TAT-GEL 组48h时抑制效果最佳,IC50值最低。对于HEK-293细胞,各重组沙门菌均显示出较低的杀伤力,且LH430/pEGFP-RGD-TAT-GEL 组的IC50值最高,说明对肿瘤细胞具有更高的靶向性。
本研究结果中,LH430/pEGFP-N1组对肿瘤细胞同样有杀伤作用,其原因为一方面细菌可以通过其自身的毒力物质,如内毒素和侵袭素等诱导宿主细胞凋亡;另一方面宿主细胞经刺激后可产生如肿瘤坏死因子、白细胞介素、凋亡蛋白等作用于自身并引起凋亡[17]。由于减毒沙门菌 LH430 本身便具有抑制肿瘤生长的能力,因此,亦可诱导细胞凋亡。同时因本研究采用重组减毒沙门菌治疗,在侵入肿瘤组织后能够诱导机体产生细胞免疫和体液免疫反应,使免疫细胞集中于肿瘤组织,从而促进肿瘤细胞的凋亡,与Felgner等[15]的结论一致。
本试验的研究结果证明,重组减毒沙门菌LH430/pEGFP-RGD-TAT-GEL靶向效果良好,抑瘤效果明显,为下一步肿瘤动物模型的试验研究奠定了基础。

