山羊痘病毒G9和A16基因的克隆及生物信息学分析
赵宏吉,张金花,司朵朵,张珠明,李继东
(宁夏大学农学院,宁夏 银川 750021)
山羊痘是由山羊痘病毒(goatpox virus, GTPV)引起山羊的一种高度接触性传染病,发病率高,同群感染的山羊发病率可达100%[1]。主要通过空气飞沫传染和接触传染等方式传播,发热、呼吸道症状及在皮肤黏膜出现痘疹为该病的特征,在中国被列为一类动物疫病[2]。山羊痘可导致山羊的体重减轻,怀孕母羊的流产率上升[3],还会对皮毛造成损坏[4],这给养羊业造成了巨大的经济损失,而且还有山羊痘感染人的相关报道[5],说明研究该病具有公共卫生学意义。世界上很多国家有山羊痘的相关报道,该病在希腊、越南、蒙古等出现过暴发流行[6]。国内多呈地方性流行,如云南、宁夏、湖南、山东、黑龙江、内蒙古、甘肃、青海、江苏等地也有山羊痘的发生[7]。
GTPV属于痘病毒科山羊痘病毒属,是一种有囊膜包被的DNA病毒。GTPV基因组呈双股线形,约有150 kb,(A+T)含量约为75%。病毒大小约为300 nm×270 nm×200 nm,可在羔羊睾丸和羊肾的单层细胞、鸡胚绒毛尿囊膜上良好地生长[8]。GTPV的基因组中约有147个开放阅读框(ORF),病毒基因编码的部分蛋白是重要的结构蛋白[9]。当前,人们对痘苗病毒(vaccinia virus,VACV)的基因组以及编码的功能蛋白已经有了较为系统、深入的研究。有研究显示,在VACV中,有12种蛋白参与病毒对细胞的侵入和融合[10]。而在侵入和融合作用的蛋白中,A16和G9是较早被鉴定为与侵入、融合相关的病毒膜蛋白,该蛋白是可溶性的肉豆蔻酰化蛋白,在病毒复制组装或有感染性的病毒颗粒产生过程中起到重要作用[11]。有试验证明,当VACV缺失了G9、A16基因就不能进行复制,说明G9、A16基因参与病毒的复制[12];在不诱导G9、A16表达蛋白时,病毒只能停留在宿主细胞表面,无法进入细胞内,说明这2个蛋白与病毒侵袭宿主细胞的毒力有关[13]。各种痘病毒在基因组成、排列方式以及核苷酸序列等方面具有不同程度的保守性,保守性较高的基因在病毒复制、组装以及感染宿主细胞等过程中起着重要作用[14]。借鉴和参考VACV感染宿主细胞相关膜蛋白的研究成果,通过比对分析GTPV和VACV的基因组,发现VACV的部分基因在GTPV基因组中具有对应的同源基因[15]。由此推断,GTPV 中G9、A16的同源基因在病毒的复制与感染中具有与VACV G9、A16基因相似的作用。
本研究通过NCBI数据库查找VACV G9、A16基因在GTPV中的同源基因序列gp055、gp103,克隆编码GTPV疫苗株G9、A16蛋白的基因序列,利用生物信息学方法分析G9、A16蛋白的性质与功能,为进一步开展相关研究提供参考。
1 材料与方法
1.1 病毒株
本试验所用山羊痘病毒疫苗株GTPV AV41来源于中国兽医药品监察所,由本实验室保存。
1.2 试剂
2×TaqPlus Master Mix,购自纽英仑生物技术(北京)有限公司;凝胶回收试剂盒,购自上海百赛生物技术股份有限公司。
1.3 引物设计和合成
参考山羊痘病毒Goatpox Virus Pellor(登录号:NC_004003)的基因组序列设计引物,从山羊痘病毒弱毒疫苗GTPV AV41的基因组中扩增编码G9蛋白和A16蛋白的基因序列,大小分别为1 011和1 134 bp,使用Primer Premier 5.0软件设计2对特异性引物,引物由上海生工生物工程股份有限公司合成。引物序列为:GTPV G9-F:5′-ATGGGTTCTTCTTTTACAGTTC-3′;GTPV G9-R:5′-TTAAATAGCTACAATTAATACCCAT-3′;GTPVA16-F:5′-ATGGGTGGATCTGTATCTGTAAC-3′;GTPV A16-R:5′-TTATCGTCTACGAACATTTATATTATT-3′。
1.4 基因扩增和鉴定
以提取的山羊痘病毒疫苗毒株GTPV AV41基因组为模板,使用引物GTPV G9-F、GTPV G9-R、GTPV A16-F、GTPV A16-R进行PCR扩增。
PCR反应体系为:50 μL,2×TaqPlus Master Mix 25 μL、模板3 μL、上下引物各2 μL、ddH2O 18 μL。
PCR反应为:95 ℃ 预变性5 min;98 ℃ 变性10 s,55 ℃退火10 s,72 ℃延伸80 s,共30个循环;72 ℃延伸10 min。
PCR扩增产物在1.2%琼脂糖凝胶进行电泳鉴定并切胶回收目的片段,将回收的目的片段放入4 ℃冰箱保存并送公司进行测序。
1.5 序列比对及进化树构建
从NCBI数据库中截取痘病毒科不同属中常见的痘病毒G9、A16的同源基因序列进行比对(表1),使用DNAStar的MegAlign软件进行核苷酸序列一致性比对分析,并用MEGA软件构建分子进化树。
表1 基因序列
1.6 生物信息学分析
将GTPV AV41 G9、A16基因核苷酸序列利用DNAStar的EditSeq软件翻译成蛋白序列,通过在线工具ExPASy(http://www.expasy.org/tools/#proteome)预测蛋白质的理化性质;通过SOPMA(http://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测蛋白质的二级结构;通过MEME(http://meme-suite.org/tools/meme)预测蛋白质的保守结构域;通过ProtScale(http://web.expasy.org/cgi-bin/protscale/protscale.pl)对蛋白质疏水性进行分析;通过NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)预测蛋白质的磷酸化位点;通过TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测蛋白质的跨膜区;通过EMBOSS Needle(https://www.ebi.ac.uk/Tools/psa/emboss_needle/)比对蛋白序列差异;通过DNAStar的Protean软件预测蛋白质的抗原表位;通过Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)分析蛋白质的三级结构。
2 结果与分析
2.1 A16、G9基因扩增
PCR产物在1.2%的琼脂糖凝胶上进行电泳鉴定,有2处明亮且单一的目的条带(图1),与预期片段1 134 bp(A16)和1 011 bp(G9)大小相符。

M.DL2000 DNA Marker;1.A16基因;2.G9基因
2.2 G9、A16基因序列比对
使用DNAStar的MegAlign软件对GTPV AV41的G9、A16基因测序结果与其他毒株的相应序列进行核苷酸序列一致性比对分析,GTPV AV41与GTPV Pellor的G9基因一致性为99.4%,与SHPV 17077-99、LSDV NI-2490的G9基因一致性为96.3%和97.1%,与VACV IHD-J的G9基因一致性为56.8%(图2A)。GTPV AV41与GTPV Pellor的A16基因一致性为99.4%,与SHPV 17077-99、LSDV NI-2490的A16基因一致性为97.5%和98.4%,与VACV IHD-J的A16基因一致性为63.8%(图2B)。

图2 G9(A)、A16(B)基因的一致性比较
2.3 进化树的构建
使用MEGA软件Neighbor Joining方法将所筛选的不同物种的蛋白序列构建进化树,结果显示GTPV AV41与GTPV Pellor的亲缘关系最近,与SHPV 17077-99次之,与VACV IHD-J的亲缘关系较远,GTPV AV41与VACV IHD-J分别在2个不同的大分支上(图3)。

图3 G9(A)、A16(B)蛋白序列进化树
2.4 蛋白质的理化性质
通过在线工具ExPASy对GTPV AV41的G9、A16蛋白理化性质进行预测,发现G9蛋白由336个氨基酸组成,相对分子质量为39 021.61,理论等电点为7.39,不稳定系数为38.52。A16蛋白由377个氨基酸组成,相对分子质量为43 976.80,理论等电点为9.09,不稳定系数为44.60。
2.5 磷酸化位点分析
通过NetPhos 3.1 Server预测G9、A16蛋白的磷酸化位点。结果显示,GTPV AV41的G9蛋白共有34个磷酸化位点,其中丝氨酸(Ser)磷酸化位点有23个,位于288位的氨基酸置信度最高,为0.997;酪氨酸(Tyr)磷酸化位点有6个,位于46位的氨基酸置信度最高,为0.823;苏氨酸(Thr)磷酸化位点有5个,位于256位的氨基酸置信度最高,为0.847(图4A)。在VACV IHD-J的G9蛋白中共有29个磷酸化位点,其中Ser 磷酸化位点有15个,位于105位的氨基酸置信度最高,为0.988;Tyr磷酸化位点有5个,位于108位的氨基酸置信度最高,为0.965;Thr磷酸化位点有9个,位于124位的氨基酸置信度最高,为0.912(图4B)。
GTPV AV41的A16蛋白共有36个磷酸化位点,其中Ser 磷酸化位点有18个,位于118位的氨基酸置信度最高,为0.993;Tyr磷酸化位点有9个,位于110位的氨基酸置信度最高,为0.953;Thr磷酸化位点有9个,位于191位的氨基酸置信度最高,为0.875(图4C)。在VACV IHD-J的A16蛋白中共有41个磷酸化位点,其中Ser 磷酸化位点有15个,位于198位的氨基酸置信度最高,为0.990;Tyr磷酸化位点有11个,位于44位的氨基酸置信度最高,为0.970;Thr磷酸化位点有15个,位于6位的氨基酸置信度最高,为0.871(图4D)。

A.GTPV AV41的G9蛋白;B.VACV IHD-J的G9蛋白;C.GTPV AV41的A16蛋白;D.VACV IHD-J的A16蛋白
2.6 抗原表位预测
通过DNAStar的Protean软件预测GTPV AV41和VACV IHD-J G9、A16蛋白的抗原表位。GTPV AV41 G9蛋白可能的抗原表位有17个,预测结果为:第9~28、30~33、40~44、50~59、68~93、100~133、138~150、157~168、175~180、191~199、208~215、221~234、236~252、256~263、266~272、279~306、312~316位氨基酸(图5A);VACV IHD-J G9蛋白可能的抗原表位16个,预测结果为:第7~23、27~32、47~65、79~89、95~110、116~130、134~144、151~165、175~184、195~205、211~221、223~252、272~277、278~287、292~301、302~309位氨基酸(图5B)。
GTPVAV41 A16可能的抗原表位有19个,预测结果为:第12~21、30~33、41~55、62~66、70~81、85~99、103~125、126~146、150~171、176~184、189~196、204~214、236~244、250~253、257~264、269~294、306~342、362~371、373~377位氨基酸(图5C);VACV IHD-J A16蛋白可能的抗原表位21个,预测结果为:第7~12、13~24、29~35、36~44、49~60、86~99、104~119、128~144、145~158、160~171、174~187、189~196、203~212、220~224、236~245、250~263、270~280、282~293、305~322、325~338、361~377位氨基酸(图5D)。

A.GTPV AV41的G9蛋白;B.VACV IHD-J的G9蛋白;C.GTPV AV41的A16蛋白;D.VACV IHD-J的A16蛋白
2.7 二级结构
通过在线工具SOPMAy对GTPV AV41和VACV IHD-J的G9、A16蛋白二级结构进行预测。结果显示,在GTPV AV41的G9蛋白中α-螺旋(h)由123个氨基酸组成,占36.61%;β-折叠(e)由50个氨基酸组成占14.88%,β-转角(t)由19个氨基酸组成占5.65%,无规则卷曲(c)由144个氨基酸组成,占42.86%。在VACV IHD-J的G9蛋白中α-螺旋(h)由134个氨基酸组成,占39.41%;β-折叠(e)由50个氨基酸组成占14.71%,β-转角(t)由17个氨基酸组成占5.00%,无规则卷曲(c)由139个氨基酸组成,占40.88%。
在GTPV AV41的A16蛋白中α-螺旋(h)由96个氨基酸组成,占25.46%;β-折叠(e)由80个氨基酸组成占21.22%,β-转角(t)由19个氨基酸组成占5.04%,无规则卷曲(c)由182个氨基酸组成,占48.28%。在VACV IHD-J的A16蛋白中α-螺旋(h)由101个氨基酸组成,占26.79%;β-折叠(e)由87个氨基酸组成占23.08%,β-转角(t)由23个氨基酸组成占6.10%,无规则卷曲(c)由166个氨基酸组成,占44.03%。
2.8 保守结构域分析
使用MEME在线工具(域宽度=6~50)预测比对GTPV AV41和VACV IHD-J以及其他几种痘病毒的G9、A16蛋白保守结构域,结果显示,在GTPV AV41的G9蛋白序列中,有9个结构域,最大的结构域长度为50个氨基酸残基,最小的为6个氨基酸残基,VACV IHD-J的G9蛋白有10个结构域(图6)。在GTPV AV41的A16蛋白序列中,有10个结构域,最大的结构域长度为50个氨基酸残基,最小的为8个氨基酸残基, VACV IHD-J的A16蛋白有10个结构域(图7)。
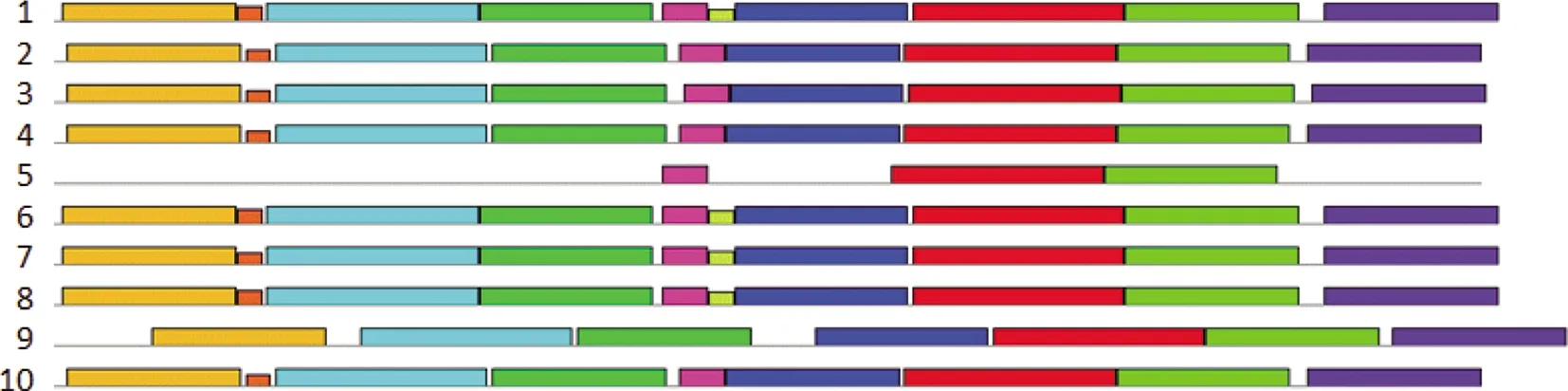
1.VACV IHD-J;2.GTPV Pellor;3.SHPV 17077-99;4.LSDV NI-2490;5.FWPV strain NVSL;6.CMPV M-96;7.MPV Zaire-96-I-16;8.VARV major;9.SWPV KASZA;10.GTPV AV41

1.VACV IHD-J;2.GTPV Pellor;3.SHPV 17077-99;4.LSDV NI-2490;5.FWPV strain NVSL;6.CMPV M-96;7.MPV Zaire-96-I-16;8.VARV major;9.SWPV KASZA;10.GTPV AV41
2.9 疏水性分析与跨膜区预测
分别使用ProtScale和TMHMM Server v.2.0网站对GTPV AV41和VACV IHD-J的G9、A16蛋白疏水性和跨膜区进行分析。由分析结果可知,在GTPV AV41的G9蛋白中,第330位色氨酸(Trp)最高,为3.456,疏水性最强;第84位天冬酰胺(Asn)最低,为-3.200,亲水性最强(图8A)。VACV IHD-J的G9蛋白中,第334位Trp最高,为3.600,疏水性最强;第55位赖氨酸(Lys)最低,为-2.933,亲水性最强(图8B)。GTPV AV41的G9蛋白从318~335位氨基酸是跨膜区(图9A),VACV IHD-J的G9蛋白从322~339位氨基酸是跨膜区(图9B)。
在GTPV AV41的A16蛋白中,第351位半胱氨酸(Cys)和第352位亮氨酸(Leu)最高,为3.411,疏水性最强;第275位精氨酸(Arg)最低,为-2.900,亲水性最强(图8C)。VACV IHD-J的A16蛋白中,第351位缬氨酸(Val)最高,为3.156,疏水性最强;第275位精氨酸(Arg)最低,为-2.867,亲水性最强(图8D)。GTPV AV41的A16蛋白从342~361位氨基酸是跨膜区(图9C),VACV IHD-J的A16蛋白从341~363位氨基酸是跨膜区(图9D)。

A.GTPV AV41的G9蛋白;B.VACV IHD-J的G9蛋白;C.GTPV AV41的A16蛋白;D.VACV IHD-J的A16蛋白
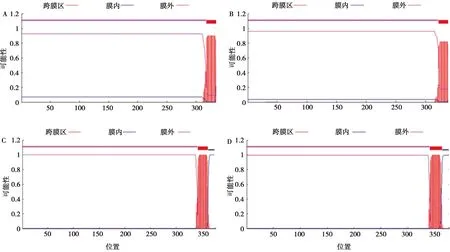
A.GTPV AV41的G9蛋白;B.VACV IHD-J的G9蛋白;C.GTPV AV41的A16蛋白;D.VACV IHD-J的A16蛋白
2.10 半胱氨酸残基位点及豆蔻酰化位点比对
通过EMBOSS Needle网站对比GTPV AV41和VACV IHD-J G9、A16蛋白序列中的半胱氨酸残基位点。由比对结果可知,GTPV AV41 G9共15个半胱氨酸残基位点,VACV IHD-J G9共14个半胱氨酸残基位点(图10A,黄色);GTPV AV41 A16共21个半胱氨酸残基位点,VACV IHD-J A16共20个半胱氨酸残基位点(图10B,黄色)。GTPV AV41与VACV IHD-J G9、A16蛋白各有一个豆蔻酰化位点(图10,紫色)。

图10 G9(A)、A16(B)蛋白半胱氨酸残基位点比对结果
2.11 三级结构
通过Phyre2网站使用同源建模方法分析GTPV AV41 G9、A16蛋白的三级结构。结果显示,G9蛋白第39~88位氨基酸序列形成类似于甲烷球菌产生的精氨酸脱羧ase2突变体结构,具有裂解酶的相似功能;第317~334位氨基酸序列形成类似于小鼠的fas/cd95细胞死亡受体跨膜结构域,具有细胞凋亡和跨膜功能。A16蛋白第50~107位氨基酸序列具有链霉菌2419-svt2蛋白的晶体结构(apo2型),是用于生物合成的一种蛋白质;第347~361位氨基酸序列具有新颖的跨膜螺旋结构,可以形成跨膜蛋白。
3 讨论
本研究通过克隆山羊痘病毒弱毒苗毒株GTPV AV41的G9、A16基因序列并进行测序,将测序得到的G9、A16核苷酸序列翻译为氨基酸序列,利用生物信息学软件和在线分析网站将VACV IHD-J以及其他痘病毒的同源序列与GTPV AV41的G9、A16序列进行比对并构建分子进化树,对G9、A16蛋白进行理化性质和生物信息学分析。结果显示GTPV AV41与VACV IHD-J的G9、A16核苷酸序列以及氨基酸序列的一致性很低且亲缘关系较远。GTPV AV41的G9蛋白是碱性的性质稳定的蛋白,A16蛋白是碱性的性质不稳定的蛋白。在G9蛋白中有23个丝氨酸磷酸化位点,5个苏氨酸磷酸化位点,在A16蛋白中有18个丝氨酸磷酸化位点,9个苏氨酸磷酸化位点,这些磷酸化位点可以促进该蛋白和其他蛋白相互作用,从而形成多蛋白聚合体,为G9、A16形成二聚体提供了依据[16];G9蛋白中的6个酪氨酸磷酸化位点和A16蛋白中的9个酪氨酸磷酸化位点可以影响宿主细胞的信号转导机制,从而控制宿主细胞生长[17],这些磷酸化位点的识别对于研究蛋白质功能有重要作用。G9和A16蛋白的二级结构中以无规则卷曲和α-螺旋为主。α-螺旋有利于蛋白质结构的稳定,无规则卷曲为凸出结构,大多出现在蛋白质表面,有利于形成表位。将G9和A16蛋白二级结构和抗原表位的预测结果综合分析发现,G9蛋白的7~21、139~145、209~214、236~250位氨基酸,A16蛋白的43~57、236~244、249~254位氨基酸存在形成表位的潜力,可以作为优势抗原表位,为以后的疫苗制备提供依据。G9和A16蛋白的氨基酸序列末端疏水性较强,可以形成跨膜区域,而且在三级结构预测中有跨膜构象,这对病毒吸附、侵染等过程发挥重要作用[18]。半胱氨酸是蛋白质中唯一一个可以形成二硫键的氨基酸,使蛋白质折叠成稳定的三级结构甚至是四级结构,G9蛋白有15个半胱氨酸残基位点,A16蛋白有21个半胱氨酸残基位点,这为病毒蛋白形成功能构象提供基础;G9和A16蛋白的N-端还有一个豆蔻酰化位点,这与病毒的复制组装有关[19]。
由于山羊痘病毒G9、A16蛋白的功能是从痘苗病毒的研究成果中推断而来,所以把2个病毒的G9、A16蛋白进行了相应的比较。从氨基酸的个数上来说,GTPV与VACV的A16蛋白氨基酸数量完全相同,GTPV比VACV的G9蛋白少了4个氨基酸,但两者对应蛋白的氨基酸序列有着很大的差异。在蛋白的磷酸化位点和抗原表位的预测结果中发现GTPV AV41与VACV IHD-J的G9、A16蛋白在位点和个数上有很大的不同,但有趣的是,在二者的G9、A16蛋白二级结构和保守结构域的预测结果中无论是在氨基酸折叠类型所占比例和位置,还是保守结构域的个数,以及构成结构域的氨基酸的个数都非常的相似。再进一步对GTPV AV41和VACV的G9、A16蛋白疏水性和跨膜区进行对比分析,结果GTPV AV41的G9、A16蛋白与Wagenaar等[20]发现的VACV的G9、A16蛋白跨膜区结果一致。在半胱氨酸残基位点的比对中发现,虽然GTPV AV41与VACV IHD-J的G9、A16蛋白序列差异很大,但在半胱氨酸残基线性位点上除了GTPV AV41的G9序列第190位半胱氨酸和GTPV AV41的A16序列第351位半胱氨酸与VACV IHD-J不同之外,其他位点上的半胱氨酸和N-端的豆蔻酰化位点都能一一对应,说明蛋白之间的三级构象以及作用位点非常相似。
综上,本研究对GTPV AV41的G9、A16基因进行克隆,并对其序列进行一系列生物信息学分析,为进一步研究G9、A16蛋白提供了基本数据资料。同时,将其与VACV同源基因比较,虽然GTPV和VACV的G9、A16蛋白在氨基酸序列上存在很大差异,但两者具有相对保守的结构域,蛋白跨膜区、半胱氨酸残基位点等高级结构也高度相似。因此,山羊痘病毒G9、A16蛋白功能的进一步研究可以参考痘苗病毒的相关研究结果。

