叉头框蛋白O亚型3a和p27激酶蛋白抑制剂1在电针促进面神经再生中的作用研究※
郑红弟 费 静 余莉亚 李雷激
(西南医科大学附属医院耳鼻咽喉头颈外科,四川 泸州 646000)
据流行病学调查显示,面瘫在我国的发病率为每年26~34/10万人,患病率为每年258/10万人,据此,我国每年将至少有335万人患此病[1],因而,研究面神经损伤的修复具有重要的临床意义。已有大量临床报道证实,针灸治疗周围性面瘫疗效确切。随着电针的普遍应用,患者的治愈率得到了较大提高[2],但电针治疗周围性面瘫的机制尚不明确。
面神经损伤后修复是多因素综合作用的结果,目前针对神经营养因子、细胞因子的研究很多,关于细胞周期调节因子在面神经损伤后修复中作用研究尚少见,在坐骨神经损伤后修复中的作用研究多见。叉头框蛋白O亚型3a(Foxo3a)和p27激酶蛋白抑制剂1(p27 kip1)是重要的细胞周期负性调节因子。Foxo3a是叉头转录因子(Foxo)的一种,Foxo3a转录后磷酸化受磷脂酰肌醇-3-激酶-蛋白激酶B(PI3K-Akt)调节,当Akt途径被抑制时,Foxo3a被激活,从细胞质导入细胞核,从而阻止细胞增殖,导致细胞死亡[3-4]。p27 kip1是细胞周期蛋白依赖性激酶抑制剂家族的一员,通过抑制激酶活性而抑制细胞周期,对损伤后修复有重要影响[5-6]。Foxo3a可调节下游基因p27 kip1,p27 kip1可抑制细胞周期蛋白D1,使细胞周期停滞在G0/G1期,从而阻止细胞增殖[3,6]。查阅文献,既往无探究面神经压榨性损伤后,Foxo3a和p27 kip1在电针促进面神经修复中的作用的相关研究。本实验旨在研究Foxo3a和p27 kip1在面神经压榨性损伤大鼠脑桥面神经核团段脑组织中的表达情况以及电针对两者表达是否存在影响,以进一步探索电针治疗周围性面瘫可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康SD雄性大鼠42只,3~5月龄,体质量250~300 g,由西南医科大学实验中心提供,实验动物合格证号:SYXK(川)2018-065。本实验通过西南医科大学伦理委员会审查,批准号:201909-5。
1.1.2 主要试剂 Foxo3a一抗、p27 kip1一抗、β-actin一抗[Abcam,艾博抗(上海)贸易有限公司],辣根过氧化物酶标记山羊抗小鼠IgG(H+L)、辣根过氧化物酶标记山羊抗兔IgG(H+L)、蛋白免疫印迹(Western Blot)一抗稀释液、放射免疫沉淀试验(RIPA)裂解液、蛋白浓度测定试剂盒、十二烷基磺酸钠—聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶配制试剂盒、聚偏二氟乙烯(PVDF)膜(上海碧云天生物技术有限公司),增强化学发光法(ECL)超敏发光液(北京博奥森生物技术有限公司),苏木素-伊红(HE)染色试剂盒(北京索莱宝科技有限公司),二氨基联苯胺(DAB)显色试剂盒、免疫组化染色试剂盒(武汉博士德生物工程有限公司)。
1.1.3 主要仪器 G6805-1A型电针治疗仪(青岛鑫升实业有限公司),无菌针灸针(北京天宇科技发展有限公司),匀浆器(上海安亭科学仪器厂),-80 ℃冰箱、蛋白浓度分析仪(美国Thermo Fisher公司),电泳仪(美国Bio-Rad公司),低温高速离心机(湖南湘仪实验室仪器开发有限公司),全自动发光分析仪(上海天能科技有限公司),石蜡包埋机(苏州市苏信净化设备厂),石蜡切片机(美国Sigma公司),恒温干燥箱(上海新苗医疗器械制造有限公司),倒置显微镜(中国奥林巴斯有限公司)。
1.2 方法
1.2.1 动物分组及模型制作 将42只大鼠按照随机数字表法分为3组,即正常组6只、模型组18只、电针组18只。正常组不予任何处理,正常饲养;模型组、电针组适应性喂养1周后均采用同样的方法由同一人独立完成制作右侧面神经上颊支压榨性损伤模型全过程。10%水合氯醛0.3 mL/kg腹腔注射麻醉大鼠,右侧面部备皮后于口角与耳屏之间做一长约2 cm“弧形”切口,止血钳钝性分离皮下组织,暴露面神经上颊支,长约1~2 cm,用蚊式止血钳满扣夹持面神经上颊支,持续30 s,松开30 s,再夹持30 s[7],面神经压榨完成后逐层缝合切口,消毒周围皮肤,将大鼠放置于37 ℃加热垫上复苏,并分笼在同种环境下饲养,常规预防感染。
1.2.2 干预方法 正常组不做任何处理。模型组每日单独固定于自制鼠板上30 min,不做任何治疗。电针组予电针治疗,第1次为术后2 h,将大鼠固定在自制鼠板上,取右侧地仓(口角外1.0 cm)、右侧颊车(下颌角前上方咬肌最隆起之处)2个穴位配对,选用直径0.25 mm,长度1.5 cm无菌针灸针,针刺深度5 mm,刺入穴位后接电针治疗仪治疗。治疗仪参数:电流40~50 μA,电压2 V,频率18~20 Hz,疏密波,强度以颊肌轻微颤动为宜。15 min后交换配对电极,每次30 min,每日治疗1次。
1.3 观察指标及方法
1.3.1 标本取材 正常组于适应性喂养1周后采用腹腔过度注射10%水合氯醛麻醉后,断头法处死大鼠,直接取材。模型组、电针组分别于术后第4、14、28 d取材(每组每个时间点分别随机抽取3只大鼠)。①Western Blot检测取材方法:采用腹腔过度麻醉后断头处死大鼠,用剪刀剪开大鼠颈背部皮肤后离断头颅,鹰嘴钳咬除颅骨暴露脑组织,右侧听神经根保留以作为术侧的标记,去除小脑的四叠体,保留脑桥四叠体区域(脑桥中、下段),将组织于无菌盘中用磷酸缓冲溶液(PBS)冲洗去除血液后,从上向下分为3块,每块厚度不超过3 mm,置于清洁冻存管于-80 ℃冰箱保存。②切片标本取材方法:将模型组、电针组每个时间点剩余的3只大鼠腹腔过度麻醉后固定于自制鼠板,腹部切口暴露腹白线,剪开腹膜找到腹主动脉并结扎,暴露心脏,剪开右心耳,将输液针自左心室插入主动脉,持续缓慢灌注0.9%氯化钠注射液至右心耳处流出的液体清亮为止,再继续予4%多聚甲醛灌注进行预固定。按照Western Blot检测取材方法进行取材,将取下的脑桥中、下段继续置于4%多聚甲醛中固定,经过修剪、脱水、透明后浸蜡包埋成石蜡块。
1.3.2 脑桥中、下段脑组织HE染色观察 将各组大鼠脑组织石蜡块切片、展片、45 ℃恒温箱中烤干,常规二甲苯、乙醇脱蜡至水后依次放入苏木素溶液染色,再用流水冲去余色,1∶400氨水冲15 s,再用自来水冲洗10 min,入蒸馏水片刻,伊红染色3 min,低浓度到高浓度酒精依次脱水,入二甲苯透明后滴上中性树脂,最后盖玻片封片,将玻片置于倒置显微镜下观察,先于低倍镜(×100)下找到聚集成团的大多角形面神经元细胞,再于高倍镜(×200)下观察神经元细胞的形态,并拍照。
1.3.3 Western Blot检测 根据蛋白提取液说明书步骤提取各组大鼠脑桥中、下段脑组织蛋白,并使用二喹啉甲酸(BCA)法进行浓度测量后100 ℃蛋白变性10 min,-20 ℃冰箱保存。制备SDS-PAGE凝胶,按照每孔40 μg蛋白量分别加入上样孔进行电泳分离90 min。然后依次进行转膜60 min、室温下脱脂牛奶封闭2 h、TBST缓冲液漂洗干净,再将膜置于一抗稀释液Foxo3a(1∶1 000)、p27 kip1(1∶2 000)4 ℃冰箱过夜;第2 d将膜用TBST缓冲液漂洗干净后再置于二抗[辣根过氧化物酶标记山羊抗小鼠IgG (H+L) 、辣根过氧化物酶标记山羊抗兔IgG (H+L) ](1∶1 000)稀释液中常温摇床上孵育60 min,TBST缓冲液漂洗干净后使用ECL超敏发光液进行发光,全自动发光分析仪显影后Image J图像处理软件处理条带,测出目的条带与内参(β-actin)条带灰度值比值以表示目的蛋白的相对表达量。
1.3.4 免疫组化检测 各组大鼠脑桥中、下段脑组织石蜡块切片二甲苯脱蜡至水,再依次进行高压抗原热修复、灭活内源性酶、5%牛血清白蛋白(BSA)室温下封闭20 min,然后于37 ℃恒温箱中孵育一抗2 h,PBS溶液洗3次,每次5 min,室温下孵育二抗20 min,PBS浸洗后行DAB室温显色10 min,苏木素复染3 min,最后依次脱水、透明、封片,60 ℃烤箱烘干,显微镜下观察阳性反应细胞数并拍照。免疫组化阳性细胞的标准:胞体直径约20 μm,神经元细胞浆及轴突内含有棕黄色颗粒。
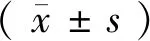
2 结 果
2.1 一般情况 正常组大鼠精神、食欲正常,体质量较术前增加,触须运动正常,双侧对称,鼻尖均居中,双侧眼睑闭合正常。模型组、电针组大鼠造模后全部存活,未出现伤口感染、伤口不愈合等情况,麻醉苏醒后术后第1 d观察所有造模大鼠表现为右侧眼睑下垂、不能闭合,右侧胡须节律性摆动消失,鼻尖偏向健侧。
2.2 各组大鼠脑桥中、下段脑组织面神经元形态学观察 正常组低倍镜(×100)视野下可见聚集成团的大多角形运动细胞面神经元细胞;高倍镜(×200)下可见面神经元细胞轮廓清晰、结构完整,胞质染色均匀,大而圆的蓝色胞核位于细胞中央。模型组低倍镜视野下见面神经元细胞稍分散,边界模糊,细胞突起减少,随着时间推移,第14、28 d细胞数目、细胞突起逐渐增多;高倍镜下见胞质染色不均匀,核仁不居中。电针组第4、14、28 d在低倍镜和高倍镜下的面神经元细胞数目及形态学与模型组呈现出相同的变化趋势,但同一时间点电针组细胞团较模型组细胞团聚集,边界更清晰,细胞数目更多,面神经元细胞突起增多(见插1,图1)。
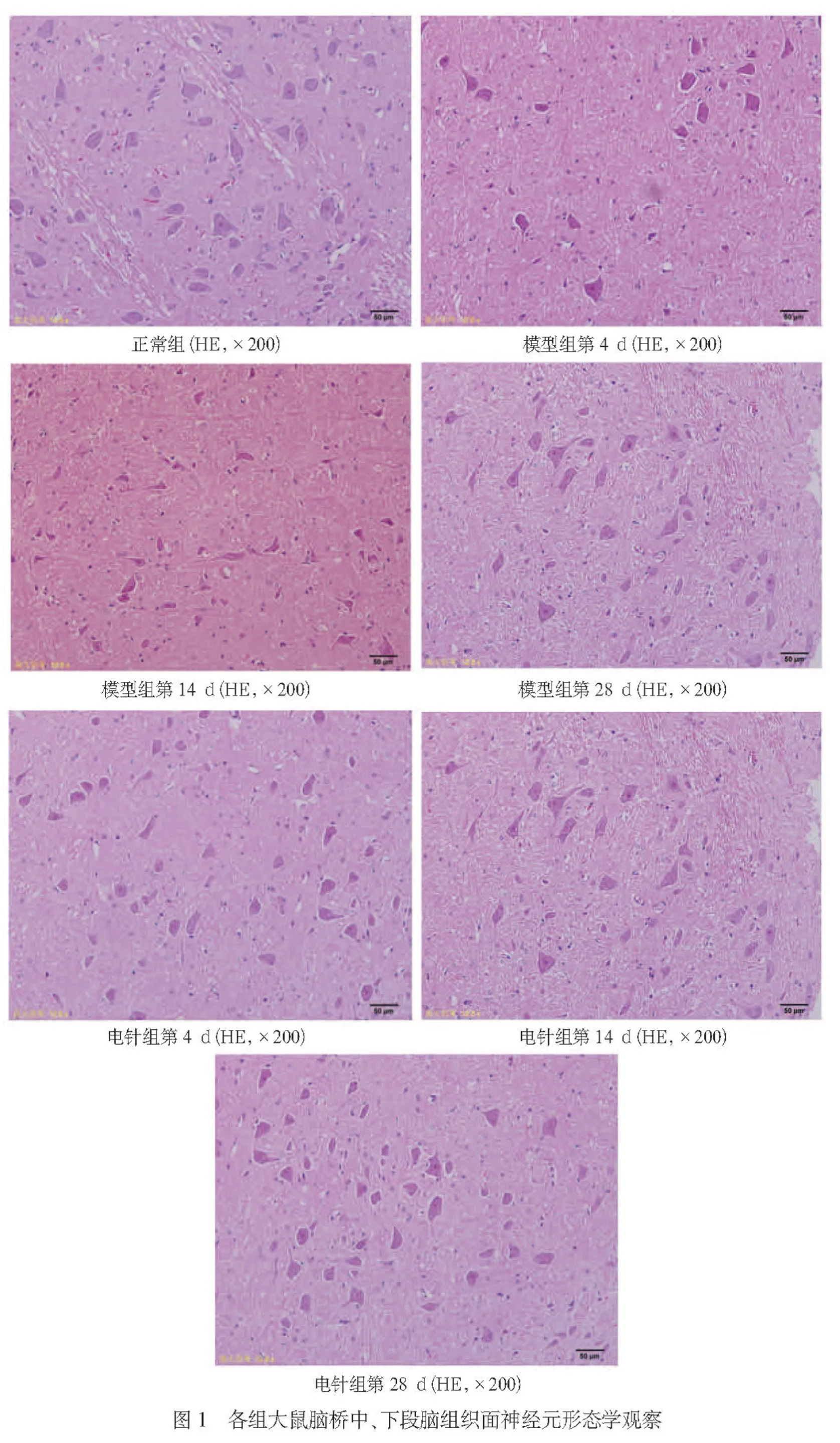
2.3 各组大鼠脑桥中、下段脑组织Foxo3a、p27 kip1蛋白表达比较 见表1。
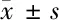
表1 各组大鼠脑桥中、下段脑组织Foxo3a、p27 kip1蛋白表达比较
由表1可见,术后第4 d,模型组Foxo3a、p27 kip1蛋白表达低于正常组(P<0.05),电针组低于模型组(P<0.05);术后第14 d,模型组、电针组Foxo3a及p27 kip1蛋白表达均较本组第4 d增高(P<0.05),但仍低于正常组(P<0.05),电针组Foxo3a、p27 kip1蛋白表达低于模型组同期(P<0.05);术后第28 d,模型组、电针组Foxo3a蛋白表达与正常组比较差异均无统计学意义(P>0.05),模型组p27 kip1蛋白表达与正常组比较差异无统计学意义(P>0.05),电针组p27 kip1蛋白表达与正常组比较差异有统计学意义(P<0.05),电针组Foxo3a、p27 kip1蛋白表达与模型组同期比较差异均无统计学意义(P>0.05),模型组、电针组Foxo3a、p27 kip1蛋白表达均高于本组第14 d(P<0.05)。模型组、电针组Foxo3a、p27 kip1蛋白表达随着时间的推移均表现为先下降后上升的趋势(见图2)。

图2 各组大鼠脑桥中、下段脑组织第4、14、28 d Foxo3a和p27 kip1蛋白条带图
2.4 各组大鼠脑桥中、下段脑组织面神经元中Foxo3a、p27 kip1阳性细胞数比较 见表2。
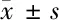
表2 各组脑桥中、下段脑组织面神经元中Foxo3a、p27 kip1阳性细胞数比较 个,
由表2可见,术后第4 、14 d模型组Foxo3a、p27 kip1阳性细胞数均低于正常组(P<0.05),术后第28 d,模型组Foxo3a、p27 kip1阳性细胞数与正常组比较差异无统计学意义(P>0.05)。术后第4 、14 d电针组Foxo3a、p27 kip1阳性细胞数均低于正常组及模型组同期(P<0.05);术后第28 d,电针组与模型组Foxo3a阳性细胞数比较差异无统计学意义(P>0.05),电针组p27 kip1阳性细胞数低于模型组同期(P<0.05)。术后第4、14、28 d模型组、电针组Foxo3a、p27 kip1阳性细胞数后一时间点均高于本组前一时间点(P<0.05)。
正常组大鼠Foxo3a在面神经元中有较高表达,免疫反应阳性信号主要在面神经元细胞质表达。术后第4 d,Foxo3a在模型组、电针组面神经元中均有表达,主要表达在细胞质,细胞核表达少。术后第4、14 d,模型组Foxo3a阳性细胞数均低于正常组,呈现出先下降后上升的趋势,术后第4 d阳性细胞数最少,随之逐渐升高,直到术后第28 d,模型组阳性细胞数接近正常组。电针组与模型组相比,术后第4、14 d电针组Foxo3a阳性细胞数均低于模型组;术后第28 d,电针组接近模型组Foxo3a阳性细胞数(见插2,图3)。

正常组大鼠面神经元细胞中可见p27 kip1阳性表达,且高倍镜下显示细胞质及细胞核均可见免疫组化阳性反应信号,细胞质表达强于细胞核。术后第4、14 d,p27 kip1在模型组及电针组面神经元中均有表达,在细胞质及细胞核中均有表达,但细胞核中的阳性表达明显强于细胞质。与正常组相比,术后第4 、14 d模型组p27 kip1阳性细胞数呈现出先下降后上升的趋势,术后第4 d阳性细胞数最少,至术后第28 d接近正常组。电针组与模型组相比,相同时间点的电针组均比模型组阳性细胞数低,也呈现出先下降后上升的趋势,到第28 d,电针组阳性细胞数仍比模型组少(见封3,图4)。

3 讨 论
世界卫生组织(WHO)推荐面瘫是针灸最适宜治疗的病种之一。目前,电针治疗面神经损伤被临床广泛应用,并取得了显著疗效。研究表明,急性期电针治疗可明显提高痊愈率、显效率,疗效比单纯针刺治疗好,能明显加快面神经传导和面神经功能恢复,痊愈所需天数明显缩短[8-10]。但电针治疗面神经损伤的具体机制仍处于研究阶段。地仓穴位于口角外侧,主治口眼斜、流涎、唇齿不收等,穴区深层有面神经颊支及面动脉分布,是治疗周围性面瘫最常用的穴位之一;颊车穴位于下颌角前上方咬肌最丰隆处中心点,与地仓穴同属足阳明胃经穴,主治口眼斜、颊肿、面肌痉挛、流涎等,也为治疗面瘫的主穴[11]。因此,地仓、颊车常配伍治疗口眼斜等病症。故本实验采用电针于面神经压榨性损伤急性期刺激地仓、颊车,观察电针对大鼠面神经损伤修复的影响。
神经再生修复需要经过一系列复杂的过程,可能涉及再生的微环境,周围细胞及其产生的不同物质,遗传因素及机体的应激反应、炎性反应、免疫反应等。据既往研究显示,神经纤维再生修复的过程涉及细胞的再生及再生过程中一些细胞周期蛋白的调节,Foxo3a、p27 kip1就是其中2种重要的负性细胞周期调节因子[12]。Foxo3a通过PI3K-Akt通路与胞核内结构蛋白14-3-3特异性结合后从细胞核转运至细胞质,发生泛素化降解从而失去转录活性,促进细胞增殖。当PI3K-Akt途径被抑制时,去磷酸化的Foxo3a大部分进入细胞核,导致细胞凋亡[4,13]。本实验结果表明,面神经颊支压榨性损伤后,术后第4 d脑桥组织面神经元中Foxo3a表达量下降,随时间进展逐渐恢复正常。王友华等[6]研究结果显示,Foxo3a在大鼠坐骨神经损伤后背根神经节中的表达先下降,再逐渐恢复接近正常,与本实验结果趋势一致。Foxo3a表达量下降可能是由于PI3K-Akt通路激活,磷酸化的Foxo3a发生泛素化降解失去转录活性,从而促进细胞增殖,这与免疫组化结果面神经损伤后Foxo3a阳性信号主要集中在细胞质以及模型组、电针组阳性细胞数少于正常组相吻合。PI3K-Akt-Foxo3a通路除了调节细胞周期外,在氧化应激方面也发挥重要作用[14]。面神经受到外界损伤后发生周围组织肿胀、炎症刺激、面神经缺血缺氧,为抵抗损伤,Foxo3a表达量应增高,但本实验结果显示术后第4 d模型组及电针组均较正常组低,可能系此阶段Foxo3a下降发挥细胞周期调节效应大于炎症刺激使Foxo3a蛋白表达增高的效应,故综合两效应最终表现为Foxo3a在脑桥中、下段脑组织面神经元中表达量下降,但电针组较模型组Foxo3a下降更显著,可能是因为电针治疗使面神经周围肿胀减轻,炎症刺激降低,导致Foxo3a升高抵抗炎症及应激的效应比模型组低。因此,推断面神经损伤后,电针可以促进面神经元中Foxo3a表达量下降来加速细胞周期,促进神经损伤修复。
p27 kip1参与细胞周期的负性调控。p27 kip1是Foxo3a的下游基因,Foxo3a的活化还能增强具有抑制细胞周期G1期向S期过渡的细胞周期抑制蛋白的表达[15-16],Foxo3a也可以在核内上调p27 kip1诱导细胞生长周期停滞。且有报道大量细胞株可以通过Foxo转录抑制来降低p27 kip1的表达,从而促进细胞增殖[12],故推测面神经损伤后p27 kip1下降受Foxo3a转录水平的调控。本实验结果显示,术后第4 d,电针组p27 kip1表达量较模型组、正常组低(P<0.05)。结合Foxo3a在面神经元中的表达趋势,印证了面神经损伤后p27 kip1下降受Foxo3a转录水平的调控的推测。神经损伤后会发生一系列应激反应,面神经元中蛋白会发生很多改变,这些蛋白改变可以帮助神经元细胞对抗外界损伤,减少对自身的损伤,帮助其修复和再生。王巍等[17]研究发现,在面神经损伤后6 h面神经核神经元p27 kip1蛋白表达量即开始升高,损伤后12 h达高峰后逐渐下降,损伤后1周左右面神经核神经元p27 kip1蛋白表达量再次增高,表明面神经核神经元p27 kip1蛋白升高在面神经损伤早期起到抵抗炎症损伤的作用,后期与面神经修复有关。本实验测得第4 d模型组p27 kip1低于正常组(P<0.05),结果与文献[17]的研究基本一致,电针组比模型组表达量更低(P<0.05),推断可能是由于电针缓解了面神经损伤早期的炎症反应及应激刺激,故与模型组比较,电针组面神经损伤早期p27 kip1升高不明显,加之Foxo3a的调节使电针组p27 kip1表达量比模型组更低,更有利于神经修复。
综上所述,电针能加快面神经损伤的修复,其机制可能与综合调控p27 kip1、Foxo3a表达量从而影响细胞周期有关。

