在线固相萃取-液相色谱-串联质谱法检测蘑菇中毒患者尿液中痕量α-鹅膏毒肽
徐小民, 张京顺, 蔡增轩, 孟 真, 黄百芬, 陈 苘
(浙江省疾病预防控制中心, 浙江 杭州 310051)
野生毒蘑菇是我国食源性疾病的主要致病因子,且一半以上的死亡病例来自毒蘑菇中毒[1]。毒蘑菇中毒的临床症状包括胃肠炎、精神神经紊乱、溶血、光敏性皮炎、横纹肌溶解症、急性肝衰竭和肾衰竭等[2]。2019年我国毒蘑菇中毒的总体死亡率为2.86%,而肝毒性毒蘑菇中毒的死亡率为20%[1]。导致肝毒性中毒的毒蘑菇主要包括鹅膏菌、褐鳞伞和盔孢伞等3类[3,4],毒素主要为鹅膏毒肽(amanitin)、鬼笔毒肽和毒伞肽,其中,鬼笔毒肽不经消化道吸收,且只存在于鹅膏菌中。毒伞肽目前还没有市售标准品,两者都不适合作为相关中毒事件病因鉴定的标志物。鹅膏毒肽在3类毒蘑菇中均有发现,主要包括α-鹅膏毒肽、β-鹅膏毒肽和γ-鹅膏毒肽3种,含量和毒性最高的主要为α-鹅膏毒肽和β-鹅膏毒肽[4-7],其中α-鹅膏毒肽对人的半数致死量(LD50)为0.1 mg/kg[4]。
鹅膏毒肽类毒素中毒潜伏期较长,一般6~24 h后才出现普通胃肠炎症状[4,8],患者容易被迷惑而延误治疗。研究表明,含鹅膏毒肽的毒蘑菇中毒最佳治疗时间在36~48 h之前[9],而肝毒性症状(转氨酶等生化指标的异常升高)出现需要中毒2~3 d后[4,8],此时再对症治疗,死亡率较高。要在转氨酶等生化指标升高前做到早诊断、早治疗,有效降低死亡率,需要建立中毒标志物的有效理化检测方法。鹅膏毒肽在体内会迅速代谢,中毒24 h后很难在血液中检出,尿液中虽然仍能检出,但浓度较低[10]。尿液中α-鹅膏毒肽比β-鹅膏毒肽稳定,能被检出的浓度更高,时间更久[10,11],更适合作为肝毒性毒蘑菇中毒病因鉴定的生物标志物。
尿液中鹅膏毒肽的检测主要包括CE[12]、LC-MS/MS[11,13-17]和酶联免疫吸附法(ELISA)[9]。文献报道的尿液中鹅膏毒肽检测方法中,CE的检出限(LOD)为1.5 μg/L[12], LC-MS/MS受基质抑制效应限制,LOD在0.22~1 μg/L之间[11,13-17],采用这两种文献方法,在转氨酶等生化指标异常之前的48~72 h内,仅少部分中毒患者尿液能检出毒素,72 h后基本检不出毒素。文献[9]报道的ELISA检测尿液中鹅膏毒肽的LOD可以达到0.08 μg/L,但存在假阳性结果的可能,目前还没有能达到这个LOD水平的质谱确证方法。
本研究拟基于在线固相萃取(SPE)的精准净化功能,探索尿液中α-鹅膏毒肽质谱检测时基质抑制效应消除方法,建立了尿液中痕量毒素的在线SPE-LC-MS/MS定性定量检测技术,以解决中毒患者生化指标异常前72 h(甚至96 h)内毒素鉴定难的问题,为中毒患者的早诊断、早治疗,有效降低死亡率提供检测技术支撑。
1 实验部分
1.1 仪器与试剂
LCMS-8060在线固相萃取-液相色谱-串联质谱仪(日本岛津公司);超纯水装置(美国Millipore公司); Sartorius 1-14高速离心机(德国Sartorius公司)、HC-3018高速离心机(安徽中科中佳科学仪器有限公司); WH-861旋涡混合器(江苏太仓华利达实验设备有限公司)。
甲醇和乙腈为色谱纯(美国Tedia公司);甲酸为分析纯(美国ROE Scientific公司);α-鹅膏毒肽标准品(纯度>95%,美国Enzo公司)。
1.2 标准溶液的配制
准确称取α-鹅膏毒肽标准品,置于10 mL容量瓶中,用甲醇溶解并定容至刻度,配制质量浓度为100 mg/L的标准储备液,于-20 ℃避光保存;用水逐级稀释并配制质量浓度为1 mg/L的标准使用液;移取适量标准使用液,用水配制质量浓度为0.000 1~0.05 mg/L的系列标准溶液。
1.3 分析条件
在线SPE净化:ODS微柱(5 mm×2.1 mm, 5 μm,日本岛津公司);柱温:35 ℃;流动相:(A)0.015%(v/v)甲酸水溶液和(B)甲醇;流速:0.5 mL/min。梯度洗脱程序:0~0.5 min, 5%B; 0.5~2.0 min, 5%B~30%B; 2.0~3.0 min, 30%B; 3.0~3.5 min, 30%B~90%B; 3.5~5.0 min, 90%B; 5.0~5.5 min, 90%B~5%B; 5.5~14.0 min, 5%B。进样量:10.0 μL。
LC分离:XBridgeTMBEH C18柱(150 mm×3.0 mm, 2.5 μm,美国Waters公司);柱温:35 ℃;流动相:(A)水和(B)甲醇;流速:0.4 mL/min。梯度洗脱程序:0~4.0 min, 5%B; 4.0~6.5 min, 5%B~65%B; 6.5~10.0 min, 65%B; 10.0~10.5 min, 65%B~90%B; 10.5~12.0 min, 90%B; 12.0~12.5 min, 90%B~5%B; 12.5~14.0 min, 5%B。
六通阀流路切换见图1。状态1:0~2.05 min,上样后在线SPE柱净化,流路切换到废液槽;LC柱平衡。状态2:2.05~2.45 min,被测物洗脱并收集到200 μL定量环中;LC柱平衡。状态3:2.45 min之后,定量环中的洗脱液注入LC柱,开始LC-MS/MS分析;SPE柱冲洗并平衡等待下一个进样周期。

图 1 在线SPE-LC-MS/MS系统流路切换示意图Fig. 1 Diagram of the flow path switching in the online SPE-LC-MS/MS system
MS/MS检测:离子源为电喷雾电离源,负离子模式(ESI-);离子源接口电压为4.5 kV;雾化气为氮气,3.0 L/min;干燥气为氮气,10 L/min;加热气为空气,10 L/min;碰撞气为氩气;脱溶剂管温度为250 ℃;加热块温度为400 ℃;接口温度为250 ℃;多反应监测(MRM)模式,m/z917.4>205.1(定量离子对),m/z917.4>257.1(定性离子对),碰撞能量均为55 eV。
1.4 样品前处理
准确吸取0.40 mL尿液,置于2 mL聚丙烯离心管中,加入0.02 mL 10%甲酸水溶液、0.2 mL甲醇和1.0 mL乙腈,涡旋混匀1 min,以14 000 r/min离心2 min,上清液转移至10 mL聚丙烯离心管中,加入2.0 mL二氯甲烷,涡旋混匀0.1 min,以10 000 r/min离心2 min,上层水相供检测。
2 结果与讨论
2.1 前处理条件的优化
离线SPE柱多为一次性的,尿液可以直接上样[11,14-16]。在线SPE柱需要多次重复使用,尿液直接上样时,尿液中存在的蛋白质和无机盐可能沉积在柱头,多次进样后会使柱压升高,甚至堵塞色谱柱。本文采用乙腈沉淀蛋白质,实际样品分析时发现,部分尿液中盐含量较高,采用75%(v/v)乙腈-水沉淀蛋白质时,底部会出现约50 μL的水层,因鹅膏毒肽水溶性较强,造成分离失败。加入甲醇(0.2 mL)可以增加无机盐的溶解性,即使对于含盐量较高的尿液,提取时也不会出现少量的水层,使得蛋白质能沉淀完全,保证提取效率和结果的稳定性。采用乙腈-甲醇(5∶1, v/v)沉淀蛋白质和无机盐(有机相比例为75%(v/v)),可以保证在线SPE柱良好的分离效果,并提高使用寿命。
α-鹅膏毒肽极性强,易溶于水,而蛋白质沉淀后的提取液含有75%(v/v)的有机溶剂,高比例有机相进样时会导致被测物色谱峰展宽。文献[13-16]多采用氮吹等方法去除有机溶剂,耗时较长,不利于快速应对相关的中毒事件。反相液液微萃取技术可以从高比例有机相中分离少量的水相,以达到快速去除有机溶剂、浓缩水溶性被测物的目的[18,19]。传统液液萃取主要利用无机盐来分离水相和有机相,反相液液萃取的目的是要得到含被测物的水相,用于色谱分离,因此无机盐不适合作为两相分离的促进剂。疏水性强的氯仿或二氯甲烷被证明是反相萃取时有效的两相分离促进剂。本文采用毒性较低的二氯甲烷分离蛋白质沉淀后的尿液和有机相(乙腈和甲醇)。在4份提取液中分别加入1.0、1.5、2.0和2.5 mL二氯甲烷,结果表明,当二氯甲烷加入量≥2.0 mL时,能定量分离提取液中的水相和有机相,水相中α-鹅膏毒肽的提取效率大于95%。
沉淀蛋白质和反相液液微萃取去除有机相和脂溶性基质的简单操作,可以作为α-鹅膏毒肽在线SPE-LC-MS/MS法检测的快速且有效前处理方法。在实际应用中发现,尿液在线SPE柱400次进样后,柱效未见明显改变。
2.2 在线SPE分离条件选择
在线SPE分离除了实现高效的净化,还要保证洗脱液与后续LC-MS/MS进样分离的兼容性,关键是要保证较窄的SPE洗脱色谱峰,以满足后续200 μL定量环的收集容量,以及需要保证洗脱液中较低比例的有机相,以防止后续液相色谱分离时的峰展宽。实验中,将图1中色谱流动相流速设为0 mL/min, SPE模块按正常分析,将废液端直接连接到质谱仪,以监测在线SPE的分离效果。改变在线SPE洗脱梯度程序中2.0~3.0 min时甲醇的比例,使其分别为30%、35%和40%,结果见图2。按流速0.5 mL/min计算,甲醇比例为30%时,收集2.05~2.45 min的洗脱液正好满足定量环的收集容量,且此时有机相比例最低。

图 2 在线SPE洗脱梯度程序中2.0~3.0 min时流动相中 甲醇体积分数分别为30%、35%和40%时α-鹅膏毒肽的洗脱曲线 Fig. 2 Elution curves of α-amanitin with volume fractions of methanol of 30%, 35%, and 40% at 2.0-3.0 min in the online SPE elution gradient procedure
2.3 在线SPE与LC-MS/MS切换
在线SPE与LC-MS/MS的切换分为非定量环和定量环两种模式[20],非定量环的模式仪器配置简单,除杂后的SPE流路可以通过六通阀直接切换到LC-MS/MS分析流路,但SPE柱和LC柱间的压力差会影响分离的重复性。本文采用定量环模式,以定量环为接口,通过快速的阀切换,SPE和LC-MS/MS两个模块互相独立,无论是流动相还是压力,均不会互相干扰,保证了系统的稳定性。
2.4 在线与离线SPE净化效果的比较
根据在线SPE优化后的洗脱曲线(见图2, 30%甲醇),本文只收集2.05~2.45 min的洗脱液进入200 μL定量环,之前的水溶性基质和之后的脂溶性基质均切换至废液槽,从而实现精准净化的目的。在线SPE净化后,空白尿液和阳性尿液(0.53 μg/L)中α-鹅膏毒肽的色谱图见图3,基本未见干扰峰,且基线控制在较低水平。
根据文献[16]报道的离线SPE柱(HLB柱,60 mg/3 mL,美国Waters公司)净化方法操作,结果见图3c,其响应值低于在线净化的50%,且离线净化后的基线噪声太高,在0.5 μg/L这个水平很难分辨是否为α-鹅膏毒肽阳性。
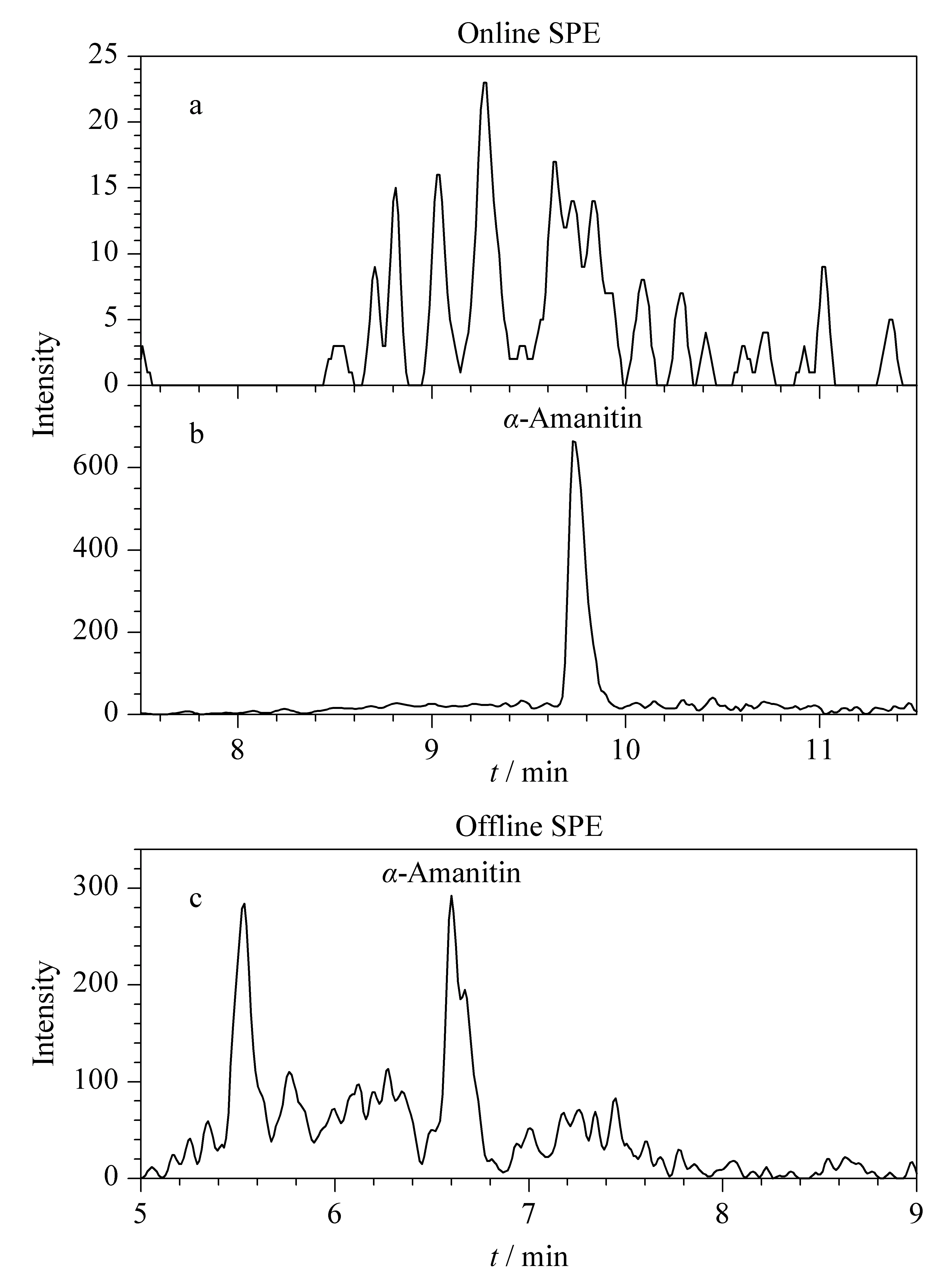
图 3 在线和离线SPE净化后尿液中α-鹅膏毒肽的色谱图Fig. 3 Chromatograms of α-amanitin cleaned by online SPE and offline SPE a. blank matrix; b. positive sample (0.53 μg/L); c. positive sample (0.53 μg/L).
2.5 质谱检测
如图4所示,α-鹅膏毒肽在ESI+模式下,除了m/z为919.4的[M+H]+峰,还存在高比例的m/z为941.4的[M+Na]+峰和m/z为957.4的[M+K]+峰,影响了质谱检测的灵敏度和稳定性。采用ESI-检测时,响应较高的为m/z为917.4的[M-H]-峰,其他峰的响应均较低。为实现尿液中α-鹅膏毒肽的高灵敏分析,本文采用ESI-模式,选择917.4>205.1为定量离子对,917.4>257.1为定性离子对,二级质谱碎裂途径和特征离子碎片见前期研究[21]。

图 4 α-鹅膏毒肽的全扫描质谱图和二级质谱图Fig. 4 Full scan mass and MS/MS spectra of α-amanitin
2.6 基质效应的考察
根据美国食品药品管理局(FDA)有关生物分析方法验证指南[22],本文考察了α-鹅膏毒肽在2个水平下6种尿液空白基质的基质效应,空白基质分别来自于正常男性和女性志愿者、非鹅膏毒肽类毒蘑菇中毒患者等,两个水平为0.1 μg/L和50 μg/L,分别平行测定6次。基质效应=样品基质中α-鹅膏毒肽的峰面积/纯溶剂中的峰面积×100%,大于或小于100%分别表示基质增强或基质抑制效应(见表1)。6种基质中的基质效应平均值为88.7%~96.5%,相对标准偏差(RSD)≤5.6%,采用本方法检测,尿液中α-鹅膏毒肽只表现为轻微的基质抑制效应。因此,可以直接采用纯溶剂标准溶液来校正样品中α-鹅膏毒肽的含量,简化操作流程。
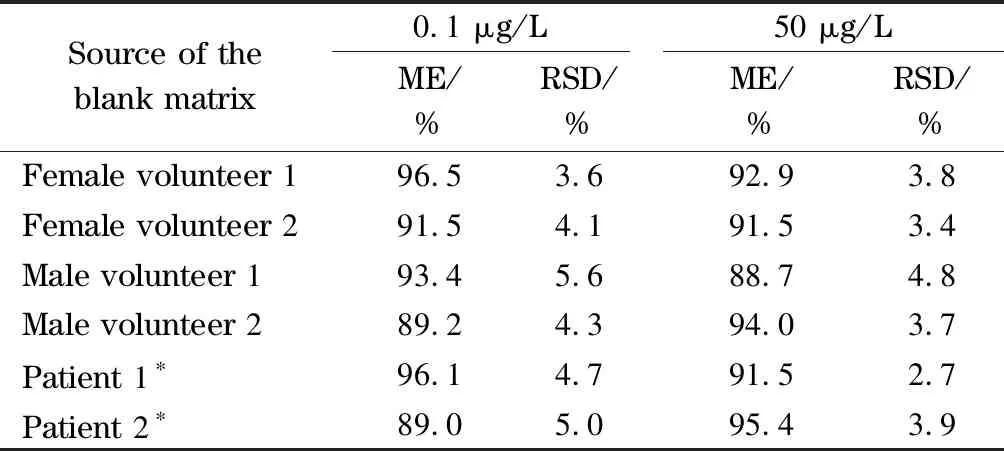
表 1 α-鹅膏毒肽在6种空白尿液中的基质效应(n=6)
2.7 方法学考察
2.7.1线性范围、检出限和定量限
尿液中α-鹅膏毒肽在0.1~50 μg/L范围内线性关系良好,相关系数(r2)为0.998 3。以3倍和10倍信噪比对应的含量定义为LOD和LOQ,结果分别为0.03 μg/L和0.1 μg/L。
2.7.2回收率
在空白尿液中添加3个水平(0.1、2和20 μg/L)的α-鹅膏毒肽,每个水平做6个平行试验,考察方法的回收率。结果表明,3个水平的平均回收率分别为84.3%、90.8%、和91.7%,相对标准偏差分别为7.2%、4.3%和3.8%。
2.7.3准确度和精密度
采用空白基质制备质量浓度分别为0.1 μg/L(LOQ)、0.2 μg/L(2倍LOQ)、2.0 μg/L(标准曲线中间点)和20 μg/L(标准曲线高浓度点)的质控样品,分别测定日内(n=6)和日间(连续3 d,n=3)准确度和精密度,结果见表2。尿液中α-鹅膏毒肽的日内准确度为85.1%~96.0%,精密度≤7.8%;日间准确度为82.9%~94.8%,精密度≤9.5%。

表 2 α-鹅膏毒肽的日内和日间准确度和精密度
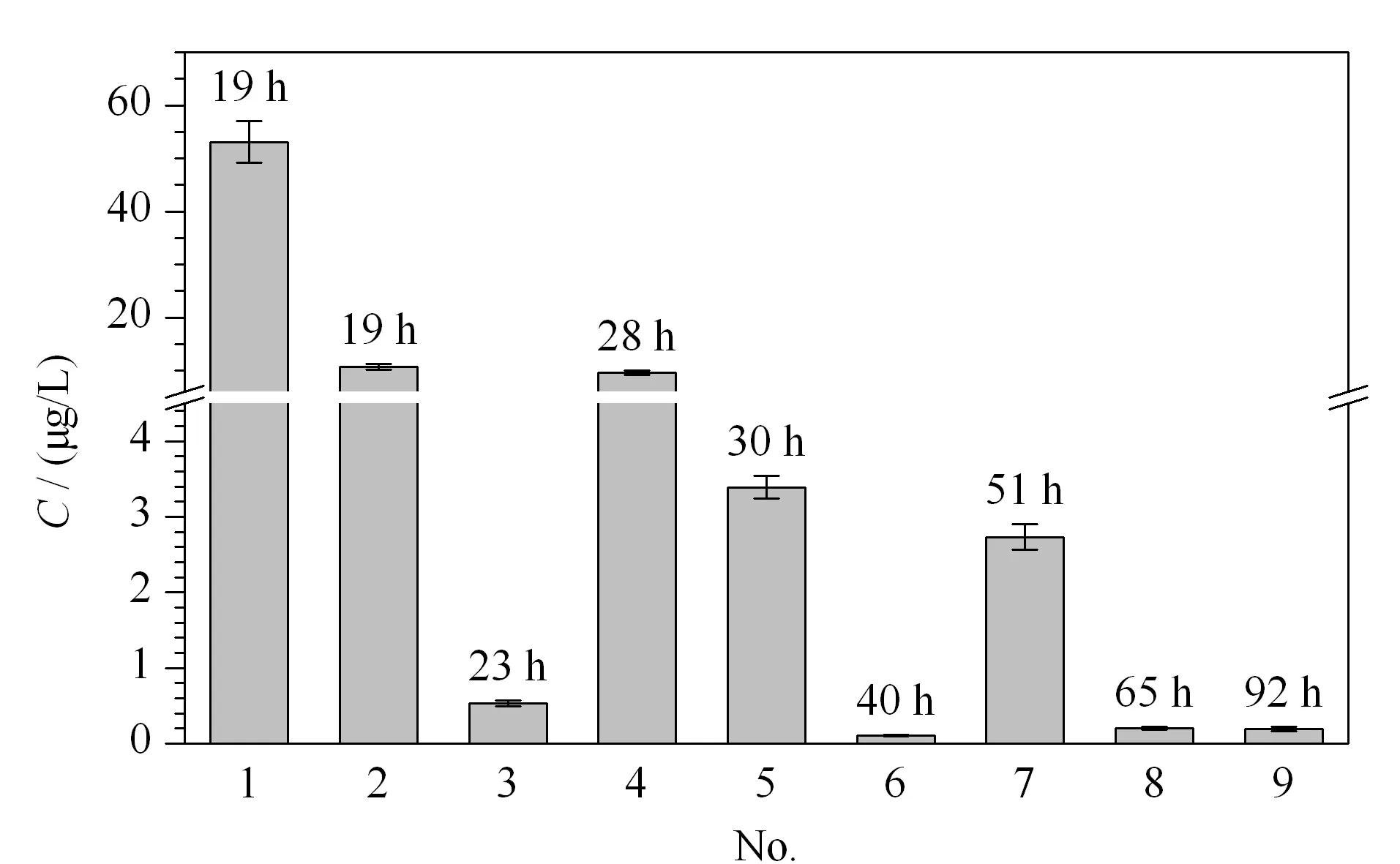
图 5 9名中毒患者尿液中α-鹅膏毒肽的含量(n=3)Fig. 5 Contents of α-amanitin in the urines of the nine poisoning patients (n=3)
2.8 实际样品检测
应用本方法,开展了多次误食毒蘑菇中毒事件的应急处置,在单纯胃肠炎或神经中毒症状的患者(非肝毒性中毒)尿液中均未检出α-鹅膏毒肽,说明方法具有很高的特异性。在9名肝毒性中毒症状的患者尿液中均检出了α-鹅膏毒肽(见图5),含量范围为0.11~53.1 μg/L,采样时间为中毒后19~92 h。对于毒蘑菇摄入量较高的中毒患者,中毒19 h后1名患者尿液中α-鹅膏毒肽含量为53.1 μg/L, 1名患者中毒51 h后的尿液中能检出2.73 μg/L的α-鹅膏毒肽,另1名患者中毒92 h后的尿液中能检出0.19 μg/L的α-鹅膏毒肽。而对于毒蘑菇摄入量较低的患者,中毒23 h后的尿液中α-鹅膏毒肽仅为0.53 μg/L。文献[11,13-17]报道的常规LC-MS/MS方法尿液中α-鹅膏毒肽的LOD为0.22~1 μg/L,尿液中检出毒素的时间窗口为中毒后72 h内[23],本文建立的在线SPE-LC-MS/MS的LOD可以达到0.03 μg/L,在实际中毒事件病因鉴定方面更具有优势,不仅可以检出中毒后92 h样品中α-鹅膏毒肽,而且0.1 μg/L的LOQ使得本方法在痕量毒素水平就能直接给出定量结果,为毒素体内剂量反应关系研究提供了强有力的定量检测技术支撑。
3 结论
本研究建立了在线SPE-LC-MS/MS联用技术检测蘑菇中毒患者尿液中痕量α-鹅膏毒肽的分析方法。溶剂沉淀蛋白质和反相液液微萃取去除有机相和脂溶性基质的简单操作,可以作为水溶性毒素在线SPE-LC-MS/MS检测时快速且有效的配套前处理方法。与文献方法相比,基于在线SPE精准净化技术,可以将尿液中α-鹅膏毒肽检测灵敏度提高10倍以上,解决了中毒时患者体内痕量水平α-鹅膏毒肽的定性确证难题,并将部分患者α-鹅膏毒肽中毒实验室鉴定的时间扩展到90 h以上。痕量水平的定量检测技术,可以为中毒后迅速代谢的α-鹅膏毒肽在体内的剂量反应关系研究提供可靠的技术支撑。