3D打印便携式凝胶电泳装置用于蛋白质的快速检测
李莹莹, 王丁一, 农骐郢, 刘丽红, 张 蒙,梁 勇,3, 胡立刚*, 何 滨, 江桂斌
(1. 江汉大学环境与健康研究院, 湖北 武汉 430056; 2. 中国科学院生态环境研究中心, 环境化学与生态毒理学国家重点实验室, 北京 100085; 3. 持久性有毒污染物环境与健康危害湖北省重点实验室, 湖北 武汉 430056)
快速、便携、经济型的现场检测是环境监测、污染治理和疾病预防与控制等的关键步骤。随着分析化学、仪器仪表学、材料科学、生物化学以及生物工程学等方面技术的进步,仪器的微型化受到越来越多的关注[1-4]。科学仪器的微型化,可以满足资源有限条件下进行快速检测的需求。在分析检测领域已经有多种开发完善的微型化仪器,如微型高速毛细管电泳仪[5-7]、微芯片临床生化分析仪[8-10]、微型离心免疫分析仪[11]和微型高效液相色谱等[12,13]。便携式分析仪器如移动酸碱度计、移动电化学检测和便携式光谱仪等也已被开发并投入市场使用。
目前,凝胶电泳(GE)技术是蛋白质研究中实现其有效分离的重要技术手段[14-16]。凝胶电泳技术以其分辨率高、重复性好和易操作等优点,被广泛地应用于分子生物学、生物化学、病理学和微生物学等学科的研究中[17-19]。例如之前研究[20]中设计的连续流动凝胶电泳与电感耦合等离子体质谱联用(GE-ICP-MS)的金属蛋白质在线分析系统,其在金属蛋白质的在线分离和检测方面表现出良好的性能。同时,凝胶电泳技术对于临床检测中蛋白质的分离检测具有重要意义。在资源少、实验室设备和技术专长有限的环境中,将简单、廉价和快速的制造用于诊断检测的设备,有助于节约资源,降低成本。至今,凝胶电泳系统均属于实验室内使用仪器,体积较大,不便于携带,无法用于蛋白质样品的现场检测以及户外使用。因此,开发稳定、便携式凝胶电泳系统对于现场检测中的蛋白质分析具有实际意义。
与传统制造工艺不同,3D打印加工更快速、准确,为低成本地加工复杂的系统提供了方便、可靠的方法。该技术的巨大优势使其在近几十年得到快速发展,并被应用于许多领域[21-31]。随着小型3D打印机的出现、打印材料种类的增加和相应成本的降低,3D打印逐渐被应用于更多的实验室,制造越来越多的满足分析化学和环境科学研究需求的定制设备[32,33]。例如,利用3D打印开发和加工微流体芯片和芯片实验室[34-38]。这些研究表明,3D打印在装置微型化的设计制造中具有广阔的应用空间。
本研究中开发了一种便携式凝胶电泳分析系统。所设计的便携式凝胶电泳装置主要在实验室内通过3D打印加工。通过对预染蛋白质相对分子质量标准的分离,证实此装置可在短时间内实现不同相对分子质量蛋白质的快速分离,并具有良好的分离性能。结合快速的蛋白质凝胶条带染色技术,展现了潜在的现场应用潜力。开发的便携式凝胶电泳装置由桌面3D打印机可在5 h内制作完成,材料总成本小于400元人民币。
1 实验部分
1.1 仪器、试剂与材料
碳酸酐酶(CA)、卵白蛋白(OVA)、牛血清白蛋白(BSA)、伴清蛋白(CB)、核糖核酸酶A(RA)、预染蛋白质相对分子质量标准(Precision Plus ProteinTMDual Color Standards)、三(2-羰基乙基)磷酸盐(TCEP)、十二烷基硫酸钠(SDS),N,N,N′,N′-四亚甲基二胺(TEMED)、过硫酸铵(APS)、磷酸盐缓冲液(PBS)购自美国Sigma-Aldrich公司。甘氨酸(glycine)、30%丙烯酰胺溶液(acrylamide)购自美国VWR国际有限公司。甘油购自美国Affymetrix公司。0.5 mol/L的三(羟甲基)氨基甲烷(Tris-HCl, pH 6.8)和1.5 mol/L的Tris-HCl(pH 8.8)购自美国Bio-rad公司。无水乙醇、乙二胺四乙酸(EDTA)购自国药集团化学试剂有限公司。One-Step BlueTM蛋白质凝胶染料购自美国Biotium公司。3D打印光固化树脂购自美国Formlabs公司。去离子水(18.2 MΩ·cm)由美国Millipore超纯水系统Milli-Q制备。所用试剂均为分析纯。
仪器:Mini-PROTEAN®Tetra凝胶电泳系统(Bio-rad公司,美国), Form2 3D打印机(Formlabs公司,美国),凝胶成像仪(UMAX PowerLook2100XL-USB,立广电脑), 25 V恒压锂电池(容量:2 000 mAh,浩博电子有限公司)。
溶液配制:CA、OVA、BSA、CB、RA蛋白质储备液(10 mg/mL)于-20 ℃避光储存;上样缓冲溶液:0.125 mol Tris(pH 6.8)+50%(v/v)甘油+8%(w/v)SDS+4%(v/v)β-巯基乙醇+0.04%(v/v)溴酚蓝;电泳缓冲溶液:25 mmol Tris(pH 8.3)+192 mmol glycine+0.1%(v/v)SDS;分离前,5种标准蛋白质混合样品(0.1 mg/mL)与上样缓冲溶液按照体积比1∶3混合,现配现用。
1.2 实验方法
1.2.1凝胶电泳装置的设计和制造
便携式凝胶电泳装置采用计算机辅助设计软件SolidWorks 2017 (Dassault Systemes SE,法国)进行设计。设计的主要组件包括凝胶电泳槽、凝胶管(板)。具体设计制造过程如下:凝胶电泳槽的尺寸最大为50 mm×20 mm×30 mm。凝胶管内径2.2 mm,外径4.0 mm,长30 mm。水平凝胶板长25 mm,宽7.5 mm,凝胶厚1.5 mm。加样孔宽4 mm,长1.5 mm。设计的凝胶电泳装置数字模型生成.stl格式的文件,并传输至PreForm软件(Formlabs公司)进行切片,在软件中对模型进行设置,选择合适的放置角度。设置打印参数:打印机选择form2,打印材料选择clear,打印精度0.1 mm;为防止影响模型使用,在参数设置中取消打印模型内部支撑的设置,保留外部支撑。在软件内完成参数设置后即可将模型传输至Form2 3D打印机开始打印。所有设计、打印时间均在10 h内完成,耗费材料均在10 mL以内。打印完成后,从打印平台去除模型,去除外部支撑,之后用无水乙醇对除去支撑后的模型进行清洗,防止多余的树脂材料残存。采用直径0.1 mm、长约4 cm的铂丝作为正、负极缓冲溶液槽的电极。
1.2.2电泳装置性能测试
首先采用预染蛋白质相对分子质量标准对不同设计的便携式凝胶电泳装置的分离性能进行测试。两种十二烷基磺酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)凝胶比例用于预染蛋白质相对分子质量标准的分离。凝胶比例1: 5 mm长度的浓缩胶浓度为4%, 15 mm长度的分离胶浓度为10%;凝胶比例2: 5 mm长度的浓缩胶浓度为4%, 15 mm长度的分离胶浓度为15%。不同浓度凝胶配方见表1。
观察两种凝胶比例对于蛋白质相对分子质量标准的分离效果,选择较好的一组进行不同浓缩胶和分离胶长度比例的分离效果比较,分离胶长度选择5、10、15、20 mm。为有效观测蛋白质条带,所有分离预染蛋白质相对分子质量标准上样量均为10 μL。选择其中分离性能最好的一组进行后续的5种标准蛋白质分离,与Mini-PROTEAN®Tetra凝胶电泳系统的分离效果进行对比。上述蛋白质分离实验均进行多次重复实验。

表 1 SDS-PAGE胶详细配方
柱状凝胶制胶方式:首先采用注射器将分离胶注入凝胶管内,然后在已注入分离胶的凝胶管内注入去离子水,待分离胶凝固,将去离子水吸出,之后注入浓缩胶,最后加入去离子水进行水封,待用。板状凝胶制胶方式:首先采用移液枪将分离胶注入凝胶板之间的空隙中,然后在已注入分离胶的凝胶板内注入去离子水,待分离胶凝固将去离子水吸出,之后注入浓缩胶,最后将梳子插入凝胶板,待用。制胶前,在所有凝胶管(板)外部标记灌胶高度,凝胶管(板)均用封口膜固定密封。
便携式凝胶电泳运行条件:恒压25 V至分离结束。
Mini-PROTEAN®Tetra凝胶电泳系统运行条件:60 V, 30 min; 100 V直至分离结束。
染色:5种标准蛋白质分离结束后,将凝胶从凝胶板上卸下。用One-Step BlueTM蛋白质凝胶染料(产品检出限:10~20 ng)对蛋白质条带进行染色。染色程序按产品说明书进行:将未固定的凝胶放入盛有25 mL One-Step BlueTM溶液的干净容器中,在摇床上常温孵育凝胶10~60 min,显色即可。
2 结果与讨论
2.1 装置设计和优化
在此前的工作中,我们已经采用3D打印开发了用于金属结合蛋白分离的凝胶电泳装置[20],验证了3D打印凝胶电泳装置的可行性,但是该装置体积大,不便于携带。我们借鉴之前研究中凝胶电泳装置的电泳槽结构,设计了一个微型化的水平凝胶电泳装置,用于现场对蛋白质进行快速分离。所设计的凝胶电泳装置主要由3部分组成:凝胶管(板)、凝胶电泳槽和电池。其中凝胶管(板)和凝胶电泳槽的主体通过实验室内的一台桌面级3D光固化打印机进行加工制造,整个制造过程可在短时间内完成,并能快速进行优化和改进。

图 1 电泳槽设计图及实物图Fig. 1 Design drawings and physical drawings of electrophoresis tanks a. Design A: double gel channel horizontal column electrophoresis tank; b. Design B: signal gel channel horizontal column electrophoresis tank; c. Design C: single gel channel horizontal column positive and negative electrophoresis tank; d. Design D: single gel channel horizontal slab positive and negative electrophoresis tank.
为使电泳装置结构更合理、使用更加方便,我们对电泳槽的几何结构和参数进行了多次测试和优化。我们首先设计了包含双凝胶通道(设计A,见图1a)和单凝胶通道(设计B,见图1b)两种结构的电泳槽。设计A与设计B均采用两种凝胶比例对标准蛋白质进行了分离,所用标准蛋白质为相对分子质量从10 kD到250 kD的商业化预染蛋白质相对分子质量标准,分离结果如图2a-d所示。设计A分离时间5 h,设计B分离时间2 h。同一设计在相同分离时间内,15%浓度分离胶未能将10、15、20 kD的蛋白质完全分离,且10%浓度凝胶的整体分离效果均优于15%浓度凝胶的整体分离效果,因此我们选择10%浓度的分离胶开展接下来的实验。分离相同蛋白质时,设计A所需时间明显长于设计B,可能是由于设计A采用双通道设计,分散了电流的强度,导致蛋白质在电场中移动减慢,分离时间增加。设计B虽然分离时间较短,但实验过程中易产生正、负极电泳缓冲溶液相互渗透的现象,所以结构需要进一步的优化。

图 2 水平凝胶电泳槽的性能Fig. 2 Performance of the horizontal gel electrophoresis tank a. Design A, concentrated gel: 4%, separating gel: 15%; b. Design A, concentrated gel: 4%, separating gel: 10%; c. Design B, concentrated gel: 4%, separating gel: 15%; d. Design B, concentrated gel: 4%, separating gel: 10%; e. Design C, concentrated gel: 4%, separating gel: 10%; f. Design D, concentrated gel: 4%, separating gel: 10%.
为此,我们将电泳槽结构改为正、负缓冲溶液槽分离的设计C(见图1c);采用设计C的电泳槽电泳缓冲溶液不会相互渗透,且其完全分离标准蛋白质的时间缩短至1.5 h左右(见图2e),与设计B相比分离时间缩短。然而在实验的过程中,柱状的凝胶不便于样品上样以及分离结束后对蛋白质条带进行染色。因此,我们在设计C的基础上,用平板凝胶代替柱状凝胶,并在凝胶板之上设置加样孔(宽4 mm,长1.5 mm),实现垂直加样,如图1d所示(设计D)。设计D完全分离标准蛋白质只需要1 h左右,从分离时间和分离之后蛋白质条带易于染色观察方面来看,设计D优于其他3种设计(见图2f),设计D的体积也最小,正、负极电泳缓冲溶液共需4 mL,在进行多个样品测试时可将设计D的多个电泳槽并联使用。
在优化电泳槽的结构之后,我们对凝胶的长度进行了优化。我们将多个设计D的电泳槽并联使用,分别装载不同长度的分离胶,同时对预染蛋白质相对分子质量标准进行分离测试,结果如图3所示。图3a的凝胶仅含10%浓度的分离胶,长度为20 mm;图3b-d的凝胶中含10%浓度分离胶和4%浓度浓缩胶,分离胶的长度分别为15、10和5 mm,浓缩胶长度均为5 mm。对比4种不同长度分离胶的分离结果,可以发现,使用长度为5 mm的分离胶即可将预染蛋白质相对分子质量标准完全分离,虽然各个蛋白质的条带较紧凑,但能够区分所有条带,且相对分子质量相差较大(如10、50、100 kD)的蛋白质之间的距离较大,足以满足便携式现场测试的需求,且整个分离时间最短只需要20 min。
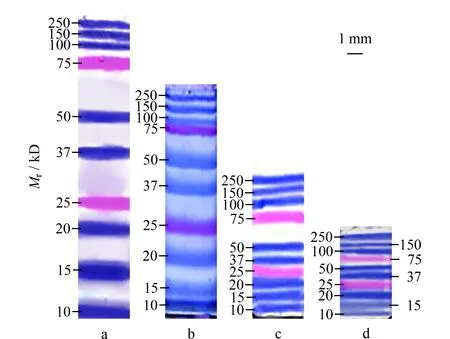
图 3 水平平板凝胶电泳采用不同长度10%分离胶分离蛋白质Fig. 3 Protein separation on a horizontal slab gel with 10% separation gel of different lengtha. 20 mm; b. 15 mm; c. 10 mm; d. 5 mm.
2.2 电源的优化
商业化凝胶电泳装置的电源尺寸较大,且需220 V交流电供电,无法便携式使用。锂电池尺寸较小,方便携带,且可根据需要对电压进行定制。因此,为了保证安全性,在本研究中我们采用固定工作电压为25 V的锂电池作为整个装置的电源。该锂电池整体尺寸为70 mm×60 mm×40 mm。在工作电压为25 V时,该锂电池可支持同时进行多个电泳槽并联使用,且可持续工作100 h。
2.3 装置性能的测试
实验室常用银染、荧光染色等方法使蛋白质条带显色。但这些方法使用试剂较多,步骤繁琐且耗时较长,无法方便地在户外进行应用。所以我们采用了一种更便捷的一步染色方法,使蛋白质条带显色。该方法只需要使用One-Step BlueTM蛋白质凝胶染料,将分离完成后的蛋白质凝胶浸没于染液中,即可对分离的蛋白质条带进行染色(染液对蛋白质进行10~60 min的染色,蛋白质条带可见即可停止染色)。使用该方法对商用平板凝胶电泳装置进行标准蛋白质分离染色后,分别采用凝胶成像仪和手机对染色的条带进行拍摄,结果如图4a、4b所示。两种不同拍摄方式得到的蛋白质条带均清晰可见,说明该染色方法不仅可以在实验室内用专用实验设备进行实验结果的保存,同时也可以在实验条件不便时用手机对实验结果进行保存,且成像效果相差无几。表明该方法可用于现场对蛋白质的分离结果进行观测。

图 4 One-Step BlueTM蛋白质显色效果以及标准蛋白质混合样品的分离应用Fig. 4 Effect of One-Step BlueTM protein staining and the application of mixed standard protein sample separation a. UMAX PowerLook2100XL-USB shooting; b. mobile phone shooting; c. 15 mm 10% separation gel with UMAX PowerLook2100XL-USB; d. 15 mm 10% separation gel with mobile phone. Standard proteins: carbonic anhydrase (CA), ovalbumin (OVA), bovine serum albumin (BSA), conalbumin (CB), ribonuclease A (RA).
根据之前的实验结果,5 mm凝胶长度适用于宽相对分子质量范围的蛋白质分离检测。对于13~76 kD的窄相对分子质量范围内的蛋白质,我们采用设计D,装配包含5 mm 4%浓度浓缩胶和15 mm 10%浓度分离胶的凝胶,对5种标准蛋白质混合溶液样品进行分析,蛋白质质量浓度0.1 mg/mL,上样量10 μL。其结果如图4c、4d所示,使用这种便携式的凝胶电泳装置,相对分子质量范围在13~76 kD的5种标准蛋白质可以在40 min左右分离完成,且染色结果清晰可见,表明此装置可有效地用于蛋白质的便携式现场分离和检测。
该便携式凝胶电泳装置与商业化常规平板凝胶电泳槽相比,后者所需电泳缓冲溶液约500 mL,分离不同相对分子质量蛋白质标准至少需要4 h。而该便携式凝胶电泳槽的尺寸仅为15 mm×20 mm×17 mm,需电泳缓冲溶液4 mL左右,分离时间40 min左右,能够更有效地应用于便携式检测的场景中。
3 结论
本研究设计加工了一种便携式凝胶电泳装置。该装置具有尺寸及容积小、电泳缓冲液用量少、分离快速、便携等特点,可用于蛋白质的现场分析和检测。值得注意的是,本系统可以多个电泳槽并联使用,同时分析更多样品。与商用平板凝胶电泳相比,本实验装置优势在于:(1)采用锂电池替代常规220 V电源,可用于户外检测;(2)分析相同的预染蛋白质所需时间更短,且分离效果相当;(3)作为核心分离单元的水平平板凝胶电泳装置主要采用3D打印技术制作,方便快捷,成本低廉。3D打印作为实验室研发手段,可基于数字化的原型将所研发的仪器组件进行快速修改和优化,并在实验室内部或实验室之间实现低成本、快速、精确的制造和复制,这也凸显了3D打印对于小型分析仪器开发的强大优势和应用前景。随着3D打印机精度、材料替代品的增加,越来越多的实验装置可通过3D打印技术实现微型化和便携化。