快速皂化-气相色谱-串联质谱法同时测定乳粉中胆固醇和维生素E 4种异构体
应 璐, 张书芬, 邢家溧,*, 李 杨, 王小宝, 毕晓丽, 周鑫达
(1. 宁波市食品检验检测研究院, 浙江 宁波 315048; 2. 宁波大学食品与药学学院, 浙江 宁波 315211)
胆固醇和生育酚都是人体所必需的重要营养元素,是乳粉中的重要质量指标。人体血液中的胆固醇浓度是高血脂症的重要评价指标之一[1],胆固醇参与人体代谢,是合成类固醇激素的原料,也是胆汁酸、激素和维生素D的前体[2,3]。维生素E(vitamin E, VE)又称生育酚,是一种人体必需的脂溶性维生素,对维持人体正常生理功能起重要作用,能提高机体免疫力和生育能力,也是人体内最重要的抗氧化剂[4-6]。维生素E包括生育酚和三烯生育酚两类8种化合物[7],其中生物效价较高的4种是α-生育酚、β-生育酚、γ-生育酚和δ-生育酚[8,9]。
目前,国家标准中用于检测食品中胆固醇和维生素E是两个不同的方法[10,11],且均需要经过传统的加热回流皂化、分液漏斗多次液液萃取、洗涤、浓缩,再用高效液相色谱或气相色谱法分离,而文献报道的关于维生素E或者胆固醇的方法[12-14]几乎也都是与国家标准相同的前处理方法。这些前处理方法过程复杂、耗时长,色谱法分离胆固醇的干扰较大。此外,严婉盈等[15]采用固相萃取(SPE)法测定胆固醇,但是该方法只能测定游离胆固醇而非总胆固醇[16],影响检测结果的准确性。鉴于乳粉基质成分复杂,该文献将SPE用于测定植物油的方法并不适用于乳粉的前处理。考虑到目前对于胆固醇和混合生育酚同时检测的方法报道甚少,本研究通过多次实验摸索了一套适用于各种乳粉中胆固醇和混合生育酚定性定量检测的方法,采用简易皂化萃取的前处理方法,用气相色谱-三重四极杆质谱联用仪在多反应监测模式(MRM)下定性和定量,相比简单的气相色谱、液相色谱及单级质谱更加准确。本研究将此快速法与国家标准方法[10,11]进行了比对,并将本方法应用于同时快速测定各种乳粉中胆固醇和4种生育酚的含量。
1 实验部分
1.1 仪器、试剂与材料
TSQ800Evo气相色谱-串联质谱仪(美国赛默飞世尔公司);万分之一天平(瑞士梅特勒-托利多集团); Milli-Q超纯水仪(美国Millipore公司); SW22恒温振荡水浴槽(德国优莱博公司); ST16离心机(美国赛默飞世尔公司); VORTEX 3涡旋混合仪(广州仪科实验技术有限公司)。
胆固醇标准品(纯度>97.2%,德国Dr. Ehrenstorfer); DL-α-生育酚标准品(纯度96.6%,曼哈格)、β-生育酚标准品(纯度99.08%, SUPELCO)、γ-生育酚标准品(纯度97.0%, SUPELCO)和δ-生育酚标准品(纯度93.0%, SUPELCO);氢氧化钾和磷酸二氢钾(分析纯,国药集团);正己烷(色谱纯,德国默克);脂肪酶(L1754-100 g, SIGMA),酶活为1 229 U/mg;所用水均为超纯水。
样品:随机购买市售的婴幼儿配方乳粉20种,低脂乳粉4种。
1.2 溶液配制
标准储备溶液:准确称取0.010 5 g胆固醇标准品,正己烷溶解并定容至10.00 mL,配制成1.00 g/L标准溶液,保存于-18 ℃冰箱中。分别准确称取0.010 4 gα-生育酚标准品,0.010 1 gβ-生育酚标准品、0.010 3 gγ-生育酚标准品、0.010 8 gδ-生育酚标准品,分别用无水乙醇溶解并定容至10 mL,分别得到1.00 g/L的α-生育酚、β-生育酚、γ-生育酚和δ-生育酚标准储备溶液,保存于-18 ℃冰箱中,备用。
混合标准中间液:量取适量的胆固醇、α-生育酚、β-生育酚、γ-生育酚和δ-生育酚标准储备溶液,配制成胆固醇含量为200 mg/L,α-生育酚、β-生育酚、γ-生育酚和δ-生育酚含量均为100 mg/L的混合标准中间液,备用。
标准系列工作溶液:由于加标回收率考察的含量和实际样品中的含量差距较大,因此,配制两个标准系列溶液,分别吸取混合标准中间液0.025、0.05、0.10、0.15、0.20、0.25、0.50、1.00、1.50、2.00、2.50 mL于10 mL棕色容量瓶中,正己烷定容至刻度,标准系列1中胆固醇的质量浓度为:0.5、1.0、2.0、3.0、4.0、5.0 mg/L,标准系列2中胆固醇的质量浓度为:5.0、10.0、20.0、30.0、40.0、50.0 mg/L,标准系列1中α-生育酚、β-生育酚、γ-生育酚和δ-生育酚的质量浓度均为0.25、0.50、1.00、1.50、2.00、2.50 mg/L,标准系列2中α-生育酚、β-生育酚、γ-生育酚和δ-生育酚的质量浓度均为2.5、5.0、10.0、15.0、20.0、25.0 mg/L。
400 g/L氢氧化钾溶液:称取20 g氢氧化钾于100 mL烧杯中,用20 mL水溶解,冷却后,加水定容至50 mL,储存于聚乙烯瓶中。
磷酸盐缓冲液(pH 8.0): 称取54.0 g磷酸二氢钾溶解于300 mL水中,用400 g/L氢氧化钾溶液调节pH至8.0,加水定容至500 mL。
1.3 样品前处理
1.3.1酶解和快速皂化
称取乳粉样品2.00 g于50 mL离心管中,加入5 mL温水溶解,加入0.2 g脂肪酶,5 mL磷酸盐缓冲液(pH 8.0),混匀后置于37 ℃振荡水浴中酶解4 h。取出后立即冷却,待冷却至室温后依次加入1 g碳酸钾、10 mL超纯水、10 mL无水乙醇,充分混合后于25 ℃水浴振荡10 min。
1.3.2萃取
加入5 mL正己烷充分涡旋萃取10 min, 4 000 r/min离心6 min,取上清液过0.22 μm有机膜,待测定。
1.4 气相色谱-质谱条件
色谱条件:色谱柱TG-5MS Sil(30 m×0.25 mm×0.25 μm),进样口温度280 ℃,程序升温,不分流模式进样,进样量1 μL,载气流速1.5 mL/min。
质谱条件:电子轰击电离源(EI),扫描方式为正离子扫描,MRM模式,离子源温度300 ℃,接口温度300 ℃。其他参数见表1。
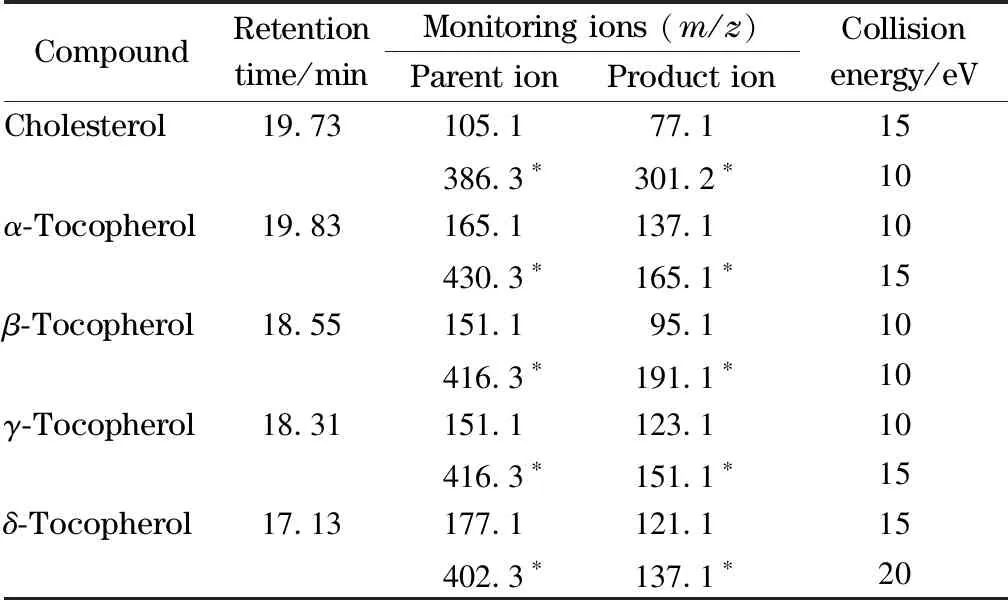
表 1 5种物质的保留时间、监测离子对和碰撞能量
2 结果与讨论
2.1 仪器条件的优化
2.1.1色谱条件的优化
参照严婉盈等[15]研究成果以TG-5MS Sil色谱柱分离,并通过改变升温程序,初始柱温150 ℃,保持1 min,然后以10 ℃/min升至280 ℃,保持12 min,最后20 ℃/min升至300 ℃,保持3 min,使得本研究的5种目标化合物得到较好的分离且峰形较好(见图1)。
2.1.2质谱条件的优化
通过将5种物质的标准品进行分离并全扫描,再与NIST谱库进行对照,可以得到5种物质的质谱图,每种物质选择了3~4种强度较高的特征离子,再通过仪器的AutoSRM功能,为每种物质优化选择出两对离子对及其对应的碰撞电压(见表1), 5种物质的定量离子提取图见图1。

图 1 5种物质的定量离子提取图Fig. 1 Quantitative ion extraction diagram of the five substances
2.2 前处理条件的优化
为了探究最优的前处理条件,先选定一个胆固醇和4种生育酚含量较低的脱脂乳粉样品作为空白基质,5种物质的加标含量均为2.0 mg/100 g,分别考察酶解时间、皂化温度、萃取溶剂的种类、溶剂体积以及萃取时间对回收率的影响,每个条件平行测定3次,以加标回收率为评价指标选出最优的前处理条件。
2.2.1酶解时间
考虑到胆固醇和生育酚都是脂溶性物质,脂肪酶酶解作为一种温和的酶解手段,可以将胆固醇和生育酚游离出来,并且避免了高温强碱环境。本研究固定条件:皂化温度25 ℃,水浴振荡,萃取溶剂及体积为正己烷5 mL,萃取时间为5 min,考察在37 ℃条件下酶解时间(2、4、12 h)对回收率的影响,乳粉中胆固醇和4种生育酚的回收率见图2。酶解4 h条件下乳粉中胆固醇和4种生育酚的回收率最高,达95.8%; 2 h和12 h乳粉中胆固醇和4种生育酚的回收率相差不大,均低于酶解4 h,其中酶解2 h回收率低可能是由于酶解时间短,乳粉未得到充分酶解,回收率偏低;酶解12 h回收率低,可能是因为酶解时间过长,导致待测组分损失[17],因此选择37 ℃下酶解4 h最佳。

图 2 酶解时间对乳粉中胆固醇和4种生育酚回收率的影响(n=3)Fig. 2 Effects of enzymatic hydrolysis time on the recoveries of cholesterol and the four tocopherols in milk powder (n=3) Saponification temperature: 25 ℃; extraction solvent and volume: n-hexane 5 mL; extraction time: 5 min.
2.2.2皂化温度
将在37 ℃酶解4 h后的样品按照1.3.1节加入试剂,分别在25、40、80 ℃下水浴振荡进行皂化,使用5 mL正己烷萃取5 min。由图3可看出,25 ℃水浴振荡的条件下回收率最高,皂化效果最佳,因此选择皂化温度为25 ℃。

图 3 皂化温度对乳粉中胆固醇和4种生育酚回收率的影响(n=3)Fig. 3 Effects of saponification temperature on the recoveries of cholesterol and the four tocopherols in milk powder (n=3) Enzymatic hydrolysis time: 4 h; extraction solvent and volume: n-hexane 5 mL; extraction time: 5 min.

图 4 萃取溶剂对乳粉中胆固醇和4种生育酚回收率的影响(n=3)Fig. 4 Effects of extraction solvent on the recoveries of cholesterol and the four tocopherols in milk powder (n=3) Enzymatic hydrolysis time: 4 h; saponification temperature: 25 ℃; extraction solvent volume: 5 mL; extraction time: 5 min.

图 5 萃取溶剂体积对乳粉中胆固醇和4种生育酚回收率的影响(n=3)Fig. 5 Effects of solvent volume on the recoveries of cholesterol and the four tocopherols in milk powder (n=3) Enzymatic hydrolysis time: 4 h; saponification temperature: 25 ℃; extraction solvent: n-hexane; extraction time: 5 min.
2.2.3萃取溶剂和溶剂体积
以胆固醇和4种生育酚的溶解性作为萃取溶剂选择的依据,在固定条件(酶解时间4 h,皂化温度25 ℃水浴振荡,萃取溶剂体积为5 mL,萃取时间5 min)下分别考察正己烷[18]、乙醚/石油醚(1︰1, v/v)[10]、乙酸乙酯[10]作为萃取溶剂对回收率的影响,结果见图4,可以看出乙酸乙酯的萃取效果最差,回收率最低至72.2%;乙醚/石油醚萃取效果优于乙酸乙酯,胆固醇和4种生育酚的回收率有所提高;正己烷萃取效果最佳,回收率高达95.5%。
进一步考察了萃取溶剂正己烷的体积对回收率的影响,在固定条件(酶解时间4 h,皂化温度25 ℃水浴振荡,萃取溶剂为正己烷,萃取时间5 min)下,考察了2、5、10 mL,结果见图5。萃取溶剂体积为5 mL和10 mL时的回收率显著高于2 mL,但萃取溶剂体积为5 mL和10 mL时的回收率结果无显著差异,考虑到实验成本和环境问题,故最终选择萃取溶剂的体积为5 mL。
2.2.4萃取时间
考察了溶剂萃取时间(5、10、15 min)对乳粉中胆固醇和4种生育酚回收率的影响,其他条件如下:酶解时间4 h、皂化温度25 ℃(水浴振荡)、萃取溶剂及体积为正己烷5 mL、萃取时间5 min。结果表明,萃取时间为10 min和15 min的回收率结果显著高于5 min,但萃取时间为10 min和15 min的回收率无显著差异,考虑到实验效率,选择萃取10 min为最优萃取时间。
2.3 方法学评价
2.3.1标准曲线与检出限
在优化条件下,对标准系列溶液进行测定,以标准溶液的质量浓度(x, mg/L)为横坐标,以相应的峰面积(y)为纵坐标,拟合线性方程得出相关系数(r2),其中胆固醇在0.5~50.0 mg/L,α-生育酚、β-生育酚、γ-生育酚、δ-生育酚在0.25~25.0 mg/L范围内具有较好的线性关系(见表2)。以最低加标结果推算10倍信噪比对应的含量为定量限,胆固醇的定量限为10.0 μg/100 g,4种生育酚的定量限均为5.0 μg/100 g。
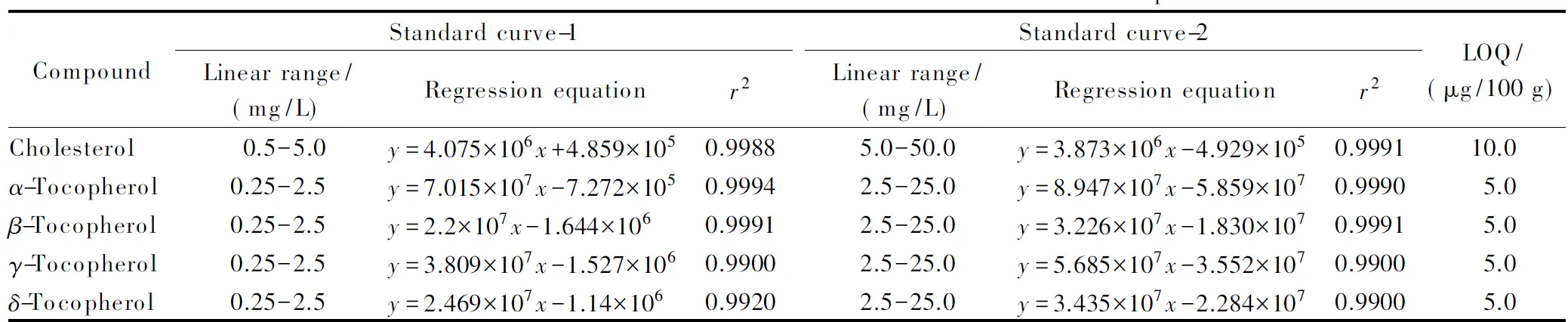
表 2 胆固醇和生育酚的校准曲线及相关系数

表 3 胆固醇和4种生育酚的加标回收率和相对标准偏差(n=6)
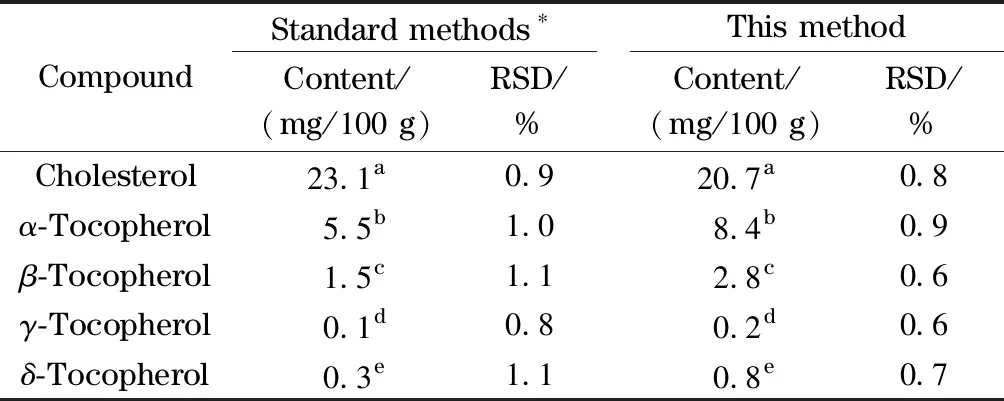
表 4 本研究方法与国标方法测得结果的比较(n=6)
2.3.2回收率与精密度试验
以脱脂乳粉为样品进行3个水平的加标试验,胆固醇加标含量分别为1.0 mg/100 g、5.0 mg/100 g、25.0 mg/100 g, 4种生育酚加标含量分别为0.1 mg/100 g、0.5 mg/100 g、2.5 mg/100 g,每一水平平行测定6次,计算方法的回收率和精密度,结果见表3。
2.4 本研究方法与标准方法的比较
考虑到加标回收率并不能完全反映该方法对实际样品的分解和萃取能力,尤其是本研究的5种物质皆为脂溶性物质,与脂肪密切结合,加标回收并不能真正验证酶解效果。为了考察本研究方法对实际乳粉样品的测试效果,选取一种婴幼儿乳粉样品,按照本文方法测试该乳粉中5种物质的含量,又按照国家标准GB 5009.82-2016《食品中维生素A、D、E的测定》第一法测定4种生育酚的含量,按照GB 5009.128-2016《食品中胆固醇的测定》第一法测定胆固醇含量,每一方法平行测定6次,结果见表4。
由表4可知,相较于国家标准方法,本研究方法测得的胆固醇含量略低,但其余4种生育酚的测定含量均比国家标准方法略高。经显著性分析,国家标准方法与本研究方法对该乳粉中胆固醇、4种生育酚含量的检测结果无显著性差异(p>0.05)。相较于国家标准方法前处理操作繁琐,且需要按照两种前处理方法分别测定胆固醇和4种生育酚,本研究开发的方法更加快速、简便,便于实际乳粉中胆固醇和4种生育酚的同时快速检测。
2.5 样品分析
为了解目前市售婴幼儿乳粉、其他低脂乳粉中胆固醇和4种生育酚的含量状况,利用上述所建立的分析方法,对20种婴幼儿配方奶粉及4种低脂乳粉中胆固醇和4种生育酚的含量进行了分析测试,检测结果见表5。
由表5可知,婴幼儿配方乳粉中胆固醇与4种生育酚的含量均高于低脂乳粉:婴幼儿乳粉中胆固醇含量最高可达81.4 mg/100 g,α-生育酚和β-生育酚的平均值分别是3.6 mg/100 g和2.0 mg/100 g,γ-生育酚和δ-生育酚含量均较低,平均值分别为0.26 mg/100 g和0.79 mg/100 g。

表 5 实际乳粉中胆固醇和4种生育酚的含量(n=3)
3 结论
现行胆固醇和4种生育酚的测定分别采用国家标准GB 5009.82-2016《食品中维生素A、D、E的测定》第一法和GB 5009.128-2016《食品中胆固醇的测定》。鉴于这2个标准的前处理方法过程复杂、耗费时间长,而且不能同时测定胆固醇和4种生育酚。本研究开发了一种前处理只需经过酶解、室温(25 ℃)皂化、直接萃取3个步骤,不需要转移和多次萃取,高效便捷,且可以批量处理样品,对胆固醇和4种生育酚可以同时测定的方法。本方法检出限、线性范围、回收率均能满足乳粉中胆固醇和4种生育酚的检测要求。