大豆发酵液的抗氧化活性
陈彬和,赵炳天,孙亚娟,李云兴*
1(合成与生物胶体教育部重点实验室(江南大学),江苏 无锡,214122)2(江南大学 化学与材料工程学院,江苏 无锡,214122)
大豆是我国一种重要的粮食作物,常被发酵制成豆瓣酱、腐乳、酱油等食品,发酵能够通过提高活性物的浓度来提升大豆的抗氧化活性。大豆中含有许多抗氧化物质,例如酚酸、黄酮以及类黄酮等多酚类化合物[1],许多研究表明,发酵提高了大豆多酚的提取浓度,同时,其还原能力以及清除自由基的能力也得到提高[2-5]。发酵能够将大分子蛋白分解为末端氨基酸残基具有抗氧化活性的小分子多肽[6],李慧娟等[7]报道,对大豆进行发酵提高了小分子多肽的产量,同样,其清除自由基的能力得到提高。许多疾病的发生都是由于机体内的氧化和抗氧化水平失衡[8-9],发酵的大豆能够通过提升抗氧化水平来预防心血管疾病和保护肠道健康。研究表明,通过给小鼠喂食发酵的大豆能够提高超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)等抗氧化酶的活性和抑制脂质过氧化,同时肥胖小鼠的血脂含量下降[10-11]。另外,发酵的大豆可以通过抑制氧化损伤来保护小鼠的肠道[12]。
大豆发酵的抗氧化研究主要是其在食用方面带来的价值,而对其通过抗氧化方式来保护皮肤的研究较少。角质细胞位于皮肤的最外层,可以阻挡外界刺激对皮肤的侵害。紫外照射、有毒的化学物质等能通过活性氧(reactive oxygen species, ROS)来损伤角质细胞,因此为角质细胞提供抗氧化保护有利于维持皮肤健康。该研究利用枯草芽孢杆菌制备了大豆发酵液(soybean fermentation broth,S-FB),并探讨了其在人永生化角质形成细胞(human immortalized keratinocytes,HaCaT)内的抗氧化作用,以明确其对于保护皮肤健康的意义。
1 材料与方法
1.1 材料与试剂
大豆,无锡欧尚超市;枯草芽孢杆菌,江南大学生物活性物发酵制备实验室提供;2,2′-联氨双-(3-乙基苯并噻唑啉-6-磺酸)[2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid,ABTS)],上海阿拉丁生化科技股份有限公司;HaCaT细胞,北京北纳生物科技有限公司;2′,7′-二氯荧光黄双乙酸盐(2′,7′-dichlorodihydrofluorescein diacetate, DCFH-DA)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide, MTT),美国Sigma公司;2,2′-偶氮二异丁基脒二盐酸盐(2,2′-azobis(2-amidinopropane) dihydrochloride, ABAP),百灵威科技公司;辣根过氧化物酶标记山羊抗小鼠IgG、ECL化学发光试剂、SOD和CAT酶活力检测试剂盒,碧云天生物技术研究所;核因子E2相关因子2 (nuclear factor erythroid-2-related factor 2, Nrf2),圣克鲁斯生物技术上海有限公司。
1.2 仪器与设备
Tecan Infinite 200 Pro型多功能酶标仪,瑞士Tecan公司;Synergy H4型多功能酶标仪,美国伯腾仪器有限公司;TU-1901型双光束紫外分光光度计,北京普析通用仪器有限责任公司;FE20型pH计,上海梅特勒-托利多仪器有限公司;DDS-307型电导率仪,上海雷磁仪器有限公司;DYCZ-24KS型双板垂直电泳仪、DYCZ-40K型转印电泳仪、DYY-5D型电脑三恒多用电泳仪,北京六一生物科技有限公司。
1.3 实验方法
1.3.1 S-FB的制备及处理
将大豆浸泡过夜,按照质量比1∶7的比例与去离子水混合并打碎制成大豆匀浆,取10 g匀浆加入39.5 g水,灭菌20 min,得到大豆培养基。冷却后接入0.5 mL OD600 nm为0.2的枯草芽孢杆菌悬浮液,并于37 ℃振荡培养箱中发酵72 h。将发酵前和发酵后的大豆培养基分别用220 nm的微孔滤膜进行过滤,去除菌和大豆残渣,最终得到S-FB和未发酵的大豆提取液(soybean extract,SE)。
1.3.2 ABTS阳离子自由基清除能力法测试抗氧化活性
制备2.45 mmol/L过硫酸钾溶液,然后取7.7 mg ABTS溶解于2 mL过硫酸钾溶液中。16 h后,将其稀释成734 nm处吸光度为0.9的ABTS工作液。分别移取50 μL SE和S-FB于96孔板中,然后加入150 μL ABTS工作液,反应10 min后测其在734 nm处吸光度As。以蒸馏水代替样品作为对照组,测得其吸光度为Ac。ABTS阳离子自由基的清除率计算如公式(1)所示:
(1)
1.3.3 总酚含量的检测
采用普鲁士蓝法检测SE和S-FB中的总酚含量[13]。取1 mL样品,并依次加入0.2 mL的0.008 mol/L铁氰化钾溶液、0.100 mol/L FeCl3溶液和0.100 mol/L 盐酸溶液,均匀混合后于室温下反应15 min。最后用水稀释至10 mL,于730 nm的波长下检测溶液的吸光度。以没食子酸酯为标准品进行测试,得到二项方程Y=-3.485 5X2+1.897 3X+0.008 0,R2=0.999 3。样品中的总酚含量通过该方程计算得到。
1.3.4 总肽含量的检测
采用双缩脲法分别对S-FB和SE中的总肽含量进行检测。先分别配制双缩脲试剂A (0.10 g/mL的NaOH溶液)和双缩脲试剂B (0.01 g/mL的CuSO4溶液)。将样品与100 g/L三氯乙酸以1∶1的质量比混合,30 min后过滤。取1 mL滤液,并依次加入2 mL双缩脲试剂A和2 mL双缩脲试剂B。接着于室温下反应15 min,在540 nm波长下检测吸光度。以牛血清白蛋白为标准品进行测试,并得到线性方程Y=0.356 7X+0.007 6,R2=0.997。样品中的总肽含量通过该方程计算得到。
1.3.5 细胞内ROS水平的检测
利用荧光探针DCFH-DA来检测HaCaT细胞内的ROS。按照2×104/孔的密度接种细胞。细胞与样品培养结束后,加入20 μmol/L荧光探针DCFH-DA溶液,在培养箱中孵育30 min,加入0.6 mmol/L的ABAP溶液,于荧光酶标仪中进行0~60 min的动力学检测,发射波长485 nm,激发波长535 nm。
1.3.6 S-FB对细胞内ROS水平的影响
HaCaT细胞分别与体积分数为0%、5%、10%和20%的S-FB培养12 h,然后按照1.3.5小节的方法检测ROS。
HaCaT细胞与400 μmol/L H2O2培养2 h,然后去除培养液,并在细胞中分别加入体积分数为5%、10%和20%的S-FB,继续培养2 h。设置2组细胞分别与400 μmol/L的H2O2和体积分数为5%的S-FB培养2 h,未处理细胞作为对照组。最后按照1.3.5小节的方法检测细胞内的ROS水平。
1.3.7 免疫印迹法测定Nrf2的表达
将HaCaT细胞与体积分数5% S-FB分别进行0、12、24、36和48 h的培养,每隔12 h给细胞换新鲜的培养液。然后除去培养基并用裂解液提取细胞内蛋白。收集裂解液并于10 000 r/min下离心8 min,保留上清液。将提取的蛋白加热变性,然后在Tris-甘氨酸电泳缓冲液中进行十二烷基硫酸钠—聚丙烯酰胺凝胶电泳使蛋白分离。在同样的缓冲液中对蛋白进行90 min的转印电泳,使蛋白转移到聚偏二氟乙烯膜上,转印完毕的膜在50 g/L脱脂奶粉中封闭1 h,并用TBST缓冲液洗涤,然后与一抗(Nrf2或β-actin)于4 ℃过夜孵育,再次洗涤,继续与二抗(辣根过氧化物酶标记山羊抗小鼠IgG)室温孵育1 h。用ECL化学发光试剂使蛋白条带显色,用Image Lab软件对条带的灰度值进行定量。
1.3.8 S-FB对细胞内SOD和CAT酶活力的影响
SOD和CAT酶活力:按照SOD和CAT酶活力检测试剂盒对1.3.7小节提取的蛋白进行检测。
紫外线B (ultraviolet radiation B, UVB)损伤测试:体积分数为5%的S-FB分别处理HaCaT细胞0、36和48 h,然后用365 μW/cm2的UVB照射细胞5 min,于培养箱中继续培养2 h,然后每孔加入100 μL 0.5 g/mL的MTT溶液,4 h后用二甲基亚砜溶解生成的甲臜,最后用酶标仪在490 nm下检测吸光度。
1.3.9 统计学分析
数据均由平行测试得到,以平均值±标准差表示。显著性差异通过GraphPad prism7的ANOVA-Tukey计算得到。P<0.05表示结果具有显著性差异。
2 结果与分析
2.1 S-FB的ABTS阳离子自由基清除能力
大豆中含有丰富的蛋白质和多酚类化合物,在发酵过程中,微生物产生的酶能提高大豆多肽的产量,并且促进大豆中多酚化合物释放。如表1所示,S-FB和SE中的总酚质量浓度分别为0.89和0.31 g/L,总肽质量浓度分别为2.30和0.70 g/L。S-FB的总酚和总肽含量比SE分别提高了187%和229%。多酚和大豆多肽通常具有抗氧化活性。ABTS阳离子是一种能够相对稳定存在于水溶液中的自由基,其可以通过电子转移被清除。由于不易受外界因素干扰,ABTS阳离子自由基清除能力能够较为准确地体现样品的抗氧化活性。如图1显示,体积分数为1%、2%、5%和10% S-FB对ABTS阳离子自由基的清除效果为(30.31±0.49)%、(49.48±0.53)%、(78.24±0.55)%和(93.88±0.13)%,都高于对应体积分数的SE清除效果〔(6.00±1.39)%、(11.13±0.57)%、(20.40±0.35)%和(33.49±1.07)%〕,其中1% S-FB对ABTS阳离子自由基的清除效果接近10% SE。因此,发酵可以提高S-FB中的多酚和多肽含量,使其具有优异的抗氧化活性。

表1 S-FB和SE中的总酚和总肽含量(n=3) 单位:g/LTable 1 Contents of total polyphenols and total peptides in S-FB and SE (n=3)
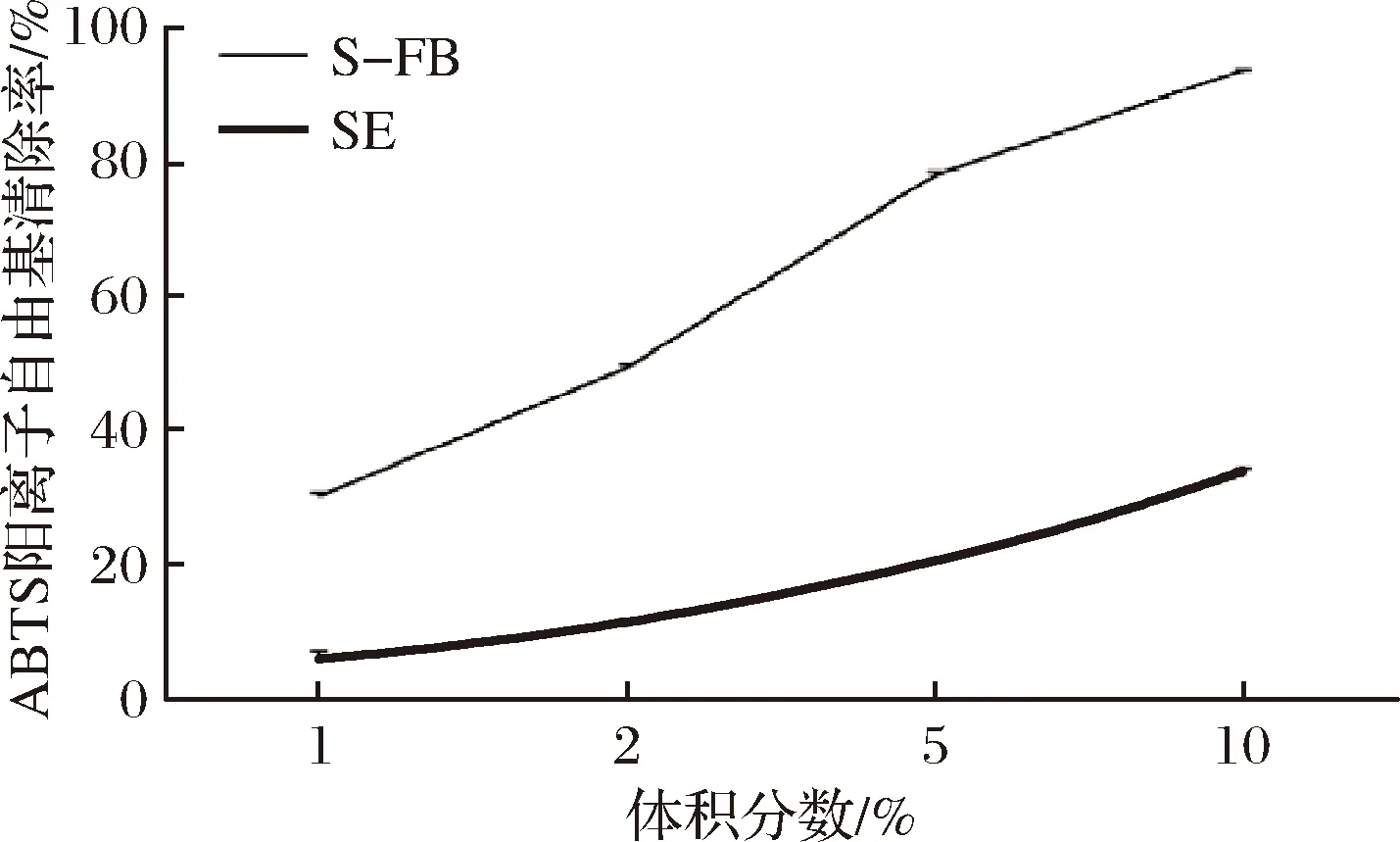
图1 S-FB和SE的ABTS阳离子自由基清除能力(n=3)Fig.1 ABTS cation radicalscavenging activity of S-FB and SE (n=3)
2.2 S-FB对细胞内ROS水平的影响
研究了S-FB对HaCaT细胞内ROS的影响来表明其抗氧化作用。为了排除渗透压和pH值对测定结果的干扰,检测了S-FB的电导率和pH值。细胞培养基,即杜氏改良Eagle培养基(Dulbecco’s modified Eagle medium,DMEM),其电导率超出仪器量程,由表2可知,0%、5%、10%和20% S-FB (双重蒸馏水配制)的电导率分别为2.59、142.20、317.00和693.00 μS/cm,相比DMEM,S-FB体积分数变化导致的电导率差异可忽略。另外,0%、5%、10%和20% S-FB的pH值在7.2~7.5范围内(DMEM配制),S-FB对pH的影响较小。因此可以忽略渗透压和pH对S-FB的影响。
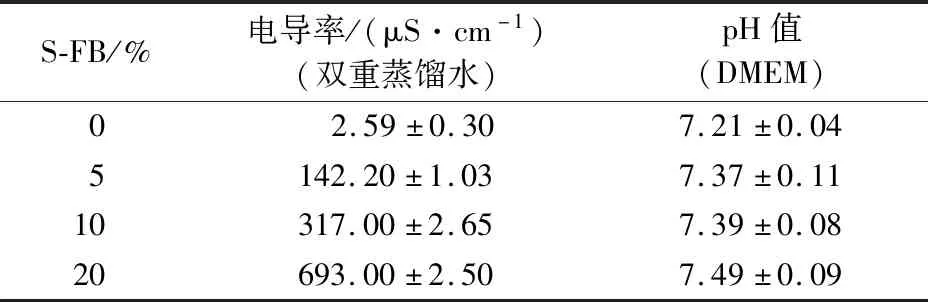
表2 S-FB的电导率和pH值(n=3)Table 2 Conductivity and pH value of S-FB (n=3)
图2-a为HaCaT细胞与S-FB培养12 h后的ROS水平。由图可知,5%、10%和20% S-FB分别处理12 h后,细胞内的ROS水平提高,且ROS随着S-FB体积分数的增加而增加。抗氧化剂能够诱导ROS的生成,另有报道表明抗氧化剂能够清除细胞在氧化应激中生成的ROS[14-16]。QIN等[17]提出抗氧化剂对ROS的清除作用在ROS高水平的细胞中更优异。因此,本实验中S-FB提高HaCaT细胞内ROS可能是由于该细胞本身的ROS水平较低所致。于是用H2O2来诱导ROS,并探讨S-FB对该细胞内ROS的影响。如图2-b所示,H2O2在细胞内提高了ROS水平,该效果接近5% S-FB对细胞内ROS的影响,H2O2+5% S-FB、H2O2+10% S-FB和H2O2+20% S-FB (先用H2O2刺激细胞,再用S-FB培养细胞)导致的细胞内ROS水平均低于H2O2。结果表明,S-FB能够清除H2O2诱导的ROS。另外,5%、10%和20% S-FB对ROS的诱导作用依次增强,而H2O2+S-FB (5%、10%和20%)导致的ROS水平都低于5% S-FB,表明H2O2提高细胞的ROS水平后,S-FB诱导ROS的作用减弱。因此,S-FB对ROS的影响与HaCaT细胞的ROS水平(S-FB处理前)有关,其清除ROS的效果在ROS水平高的细胞中更加显著,同时诱导ROS的作用减弱。因此,S-FB能够通过降低细胞的氧化应激反应来保护细胞。
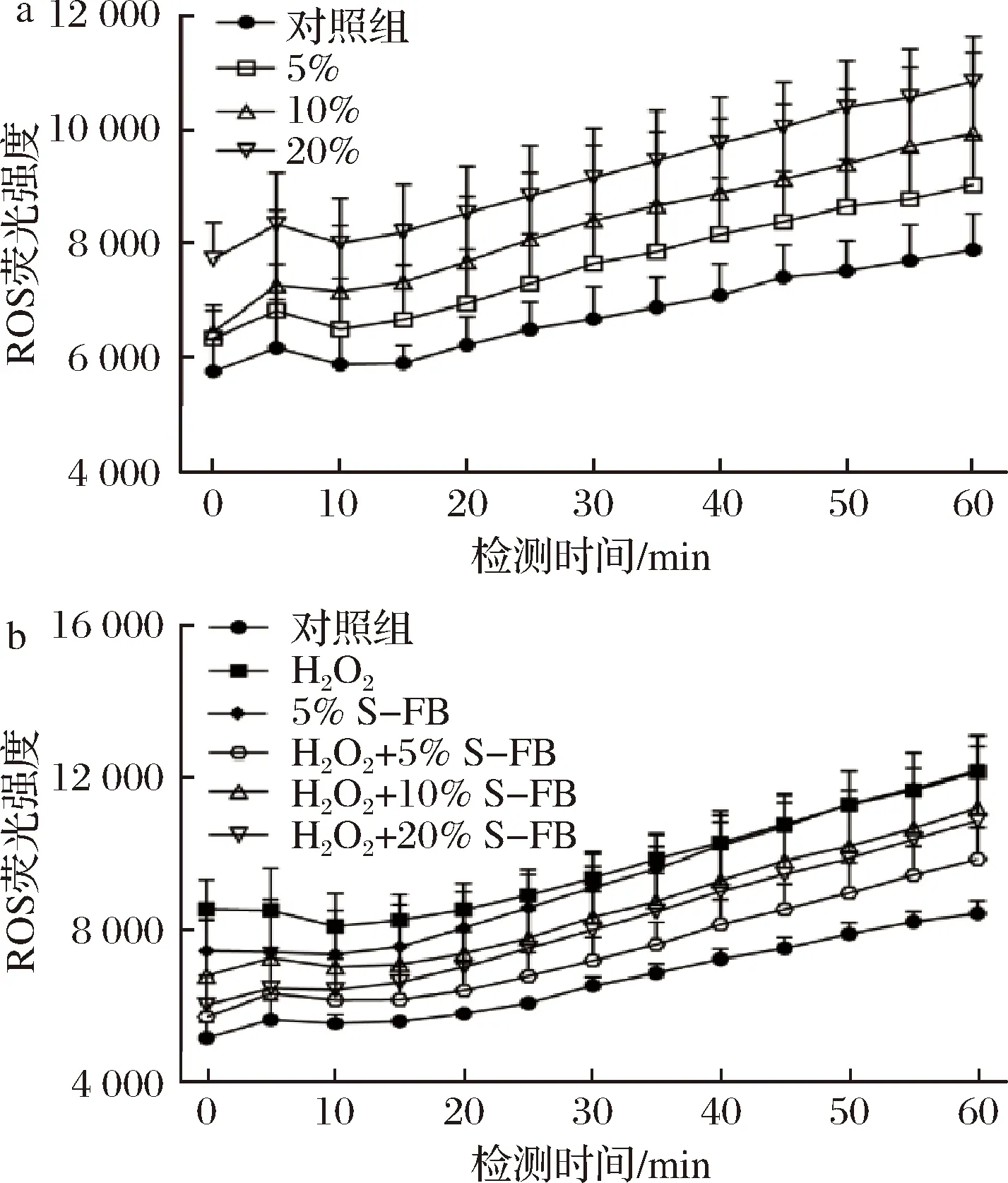
a-未添加H2O2; b-添加H2O2图2 S-FB对HaCaT细胞内ROS水平的影响(n=6)Fig.2 The effect of S-FB on the intracellular ROS level in HaCaT cells (n=6)
2.3 S-FB对细胞内Nrf2水平的影响
Nrf2即核因子E2相关因子2,是抗氧化通路中的关键转录因子,其通过调控抗氧化基因的表达来控制抗氧化酶的合成,从而对细胞内的氧化还原状态进行调节[18-19],Nrf2的表达量关系着细胞的抗氧化能力。由图3可知,5% S-FB分别处理12、24、36和48 h后,细胞内的Nrf2蛋白的相对含量分别为1.85、2.04、2.64和2.65。
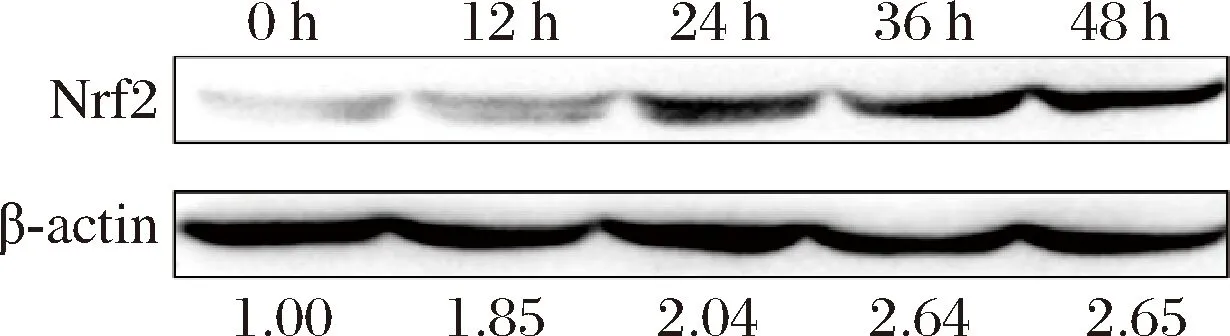
图3 S-FB对HaCaT细胞内Nrf2的影响Fig.3 The effect of S-FB on the intracellular Nrf2 in HaCaT cells
结果表明,S-FB上调了HaCaT细胞中的Nrf2水平,因此,S-FB能够通过激活细胞的Nrf2相关抗氧化通路来发挥抗氧化作用并保护HaCaT细胞。
2.4 S-FB对细胞的SOD和CAT酶活力以及抗氧化能力的影响
抗氧化酶的增加能够提高细胞的抗氧化能力[20-21]。
图4-a和4-b分别是细胞与5% S-FB培养后的SOD和CAT酶活力。常规HaCaT细胞的SOD和CAT酶活力分别为8.16和13.19 U/mg。S-FB分别处理12、24、36和48 h后,SOD酶活力分别为7.82、5.91、10.81和10.78 U/mg,CAT酶活力分别为13.19、11.35、16.34和16.05 U/mg。细胞与5% S-FB分别培养36和48 h后,其SOD酶活力相比常规HaCaT细胞分别提高了32.5%和32.1%,CAT酶活力分别提高了19.6%和17.5%。细胞的抗氧化酶活力提高后,进一步检验了其抗氧化能力。UVB能够诱导ROS生成,并造成细胞氧化损伤。如图4-c所示,5% S-FB分别处理36和48 h的细胞在UVB损伤中的存活率都是常规HaCaT细胞的1.3倍。因此,S-FB能够增强HaCaT细胞的SOD和CAT酶活力,并提升了其抗氧化能力。
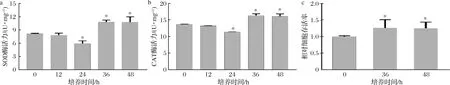
图4 S-FB对HaCaT细胞的SOD和CAT酶活力以及抗氧化能力的影响(n=3)Fig.4 The effect of S-FB on SOD and CAT activities and the antioxidant capacity in HaCaT cells (n=3)注:*代表差异显著(P<0.05)
3 结论
以上结果表明,发酵提高了S-FB中的总酚和总肽含量,并且增强了其对ABTS阳离子自由基的清除能力。通过研究S-FB在HaCaT细胞中的抗氧化作用得到其能够降低细胞的氧化应激反应,还可以激活Nrf2抗氧化通路并提高细胞的抗氧化能力。因此,S-FB具有良好的抗氧化效果,同时能以抗氧化的方式来保护HaCaT细胞。
HaCaT细胞本身的ROS水平较低,当氧化刺激提高其ROS水平时,S-FB能够清除增加的ROS,但S-FB在正常HaCaT细胞内会诱导ROS生成。菌株影响着发酵液的活性成分,下一步工作希望通过筛选菌株来制备抗氧化性能优异但ROS诱导作用减弱的发酵液。

