脱酰胺对玉米醇溶蛋白乳化特性和结构的影响
董世荣,王丽,高昂,徐微
1(哈尔滨学院 食品工程学院食品系,黑龙江 哈尔滨,150086)2(济南市第二药品不良反应监测中心,山东 济南,271100)
乳液在食品、化妆品、生物技术和医药产品等领域有着广泛地应用[1],其是2种互不相容液体(一般为油和水)组成的非均相分散体系,一种液体以细液滴形式均匀地分散在另一种液体中,它们在热力学上是不稳定的,乳化液很容易发生絮凝、乳脂化、沉降、聚结、相转化等[2]。通过添加乳化剂,在均质化过程中,乳化剂吸附在液滴表面而降低界面张力,进而改善乳液的稳定性[1]。近年来,天然高分子材料如蛋白质、多糖、磷脂常作为乳化剂应用到食品领域。
玉米醇溶蛋白是一种从玉米粉中分离出的植物蛋白质,因具有良好的生物降解性、环保、无毒、成膜性、可食用性等优点而被作为一种有价值的食品原料[3]。玉米醇溶蛋白具有特殊的氨基酸组成和结构特点,含有超过50%的非极性氨基酸而具有较强的疏水性[4],因此不易溶于水而易分散在50%~90%的乙醇-水溶液中。MATSUSHIMA等[5]提出玉米醇溶蛋白是1个13 nm×1.2 nm×3 nm的棱镜模型,该模型中含有9~10个以反平行方式排列的螺旋段,螺旋两端由富含谷氨酰胺的桥连接。基于此模型,螺旋外表面形成的棱柱体的侧面是疏水的,而富含谷氨酰胺的棱柱体的上下表面是亲水的,因此玉米醇溶蛋白属于双亲性蛋白质[6],但是由于玉米醇溶蛋白的刚性太强,不能作为良好的乳化剂使用。
为了改善玉米醇溶蛋白的刚性结构,很多研究人员采用了碱、酶、热处理、复合等方式修饰玉米醇溶蛋白。张京京等[7]利用碱性蛋白酶修饰玉米醇溶蛋白,改善了玉米醇溶蛋白的乳化性。赵城彬等探究了葡聚糖接枝作用对玉米醇溶蛋白乳化性的影响,结果发现接枝反应能够提高玉米醇溶蛋白的乳化活性和乳化稳定性[8]。CABRA等利用碱对玉米醇溶蛋白进行脱酰胺修饰,发现玉米醇溶蛋白的乳化稳定性从(18±0.7)%增加至(80±4.7)%[9]。李丹等研究发现脱酰胺的乳清分离蛋白的乳化稳定性比未脱酰胺乳化稳定性高[10]。SELLING等在25~70 ℃条件下热处理玉米醇溶蛋白,发现70 ℃加热15 min可以改变玉米醇溶蛋白的初级结构[11]。柔性是决定蛋白质功能性质的重要因素之一,分子柔性实质上反应了蛋白质构象的运动性,而功能性质如乳化性质与蛋白质构象的运动性密切相关[12]。这些研究说明了采用碱、热等方式可以改变玉米醇溶蛋白的结构和乳化特性,而且碱修饰使得玉米醇溶蛋白发生脱酰胺反应,从而改善玉米醇溶蛋白的乳化性。但是脱酰胺度对乳化性影响规律,以及脱酰胺度对玉米醇溶蛋白构象的影响并没有系统的研究报道。因此,本研究在碱-水介质环境中利用碱对玉米醇溶蛋白进行脱酰胺,通过控制加热时间调节脱酰胺度,研究脱酰胺度与玉米醇溶蛋白乳化稳定性和乳化活性的变化规律,同时分析了脱酰胺的玉米醇溶蛋白分子构象、柔性的变化,以期为开发玉米醇溶蛋白天然乳化剂提供理论参考。
1 材料与方法
1.1 材料与仪器
Z3625型玉米醇溶蛋白、胰蛋白酶、十二烷基磺酸钠,美国Sigma公司;大豆油,九三集团;其他试剂均为国产分析纯。
T6紫外可见分光光度计,北京普析通用仪器有限责任公司;F-4500荧光分光光度计,日本日立公司;UV-2550 紫外可见光分光光度计,日本岛津公司;FSH-2A可调高速匀浆机,常州金坛精达仪器制造有限公司。
1.2 实验方法
1.2.1 样品的制备
将玉米醇溶蛋白分别分散至均含有7.5 mmol/L NaOH的水溶液、50%、60%、70%、80%、90%(体积分数)乙醇-水溶液等6种介质中,在室温下磁力搅拌1 h,配制成质量浓度为10 mg/mL的6份不同的玉米醇溶蛋白溶液,然后在65 ℃加热不同时间(0、1、2、3、4、5、6、7、8、9、10 h)。将不同处理后的玉米醇溶蛋白溶液进行旋转蒸发除去乙醇,然后冻干,作为后续试验样品。
1.2.2 脱酰胺度的测定
采用苯酚-次氯酸盐法测定脱酰胺度[13]。
试剂A的配制:分别准确称取5.0 g苯酚、25 mg亚硝基铁氰化钠,加入双蒸水定容至500 mL,移入棕色试剂瓶中备用。
试剂B的配制:准确称取2.5 g NaOH并溶于双蒸水中,移取4.2 mL次氯酸钠溶液加入到NaOH溶液中,并定容至500 mL,移入棕色试剂瓶中备用。
准确移取5.0 mL试剂A于试管中,加入20 μL不同浓度的(NH4)2SO4标准溶液(质量浓度为0.1、0.4、0.6、0.8、1.0 μg/L)或者待测样品,充分振荡、混匀。然后准确移取5.0 mL试剂B加入到上述混合溶液中,充分振荡、混匀。迅速转移至水浴锅中,在37 ℃下水浴显色20 min。然后冷却至室温,在625 nm处测定溶液吸光值。每个浓度做3个平行。
根据所测定的样品游离氨含量及总酰胺含量,按公式(1)计算脱酰胺度:

(1)
1.2.3 乳化性的测定
参照PEARCE等的浊度法[14]测定乳化活性和乳化稳定性。分别取3 mL质量浓度均为1 mg/mL的不同脱酰胺度的玉米醇溶蛋白溶液和1 mL一级大豆油混合,12 000 r/min均质1 min,静置,分别在0 min和10 min从距离容器底部0.5 cm处的相同位置取50 μL乳状液于装有5 mL质量浓度为1 mg/mL的SDS溶液中,旋涡振荡,混合均匀,然后在500 nm波长下测定吸光值,其中以1 mg/mL的SDS溶液进行调零。乳化活性指数和乳化稳定性按照公式(2)和公式(3)进行计算:
(2)
(3)
式中:T=2.303;A0,乳化液静置0 min时在500 nm下的吸光值;ρ,蛋白质质量浓度,g/mL;φ,油在溶液中的体积分数,%;n,稀释倍数;A10,乳化液静置10 min时在500 nm下的吸光值。
1.2.4 内源性荧光光谱的测定
参照DEL等的方法[15],使用荧光分光光度计对样品进行荧光扫描。具体参数如下:激发波长280 nm,发射光谱为290~450 nm,扫描速度100 nm/min,激发和发射狭缝宽度均为10 nm,电压700 mV。每个样品测定重复3次。所有数据均在室温下收集。
1.2.5 紫外吸收光谱的测定
紫外吸收光谱的测定参考SUN等的方法[16],将样品浓度进行适当稀释,扫描范围在200~450 nm,扫描速度200 nm/s。
1.2.6 表面疏水性荧光光谱的测定
以8-苯氨基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)为荧光剂,参照CHAUDHURI等[17]的方法对蛋白样品进行表面疏水性荧光光谱扫描。将待测样品用0.01 mol/L的磷酸缓冲液稀释成质量浓度为0.015 mg/mL,然后加入20 μL的8 mmol/L的ANS溶液,利用旋涡振荡器混匀,避光室温下反应15 min,然后在激发波长为390 nm,发射波长为400~600 nm进行扫描,激发和发射波长的狭缝均为5 nm,试验在室温下进行,每个样品扫描3次,获得表面疏水性荧光光谱。
1.2.7 分子柔性的测定
以蛋白质对胰蛋白酶的敏感度表征分子柔性[18],利用0.05 mol/L、pH 8.0的Tris-HCl缓冲液配制1 mg/mL胰蛋白酶溶液。取250 μL胰蛋白酶液加入到4 mL质量浓度为1 mg/mL脱酰胺修饰后的玉米醇溶蛋白溶液〔m(蛋白)∶m(酶)=16∶1〕中,38 ℃水浴恒温5 min,反应结束后加4 mL质量浓度为50 g/L三氯乙酸终止反应,离心后取上清液测定其在280 nm下的吸光度,用吸光度A表征量化柔性的大小。
2 结果与分析
2.1 乙醇浓度对脱酰胺度的影响
研究发现,玉米醇溶蛋白在不同溶剂(0、50%、60%、70%、80%、90%体积分数的乙醇-水溶液)中脱酰胺度随着加热时间延长呈现增长的趋势(图1)。

a-0%乙醇; b-50%乙醇; c-60%乙醇; d-70%乙醇; e-80%乙醇; f-90%乙醇图1 在不同加热时间条件下乙醇浓度对脱酰胺度的影响Fig.1 The effect of ethanol concentration on deamidation degree of zein at different heating time
由图1可知,其中在水溶剂中脱酰胺度的变化幅度最大,从加热0 h的0.89%增加至加热10 h的34.70%。玉米醇溶蛋白分散至碱-水介质时需要一定时间,在溶解期间也发生了脱酰胺反应。在含有7.5 mmol/L的NaOH的50%、60%、70%、80%、90%体积分数的乙醇-水溶液中,玉米醇溶蛋白在加热0 h时的脱酰胺度几乎为0,当加热10 h时,玉米醇溶蛋白的脱酰胺度分别为3.06%、1.95%、1.89%、1.69%、1.35%,表明脱酰胺度随着乙醇浓度的增加而呈现变小的趋势。而且与玉米醇溶蛋白在水溶剂中的脱酰胺度相比,在乙醇-水溶液中玉米醇溶蛋白的脱酰胺度均很小。改变溶剂类型可改变玉米醇溶蛋白的二级或三级结构,从而改变其反应位点的可接近性[11]。为研究脱酰胺度对玉米醇溶蛋白的界面性质的影响,选用碱-水作为溶剂对玉米醇溶蛋白进行脱酰胺作用。
2.2 脱酰胺度对乳化活性和乳化稳定性的影响
乳化活性和乳化稳定性是直接反应乳化特性的重要指标。不同脱酰胺度玉米醇溶蛋白的乳化活性和乳化稳定性见图2。

图2 脱酰胺度对乳化活性和乳化稳定性的影响Fig.2 The effect of deamidation degree on the emulsion active index and emulsion stability
图2乳化活性和乳化稳定性随着脱酰胺度的增加均呈现上升趋势。玉米醇溶蛋白在脱酰胺度较低(DD=0.89%)时,乳化活性仅为1.07 m2/g,可能是因为此时玉米醇溶蛋白表面活性较低[19],无法很好地形成良好的乳化液。但是当脱酰胺度增加至34.70%时,玉米醇溶蛋白的乳化活性增加至3.69 m2/g,增加的幅度达244.86%。脱酰胺度的提高也改善了玉米醇溶蛋白乳化液的稳定性,当脱酰胺度从0.89%增加至34.70%时,玉米醇溶蛋白的乳化稳定性从6.32%增加至73.05%,增加的幅度为1 055.85%。脱酰胺度较低的玉米醇溶蛋白黏度较低、表面疏水力较高,促进了乳化液滴的聚集絮凝[20],从而表现出较差的乳化稳定性。除了黏度和表面疏水性,分子柔性也是影响蛋白质乳化性的重要因素,因为分子柔性可以促进蛋白质分子和油表面的相互作用[9],脱酰胺度可能会改变玉米醇溶蛋白的分子柔性。
2.3 脱酰胺度对乳化活性和乳化稳定性归一化结果的影响
为定量反映脱酰胺度对玉米醇溶蛋白的乳化活性和乳化稳定性的影响规律,本研究采用单指数函数拟合脱酰胺度和归一化的乳化活性和乳化稳定性的关系〔乳化活性归一化(EAIg):不同脱酰胺度时的乳化活性与脱酰胺度为0.89%时平均乳化活性的比值;乳化稳定性归一化(ESIg):不同脱酰胺度时的乳化稳定性与脱酰胺度为0.89%时平均乳化稳定性的比值〕。如图3所示。
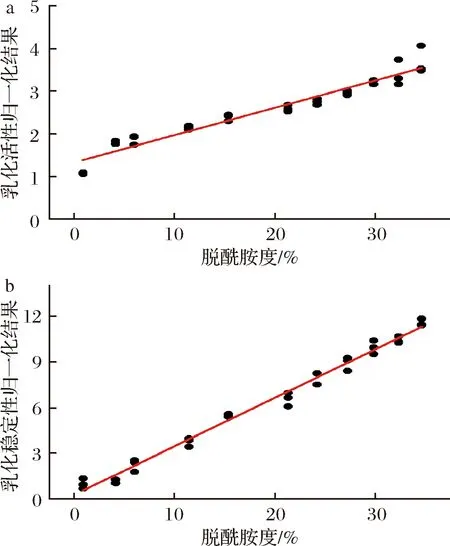
a-乳化活性归一化-脱酰胺度; b-乳化稳定性归一化-脱酰胺度图3 脱酰胺度对乳化活性和乳化稳定性归一化结果的影响Fig.3 The regressed result of generalized emulsion active index and emulsion stability as a function of deamidation degree
EAIg和ESIg最小二乘法回归分析可表示为:
EAIg=0.063 84x+1.322 5
(4)
ESIg=0.316 75x+0.288 64
(5)
2.4 脱酰胺后表面疏水性的变化
表面疏水性反映了蛋白质表面的疏水基团含量,与蛋白质的性质息息相关。本试验采用ANS荧光探针的方法对玉米醇溶蛋白的表面疏水性进行测定。从图4可以看出,脱酰胺度在0.89%时,玉米醇溶蛋白表现出较高的表面疏水性;当脱酰胺度增加至34.70%时,玉米醇溶蛋白的表面疏水性降低。脱酰胺反应使得疏水酰胺基团形成亲水性的羧基,从而降低了蛋白质的表面疏水性[21]。
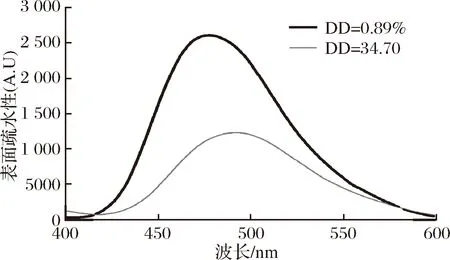
图4 不同脱酰胺度的玉米醇溶蛋白的表面疏水性的变化Fig.4 Surface hydrophobicity change of zein at various deamidation degree
2.5 内源性荧光光谱分析
色氨酸、酪氨酸和苯丙氨酸是蛋白质中发射内源性荧光的氨基酸,在激发波长为280 nm时,内源性荧光通常取决于色氨酸和酪氨酸残基,与酪氨酸相比,色氨酸对环境变化更敏感,因此内源性荧光的强度主要来源于色氨酸[22]。通过测定蛋白质中色氨酸的荧光强度变化可以反映蛋白质的结构、稳定性、折叠和展开参数以及动态变化[23]。当蛋白质结构展开,发色团暴露于溶剂中会降低荧光强度[24-25]。从图5看出,在玉米醇溶蛋白脱酰胺度(DD=0.89%)很低时,色氨酸发色团的峰值约330 nm,这是色氨酸在一个相对疏水环境中的一个特定峰值[24]。但是当玉米醇溶蛋白的脱酰胺度达到34.70%时,内源性荧光强度的峰值消失,没有出现明显的峰值,可能由于脱酰胺破坏了玉米醇溶蛋白的结构,使得内部的色氨酸完全暴露,在碱性环境下发生了荧光猝灭。
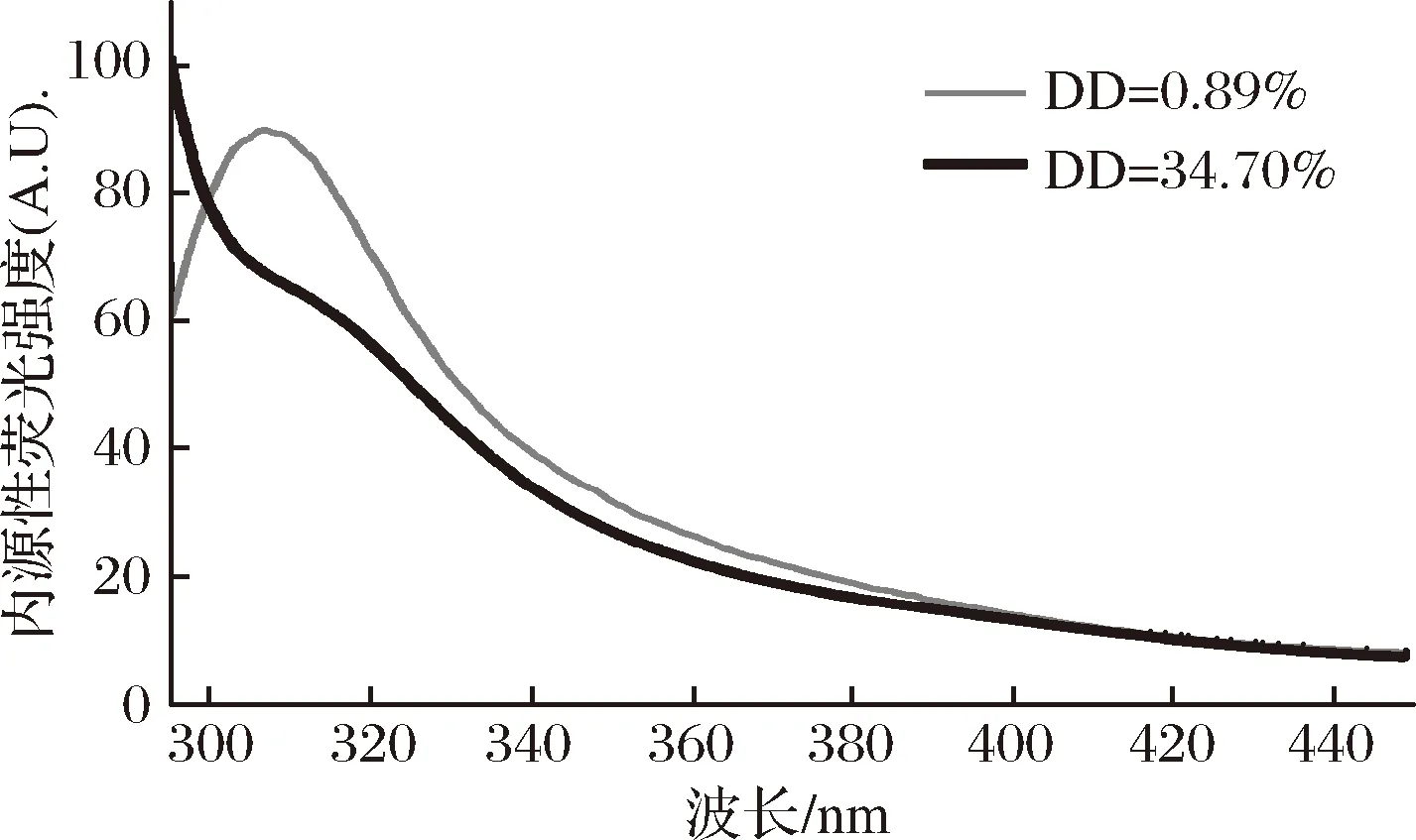
图5 不同脱酰胺度的玉米醇溶蛋白的内源性荧光光谱Fig.5 Typical intrinsic emission fluorescence spectra of zein at different deamidation degree
2.6 紫外吸收
蛋白质产生紫外吸收光谱主要是由于色氨酸和酪氨酸残基侧链基团对紫外光的吸收作用,根据蛋白质对紫外光谱吸收的不同,可以预测蛋白质分子在溶液中构象的变化[26]。蛋白质中的酪氨酸和色氨酸的吸收峰值在280 nm左右。由图6可以看出,脱酰胺度低(DD=0.89%)时,玉米醇溶蛋白的最大紫外吸收峰大约在280 nm,脱酰胺度高(DD=34.70%)时,吸收强度增加,表明蛋白质内容发色基团暴露在外部,玉米醇溶蛋白更加舒展[27]。紫外吸收强度的变化表明玉米醇溶蛋白结构发生了改变。

图6 不同脱酰胺度的玉米醇溶蛋白的紫外吸收光谱Fig.6 UV spectra of zein at different deamidation degree
2.7 分子柔性的变化
脱酰胺的过程是将玉米醇溶蛋白中的疏水的谷氨酰胺和天冬酰胺转变为亲水的谷氨酸和天冬氨酸[28]。这种变化增加了玉米醇溶蛋白的亲水特性,从而可用作食品加工的表面活性剂或乳化剂[9,28]。紫外吸收光谱的变化和内源性荧光强度的变化均说明脱酰胺改变了玉米醇溶蛋白的结构,可能也改变了玉米醇溶蛋白分子的柔性。利用低脱酰胺度(DD=0.89%)和高脱酰胺度(DD=34.70%)的玉米醇溶蛋白对胰蛋白酶的敏感性表征分子柔性,见图7。
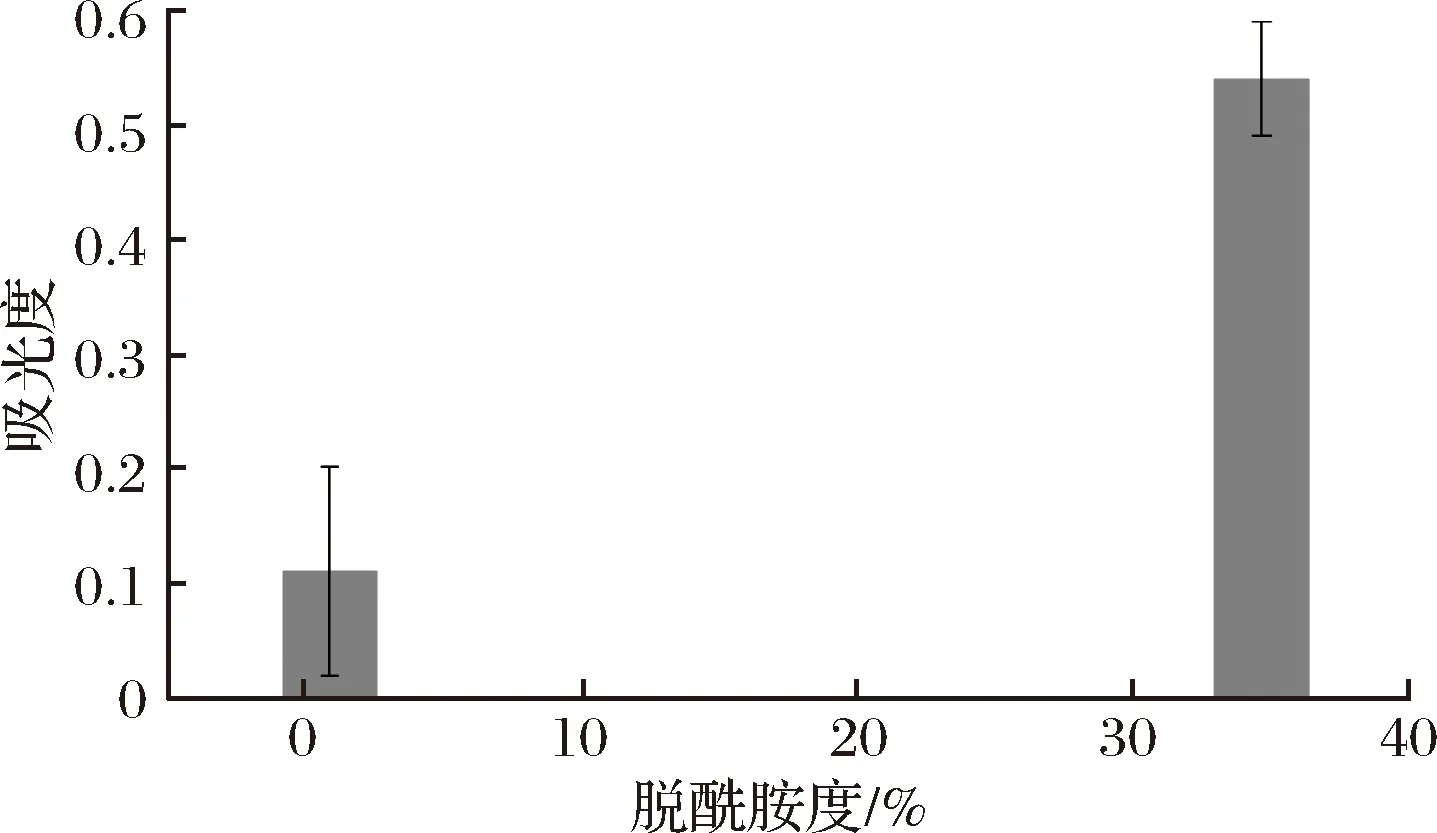
图7 脱酰胺度对玉米醇溶蛋白分子柔性的影响Fig.7 The effect of deamidation on the flexibility of zein
脱酰胺度为0.89%时,玉米醇溶蛋白经过胰蛋白酶修饰后在280 nm下的吸光值为0.11,而脱酰胺度为34.70%时,玉米醇溶蛋白经过胰蛋白酶修饰后在280 nm下的吸光值为0.54,说明脱酰胺作用可以增加玉米醇溶蛋白的分子柔性。KATO等研究发现增加蛋白质的柔性可以显著改善蛋白质的乳化性[18]。
3 结论
与50%~90%的乙醇-水溶液介质相比较,玉米醇溶蛋白在水介质中更容易发生脱酰胺作用。高脱酰胺度(DD=34.70%)玉米醇溶蛋白的乳化活性和乳化稳定性比低脱酰胺度(DD=0.89%)玉米醇溶蛋白的乳化活性和乳化稳定性分别提高了244.86%和1 055.85%。脱酰胺作用改变了玉米醇溶蛋白的结构和构象,提高了玉米醇溶蛋白分子的柔性,本研究的结果为开发天然乳化剂提供了很好的基料并奠定了理论基础。

