偶氮鎓二醇盐衍生物JS-K通过MEK/ERK通路抑制肝纤维化抗大鼠肝癌
刘 玲,曹梦瑶,陈晶晶,徐静蕾,黄紫乐
(河南科技大学基础医学院药学系,河南 洛阳 471003)
原发性肝癌的发生是由多条信号通路和多个基因共同参与控制的复杂过程,其病情发展较快,起病隐匿,恶性程度高。二乙基亚硝胺(diethylni⁃trosamine,DEN)是一种强致癌物,在化妆品、食品、香烟等中都含有亚硝胺类化合物。高浓度一氧化氮(nitric oxide,NO)作为一种信号分子能调节肿瘤发生过程,包括血管生成、细胞凋亡、细胞周期进程、侵袭和转移[1]。但NO在水中溶解度有限,半衰期较短,而NO可与其他分子偶联形成新的NO型供体化合物。因此,NO供体是稳定释放NO的有效途径,其中偶氮鎓二醇盐在靶向释放NO作用方面较为明显,O2(2,4-二硝基苯基)1-〔(4-乙氧羰基)哌嗪-1-yl〕偶氮-1-鎓-1,2-二醇(JS-K)可与谷胱甘肽-S-转移酶(glutathione S-transferase,GST)结合,在GST作用下释放高浓度NO[2]。JS-K也可显著抑制肝细胞癌的增殖,引起Jun激酶(jun kinase,JNK)和P38及其下游效应物c-Jun和激活蛋白(activator protein-1,AP-1)的活化[3]。前期研究表明,JS-K可减少大鼠肝癌瘤块形成,上调蛋白磷酸酶2A(protein phosphatase 2A,PP2A)蛋白表达,下调β连环蛋白(β-catenin)、c-Myc和p-Bcl-2(Ser70)蛋白表达;增加活性氧(reactive oxygen species,ROS)和Ca2+水平,经胱天蛋白酶依赖途径诱导细胞凋亡[4-5]。
细胞外信号调节激酶(extracellular signalregluated kinase,ERK)通路是将信号从表面受体转导至细胞核的关键,在许多肿瘤(如肝癌、黑色素瘤和乳腺癌等)中都可发现ERK过度激活,而有关JS-K对ERK通路中的具体作用机制尚未见报道,本研究以DEN为诱导剂建立大鼠原发性肝癌模型,通过检测肝组织中促细胞丝裂原细胞外激酶(mito⁃gen-activated extracellular signal-regulated kinase,MEK)/ERK通路相关蛋白表达的变化,探索外源性NO对肝癌中MEK/ERK信号通路的影响及其作用机制,为NO供体抗肿瘤机制研究提供新的作用靶点。
1 材料与方法
1.1 动物、药物、试剂和仪器
健康雄性Wistar大鼠40只,约6周龄、体质量180~220 g,购自河南科技大学医学院实验动物中心,动物许可证号:SCXK(鄂)2010-0007。将大鼠饲养在室温22~28℃、自然光、相对湿度为40%~60%、通风良好的环境中,自由饮水摄食,适应性饲养1周后用于实验。
JS-K购自美国Santa公司;DEN购自美国Sigma公司;γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,γ-GT)、碱性磷酸酶(alkaline phosphatase,AKP)、羟脯氨酸检测试剂盒购自南京建成生物工程研究所;甲胎蛋白(alpha-fetoprotein,AFP)、AFP异质体 3(alpha-fetoprotein variants,AFP-L3)和异常凝血酶原(abnormal prothrombin,APT)ELISA检测试剂盒购自上海酶联生物科技有限公司;兔抗大鼠p-MEK(cat#9121)、核糖体 S6蛋白激酶 P90(phospho-P90 ribosomal S6 kinase,p-P90RSK)(cat#9341)多克隆抗体和兔抗大鼠p-ERK(cat#4376)单克隆抗体购自美国Cell Signaling Tech⁃nology公司;辣根过氧化物酶标记山羊抗兔IgG抗体(SA00001-2)购自武汉三鹰公司;通用SP检测试剂盒(SP0041)购自北京索莱宝公司。其他试剂均为分析纯。
电泳仪DYCZ-40D购自北京六一科技有限公司;BIO-RAD凝胶成像分析系统(型号:Universal HoodⅡ)购自美国伯乐公司。
1.2 动物分组和给药
40只Wistar雄性大鼠随机均分为正常对照组(ip,生理盐水10 mL·kg-1)、模型组(ip,DEN 50 mg·kg-1),前4周每周2次,4周后每周1次,连续16周;JS-K 0.25和0.5 mg·kg-1药物组尾静脉注射,每周2次,在DEN注射后1 d给药,连续16周。造模过程观察记录各组大鼠的精神状态、体质量和生存状态。16周后摘眼球取血,离心取血清;取肝组织,观察肝的色泽、质地、大小,表面有无结节形成等。剪取部分组织,用0.9%生理盐水冲洗,一部分用4%多聚甲醛固定,制备石蜡切片进行HE染色和免疫组化实验等;一部分用于制备组织匀浆提取蛋白进行Western印迹实验。通过HE染色检测肝组织病理变化,EILSA试剂盒检测血清中肿瘤标志物AFP,AFP-L3和APT含量作为模型建立成功的依据[6-7]。
1.3 抑瘤作用评价
计数各组大鼠肝表面的结节数;剥离大鼠肝肿瘤组织并称重,计算各组抑瘤率。抑瘤率(%)=(模型组平均瘤质量-药物组平均瘤质量)/模型组平均瘤质量×100%。
1.4 比色法检测血清 γ-GT和AKP活性及羟脯氨酸含量
按γ-GT试剂盒操作要求,在测定管和对照管都加入0.1 mL血清样品,测定管中加入2 mL底物基质液,混匀,37℃水浴10 min,之后在测定管和对照管中加入0.2 mL终止剂,在对照管中加入2 mL基质液,混匀,在正常条件下放置5 min,用蒸馏水调零,在410 nm测各管吸光度(A410nm),根据公式计算γ-GT活性。血清γ-GT活性=〔(样本A410nm-对照A410nm)×232.56〕。
按AKP试剂盒(微板法)操作要求,在空白孔、标准孔、测定孔各加5 μL双蒸水、酚标准应用液、待测血清,然后在各孔均加50 μL缓冲液和50 μL基质液,混匀,在37℃水浴15 min。各孔中加显色剂,测定A520nm值,根据公式计算AKP活性。血清中AKP活性=〔(样本A520nm-空白A520nm)/(标准A520nm-空白A520nm)〕×标准品浓度×100 mL×样本稀释倍数。
按羟脯氨酸试剂盒操作要求,取0.5 mL血清加水解液1 mL,混匀,沸水浴中水解20 min,流水冷却后调pH值至6.0~6.8。按说明书操作步骤,加检测试剂后60℃水浴15 min,冷却后离心10 min,取上清测各管A520nm值,根据公式计算羟脯氨酸含量。羟脯氨酸含量=〔(样本A550nm-空白A550nm)/(标准A550nm-空白A550nm)〕×标准品含量×水解液总体积/取样量。
1.5 HE染色检测肝组织病理变化
将肝组织用4%多聚甲醛固定,石蜡包埋,切片、烤片、脱蜡,经梯度乙醇水化、HE染色后,脱水封片,光学显微镜下观察肝组织的病理变化。
1.6 ELISA检测血清AFP,AFP-L3和APT含量
按AFP,AFP-L3和APT检测ELISA试剂盒操作要求,将血清样品加入相应酶标板,分别设空白对照孔,同时进行标准品的加样。加相应酶试剂,温育1 h,加满洗涤液静置30 s后弃去,重复5次。然后加显色剂,15 min后终止反应。酶标仪测定A450nm值,根据标准曲线计算AFP,AFP-L3和APT在血清中的含量。
1.7 Gomori银染法检测肝组织网状纤维水平
石蜡切片脱蜡后,加入高锰酸钾氧化、草酸漂白、硫酸铁铵媒染、Gomori银氨液染色、中性甲醛液还原后,常规脱水透明,中性树胶封片,光学显微镜下观察肝组织的网状纤维变化,采用Image-Pro Plus 6.0软件(美国MediaCybemetics公司)对网状纤维的阳性表达区域进行吸光度值统计分析,各组与正常对照组的平均光吸光值的比值表示网状纤维变化水平。
1.8 免疫组化法检测肝组织中p-ERK表达水平
将制备的石蜡切片在二甲苯中脱蜡,浓度梯度乙醇脱水,3%H2O2作用20 min淬灭内源性过氧化物酶活性,浸入95°C柠檬酸盐缓冲液(0.01 mol·L-1,pH 6.0)20 min进行抗原修复,加山羊血清37℃封闭1 h,PBS洗涤2次,每次3 min,加p-ERK(1∶200)4℃过夜,PBS清洗,滴加链酶亲和素-POD工作液,PBS清洗,DAB显色。蒸馏水清洗,终止显色。苏木素复染细胞核5 min,自来水水洗返蓝,中性树胶封片后,显微镜下拍照,棕黄色或褐色颗粒视为阳性表达区域。采用Image-Pro Plus 6.0软件对阳性表达区域进行积分吸光度值半定量分析,各组与正常对照组的平均积分吸光度值的比值表示p-ERK蛋白水平。
1.9 Western印迹法检测肝组织中p-ERK,p-MEK和p-P90RSK蛋白表达水平
取部分肝组织匀浆置于离心管中,加裂解液裂解提取总蛋白,BCA法测定总蛋白含量。用12%SDS-PAGE电泳分离蛋白,电转印至PVDF膜上,5%脱脂奶粉常温封闭1 h,加相应一抗(稀释倍数均为1∶1000)4℃孵育过夜;二抗(1∶10 000)室温孵育2 h。ECL化学发光法显影,凝胶成像系统拍照,并对蛋白条带进行半定量分析。应用Chemis⁃cope Analysis图像分析软件对条带进行积分吸光度值分析,以目的蛋白条带与内参蛋白(β肌动蛋白)的积分吸光度值比值表示目的蛋白相对表达水平。
1.10 统计学分析
2 结果
2.1 JS-K对大鼠肿瘤结节数、瘤质量和抑瘤率的影响
DEN处理16周后,与正常对照组相比,模型组大鼠肝硬度增加,表面呈颗粒状或结节状,并出现单发或多发的大小不等的肝癌结节。结节数和瘤质量结果(表1)显示,与模型组相比,JS-K 0.25和0.50 mg·kg-1组肿瘤结节数和肿瘤质量显著减少(P<0.05,P<0.01)对肝肿瘤的抑瘤率增加,提示JS-K可抑制大鼠原发性肝癌的发生。
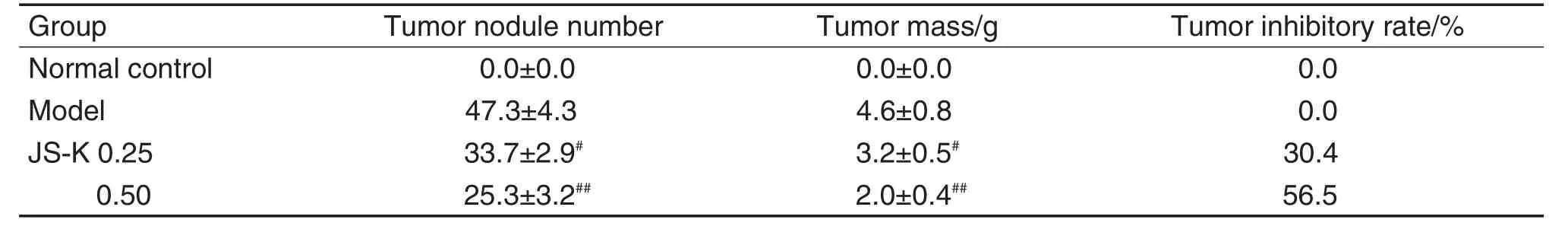
Tab.1 Effect of JS-K on tumor nodule number,tumor mass and tumor inhibitory rate in diethylnitrosomine(DEN)-treated rats
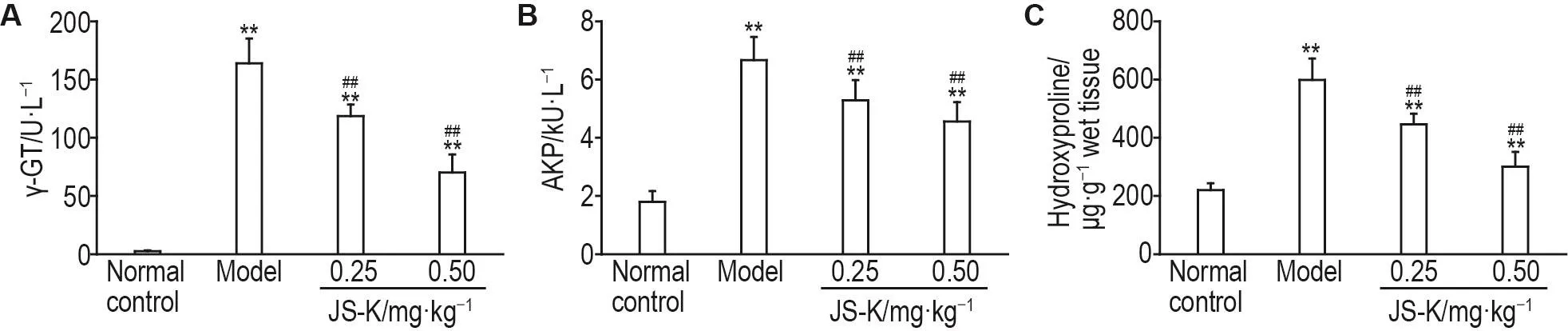
Fig.1 Effect of JS-K on activities of γ-glutamyl transferring( γ-GT,A),alkaline phosphatase(AKP,B)and content of hydroxyproline(C)in serum of DEN-treated rats.See Tab.1 for the rat treatment.±s,n=10.*P<0.05,**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model group.
2.2 JS-K对大鼠血清中 γ-GT和AKP活性及羟脯氨酸含量的影响
比色法结果(图1)显示,在DEN处理16周后,与正常对照组相比,模型组γ-GT和AKP活性及羟脯氨酸含量均明显升高(P<0.01);与模型组相比,JS-K 0.25和0.50 mg·kg-1组γ-GT和AKP活性及羟脯氨酸含量显著降低(P<0.01),提示JS-K可减轻肝损伤和纤维化程度。
2.3 JS-K对大鼠肝组织病理变化的影响
HE结果(图2)显示,在DEN处理16周后,模型组肝小叶结构被破坏,可见多发大小不等、形状各异的癌巢,癌巢周围可见较多毛细血管,肝细胞变性坏死,出现多核、核固缩、核内空泡等现象,提示模型建立成功[6]。JS-K 0.25和0.50 mg·kg-1组肝小叶结构相对完好,癌细胞分化程度高,提示JS-K减轻了DEN诱导性肝癌的发生。
2.4 JS-K对大鼠血清中AFP,AFP-L3和APT含量的影响
ELISA结果(图3)显示,在DEN处理16周后,与正常对照组相比,模型组AFP,AFP-L3和APT含量均明显升高(P<0.01),提示模型建立成功。与模型组相比,JS-K 0.25和0.50 mg·kg-1组以上指标均降低(P<0.05,P<0.01),提示JS-K可减轻DEN诱发性大鼠肝癌的恶性程度。
2.5 JS-K对大鼠肝组织中网状纤维水平的影响
Gomori染色结果(图4)显示,在DEN处理16周后,模型组大鼠肝组织网状纤维失去正常分布状态,自汇管区周围网状纤维塌陷、融合、增粗、包裹并已形成假小叶。JS-K 0.25和0.50 mg·kg-1组大鼠肝组织网状纤维化程度阳性表达区域明显减少(446±37,301±51vs598±74,P<0.01)提示JS-K可减轻DEN诱发性大鼠肝癌的纤维化程度。
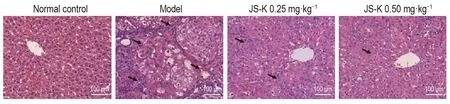
Fig.2 Effect of JS-K on morphological changes in liver tissue of diethylnitrosomine(DEN)-treated rats.See Fig.1 for the rat treatment.The arrows show areas of disordered arrangement in the hepatic cells.
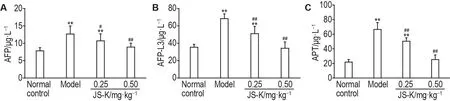
Fig.3 Effect of JS-K on content of α-fetoprotein(AFP,A), α-fetoprotein variants(AFP-L3,B)and abnormal pro⁃thrombin(APT,C)in serum of DEN treated rats.See Tab.1 for the rat treatment.±s,n=10.*P<0.05,**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model group.

Fig.4 Effect of JS-K on reticular fiber of liver tissue of DEN-treated rats by Gomori staining.See Tab.1 for the rat treatment.The arrows show the reticular fibers.
2.6 JS-K对大鼠肝组织中p-ERK表达水平的影响
免疫组化结果(图5)显示,与正常对照组相比,在DEN处理16周后,模型组大鼠肝组织p-ERK表达升高。与模型组相比,JS-K 0.25和0.50 mg·kg-1组p-ERK表达降低(119±10,70±16vs164±21,P<0.01),提示JS-K可减轻DEN诱发性大鼠肝癌中p-ERK蛋白的表达。
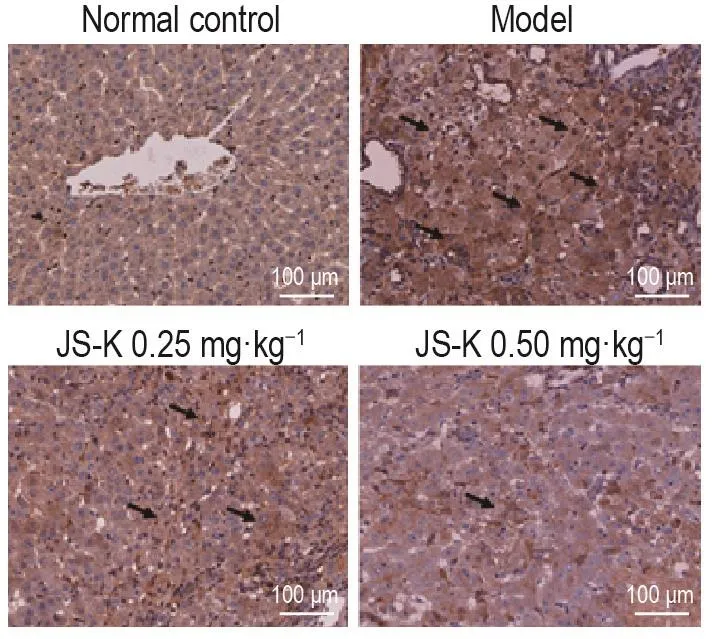
Fig.5 Effect of JS-K on levels of p-ERK in liver tissue of DEN-treated rats.See Tab.1 for the rat treatment.The arrows show p-ERK-positive staining.
2.7 JS-K对肝组织中MEK/ERK信号通路相关蛋白表达的影响
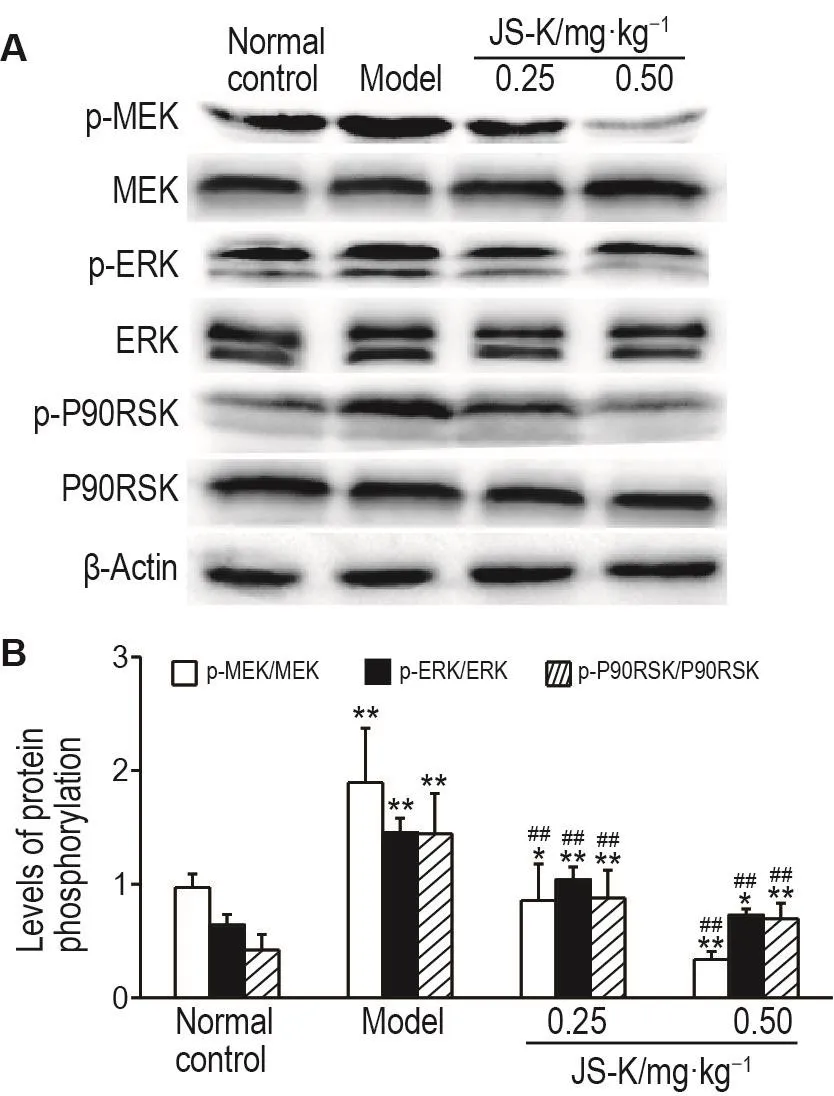
Fig.6 Effect of JS-K on phosphorylation of MEK/ERK pathways and apoptotic related proteins in liver tissue of DEN-treated rats.See Tab.1 for the rat treatment.B was semi-quantitative result of A.±s,n=10.**P<0.01,compared with normal control group;##P<0.01 compared with model group.
Western印迹结果(图6)显示,在DEN处理16周后,与正常对照组相比,模型组中MEK,ERK和P90RSK蛋白磷酸化水平显著升高(P<0.01)。与模型组相比,JS-K 0.25和0.50 mg·kg-1组MEK/ERK通路相关蛋白MEK,ERK和P90RSK蛋白磷酸化显著降低(P<0.01),提示JS-K可抑制MEK/ERK通路的激活。
3 讨论
本研究通过检测大鼠血清中酶活性,羟脯氨酸含量、肝病理改变、肿瘤标志物和肝纤维化程度,以确定偶氮鎓二醇盐衍生物在大鼠DEN诱发性肝癌模型中的作用。结果显示,JS-K显著降低大鼠血清中γ-GT和AKP活性及羟脯氨酸含量;也可降低AFP,AFP-L3和APT的含量,改善肝纤维化程度,使p-ERK在组织中表达减少,以及p-MEK和p-P90RSK表达水平下降,提示JS-K对大鼠原发性肝癌所致的肝损伤和纤维化的抑制作用,与其抑制MEK/ERK信号通路有关。
JS-K在GST作用下可释放NO。肝组织中γ-GT主要局限于毛细胆管和肝细胞的微粒体中,可用于对占位性肝病,肝实质损伤(慢性肝炎和肝硬化)的诊断等;在胆管梗阻、肝细胞损害、胆管上皮再生和癌变等情况下,肝细胞过度产生AKP,经淋巴道和肝窦返流入血液[8]。本研究发现,JS-K可减少γ-GT和AKP活性,减轻在DEN诱发性肝癌中所致的肝损伤。研究表明,肝细胞癌通常由慢性肝炎进展为肝纤维化,再由肝癌纤维化进展为肝硬化,最终演变成肝细胞癌,其中羟脯氨酸是合成胶原的重要氨基酸,其含量决定胶原蛋白的数量,可反映肝纤维化程度[9]。本研究中,JS-K可减少羟脯氨酸含量,进而抑制大鼠原发性肝癌纤维化进程。在大鼠原发性肝癌模型建立过程中,本研究通过检测大鼠血清中AFP,AFP-L3和APT 3项指标,对原发性肝癌进行诊断和药物作用后的评估。AFP是原发性肝癌的最灵敏和特异的肿瘤标志;在肝癌发生发展中,肿瘤细胞可特异性产生AFP-L3,而且具有早期血管浸润和转移趋势的特性,且AFP-L3的含量与肿瘤的恶化程度成正比;APT是一种维生素K缺乏诱导蛋白,肝癌组织可产生大量APT释放入血,随着病程进展,血清中APT含量随之升高[7,10]。本研究结果显示,在DEN诱导的原发性大鼠模型中,大鼠血清中AFP,AFP-L3和APT含量均呈现显著升高,结合肝组织病理变化结果,提示大鼠原发性肝癌模型建立成功。而JS-K给药组可不同程度减少三者的含量,提示JS-K对大鼠原发性肝癌具有一定的抑制作用。网状纤维主要由Ⅲ型胶原蛋白构成,在肝受到各种刺激因子损害时肝星形细胞被激活,使其异常蓄积而形成肝纤维化。JS-K在减少羟脯氨酸含量的同时也减少了网状纤维的形成,提示JS-K可减轻DEN诱发性大鼠肝癌的纤维化程度,对原发性肝癌发展过程中纤维化的形成具有一定的抑制作用。
丝裂原活化蛋白激酶(mitogen-activated pro⁃tein kinase,MAPK)是一组能被不同的细胞外刺激,如细胞因子、神经递质、激素、细胞应激及细胞黏附等激活的丝氨酸-苏氨酸蛋白激酶,是信号从细胞表面转导到细胞核内部的重要传递者。研究表明,JS-K可抑制Hep3B肝癌细胞的增殖,这与JNK和P38及其下游效应c-Jun和AP-1的激活有关,而NO清除剂可取消JS-K对MAPK的激活和肿瘤抑制作用[12]。ERK包括ERK1和ERK2,是将信号从表面受体转导至细胞核的关键激酶。MEK属于双重特异性激酶,使Tyr和Thr 2个调节位点磷酸化而激活ERK[12]。在生理状态下,ERK是MEK的唯一下游底物,表明MEK及ERK在该通路中具有重要地位,激活后的ERK可通过磷酸化作用激活P90RSK及其底物,并与之共同入核促进环腺苷酸应答元件结合蛋白等重要转录因子的磷酸化,从而调节如c-Fos,c-Myc,c-Jun等基因的转录表达[13-14]。本研究结果显示,模型组大鼠肝组织中MEK/ERK通路关键性蛋白表达增加,JS-K可不同程度地降低MEK磷酸化水平,抑制其调控细胞生长和分化的作用,使ERK1/2(P44/42)磷酸化水平减少,抑制ERK易位至细胞核,从而减弱其对转录因子的调节。同时,JS-K可降低P90RSK的磷酸化水平,减弱其促进细胞增殖的作用。有研究报道,ERK信号通路在肝细胞外基质产生和降解中起到重要作用,阻断ERK通路可抑制肝纤维化[15-16]。本研究结果显示,JS-K可减少DEN诱发大鼠肝网状纤维的水平,减轻纤维化病变程度,提示与其下调MAPK/ERK信号通路有关。前期研究结果显示,在DEN诱发性大鼠肝癌模型中,JS-K可降低ERK下游底物c-Myc蛋白的表达,与本次研究结果相一致,进一步验证了JS-K对大鼠肝癌的抑制作用与其干预MEK/ERK信号通路有关。
综上所述,偶氮鎓二醇盐衍生物JS-K对大鼠原发性肝癌具有一定的抑制作用,可降低血清中AFP等肿瘤标志物水平,减轻肝损伤和肝纤维化程度,与其抑制MEK/ERK通路有关。

