五味子木脂素对佐剂性关节炎大鼠的抗炎作用及对自噬相关通路的影响
范紫微,古 虹,邹天琪,柏 琳,孙靖辉,张成义
(北华大学药学院,吉林 吉林 132013)
RA模型分为多种,但最为经典的是弗氏完全佐剂(Freund′s complete adjuvant,CFA)诱导的佐剂性关节炎(adjuvant arthritis,AA)大鼠模型[4]。AA模型大鼠症状与RA患者的临床症状接近,故本研究采用AA大鼠模型进行研究。
北五味子是长白山道地药材,同时也是常用的传统中药材之一,在我国《药典》中列为滋补和镇静中药,具有益气生津、补肾养心、收敛、固涩的功效,已广泛应用于中医多种处方及与之相关的保健品和复方制剂中,如肝得安、五味子蜜丸、北五味子茶、纳米参芪五味子制剂、北五味子片和五酯胶囊等[5]。五味子木脂素(Schisandra chinensislignans,SCL)是中药五味子的主要活性成分,中医以五味子入药治疗RA。近年研究发现,SCL具有较强的体外抗炎活性[6],但其抗炎作用与自噬相关基因的相关性未见报道。本研究拟通过SCL干预AA大鼠,探讨SCL对AA大鼠的抗炎作用及对自噬相关通路的影响。
1 材料与方法
1.1 药物、试剂和仪器
SCL,由北华大学药学院制备(纯度90.6%)。具体制备过程见文献[7]。将干燥的五味子粉碎并过筛,用95%乙醇连续2次回流提取,旋转蒸发干燥滤液。将干燥的样品溶解在适量的蒸馏水中,过滤,通过旋转蒸发干燥,并向提取物中添加适量的蒸馏水,用大孔树脂填充柱,洗脱提取物。收集乙醇洗脱液用于旋转蒸发和冷冻干燥。最后,获得SCL粉末,每1 g五味子含有10.9 mg木脂素。
地塞米松(dexamethasone,Dex)片(广东华南药业集团有限公司);CFA(编号:76J00110,北京鼎国昌盛生物技术有限责任公司);兔抗大鼠AMPK单克隆抗体、兔抗大鼠mTOR多克隆抗体、兔抗大鼠Beclin1多克隆抗体和兔抗大鼠轻链3-Ⅱ(light chain 3-Ⅱ,LC3-Ⅱ)多克隆抗体(英国Abcam公司);兔抗大鼠自噬相关基因5(autophagy-related gene 5,ATG5)、ATG7和ATG12多克隆抗体(中国武汉AB clonal公司);辣根过氧化物标记山羊抗兔各蛋白IgG抗体,GAPDH、白细胞介素6(interleu⁃kin-6,IL-6)、IL-1β、IL-17、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、环氧合酶1(cyclooxygen⁃ase-1,COX-1)、COX-2、AMPK、mTOR、Beclin1、LC3-Ⅱ、ATG5、ATG7和ATG12引物(北京鼎国公司);逆转录cDNA试剂盒和高纯总RNA快捷提取试剂盒(购于美国BioTake公司);BCA蛋白浓度测定试剂盒(上海翊圣生物科技公司)。
酶标仪(680,美国Bio-Rad公司);凝胶成像系统(E-Gellmager,美国莫赛飞公司);PCR仪(Master⁃cycler X50,德国Eppendorf有限公司);电泳仪(JY200C,上海珂淮仪器有限公司);切片机(RM2235)和石蜡包埋机(EG1150,德国徕卡有限公司);化学发光成像系统(MG8000,托摩根生物科技有限公司);足跖容积测量仪(PV-200,成都泰盟有限公司)。
1.2 动物、AA模型制备和分组
60只雄性Wistar大鼠,6~7周龄,体质量200~210 g(长春市亿斯实验动物技术有限公司提供)。在SPF条件下动物室饲养,室温24℃和相对湿度45%~55%。实验开始前,大鼠适应性饲养7 d,实验设计及实验操作由北华大学动物伦理委员会审查和批准。
大鼠适应性饲养7 d后,随机分为6组,每组10只。正常对照组、模型组、模型+Dex 0.25 mg·kg-1组、模型+SCL 25,50和100 mg·kg-1组。以造模当天为实验第0天(D0),正常对照组大鼠右后足足跖皮下注射器0.2 mL生理盐水,其余50只大鼠注射CFA 0.2 mL[8]。8 h 后,大鼠致炎足足肿胀度均大于0.8 mL,认为造模成功。D1开始,正常对照组和模型组ig给予生理盐水,其余组大鼠ig给予相应药物,每天1次,持续28 d。测D0和D28大鼠体质量,观察并记录其体质量变化。
香豆素对小麦发芽指数、种子萌发、幼苗生长及根系活力有抑制作用,且随处理浓度的增加而增强,肉桂酸、羟基苯甲酸和苜蓿素在处理浓度大于0.010 g/L之后抑制作用逐渐明显。
1.3 观察AA大鼠足跖形态变化
观察1.2分组大鼠D0,D21和D28致炎足跖形态变化,观察大鼠非致炎足是否出现继发反应及继发反应高峰,拍照记录。
1.4 排水法检测AA大鼠足跖肿胀
实验期间,每4 d测1.2分组大鼠右后足足跖的容积,计算各组大鼠足跖肿胀度。足肿胀度(mL)=Vt-V0,式中V0和Vt分别代表致炎前后足组织容积值。
1.5 检测AA大鼠胸腺和脾指数
最后1次给药后1 h,取1.2分组大鼠称重,ip给予25%乌拉坦(4 mg·kg-1)麻醉处死,立即取胸腺和脾,用生理盐水清洗后用滤纸吸干水分并称重,计算胸腺和脾指数[9]。胸腺或脾指数=胸腺或脾质量(g)/体质量(g)×100。
1.6 HE染色法观察AA大鼠关节组织病理改变
取1.2分组大鼠右后足踝关节给予10%中性甲醛固定后,用10%EDTA脱钙,每4 d更换1次脱钙液,脱水24 h;石蜡包埋,5 μm厚连续切片,HE染色。光学显微镜观察大鼠关节组织病理形态变化并进行病理评分,分别半定量检测炎症细胞、滑膜组织增生和OOCHAS[10]评分。炎症细胞评价评分标准:0分,无;1分,稀疏、散在;2分,较密集;3分,大量。滑膜组织增生评分标准:0分,无;1分,单层;2分,2层;3分,3层。OOCHAS评分=关节软骨损伤深度及相应组织反应分级(0~6级)×关节软骨损伤范围分期(0~4期);分级评分标准为:0级:关节面完整,软骨完整;1级:表面完整;2级:表面不连续;3级:垂直裂隙;4级:糜烂;5级:缺损;6级:变形;分期评分标准为:0期:无炎症表现;1期:损伤面积小于样本面积10%;2期:损伤面积占样本面积10%~25%;3期:损伤面积占样本面积25%~50%;4期:损伤面积大于样本面积50%。
1.7 RT-PCR法检测AA大鼠足跖关节滑膜组织炎症相关因子和自噬相关基因mRNA表达水平
取1.2分组大鼠右后足致炎足跖滑膜组织,使用RNA提取试剂盒提取大鼠致炎足跖滑膜组织总RNA。然后以总RNA为模板进行逆转录,提取cDNA。操作步骤如下:42℃孵育50 min和72℃孵育10 min,逆转录cDNA;RT-PCR反应体系(25 μL):2 Taq Master mix 12.5 μL、双蒸水 9.5 μL、上游引物1 μL、下游引物1 μL和cDNA 1 μL 。
PCR扩增以逆转录的cDNA为模板,在94℃3 min的条件进行初始变性,经20个循环,94℃30 s变性,65℃30 s退火和72℃1 min延伸过程,72℃ 10 min充分延伸;依次点样,100 V、40 min电泳,通过2%琼脂糖和Gelred电泳1 h和凝胶成像分析系统观察扩增产物,进行目的基因mRNA的半定量分析,以目的基因条带与GAPDH条带吸光度比值进行数据分析(PCR引物序列见表1)。以上实验至少重复3次。
1.8 Western印迹法检测AA大鼠足跖关节滑膜组织AMPK,mTOR,Beclin1,LC3-Ⅱ,ATG5,ATG7和ATG12蛋白表达水平
取1.2分组大鼠右后足致炎足跖滑膜组织,配制裂解缓冲液、PMSF和磷酸酶抑制剂工作液,用于大鼠致炎足跖滑膜组织总蛋白的提取。BCA蛋白浓度测定试剂盒对提取蛋白质进行定量分析。配制浓缩胶、分离胶(12%SDS-聚丙烯酰胺凝胶);上样50 μg蛋白进行电泳(80 V 30 min,100 V 1.5 h);转模(PVDF膜,100 V 1 h);封闭:5%脱脂奶粉室温封闭1 h;孵育一抗,4℃过夜:用TBST稀释兔抗大鼠 AMPK、mTOR、Beclin-1、LC3-Ⅱ、ATG5、ATG7、ATG12和 GAPDH抗体(1∶1000稀释);回收一抗,用TBST洗膜3次,每次10 min;孵育HRP标记山羊抗兔IgG(二抗)(1∶10 000稀释)室温1 h;用TBST洗3次,每次10 min;采用增强化学发光底物试剂盒进行免疫检测。GAPDH作为内参蛋白,采用Image J软件对蛋白条带的积分吸光度进行定量分析。以目标蛋白条带与内参条带积分吸光度值比值表示目标蛋白的相对表达水平。

Tab.1 Sequence of primers for RT-PCR
1.9 统计学分析
2 结果
2.1 SCL对AA大鼠体质量的影响
结果显示(表2),D28,与正常对照组相比,模型组大鼠体质量明显下降(P<0.01)。与模型组相比,模型+SCL 50和100 mg·kg-1组可明显增加大鼠体质量(P<0.01),模型+SCL 100 mg·kg-1组大鼠体质量接近正常对照组。模型+Dex组与模型组相比,AA大鼠的体质量明显下降(P<0.01)。
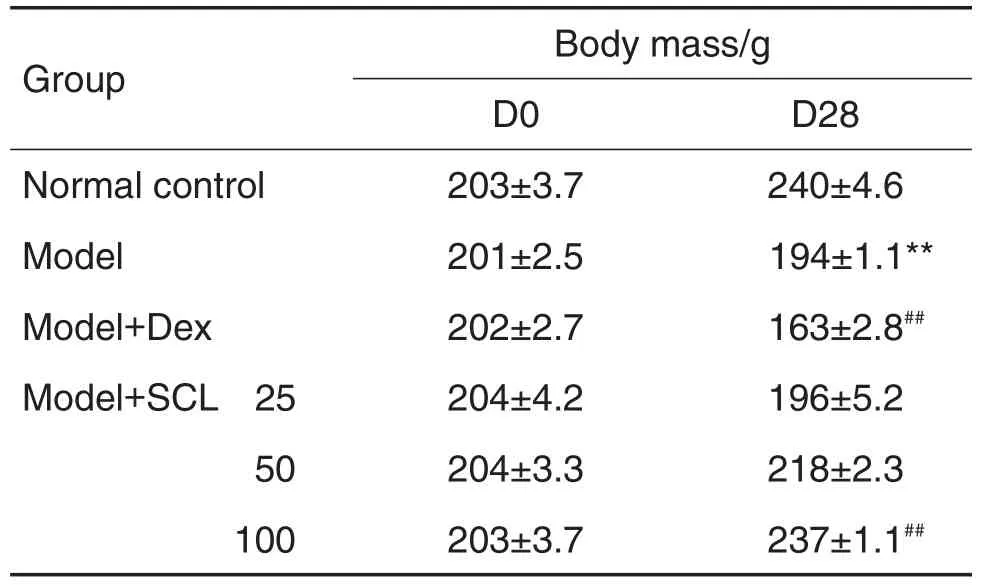
Tab.2 Effect of Schisandra chinensis lignans(SCL)on body mass of adjuvant arthritis(AA)model rats
2.2 SCL对AA大鼠足跖形态变化的影响
D1,注射CFA的大鼠足跖红肿明显。D28,模型组足跖肿胀明显,模型+SCL 25,50和100 mg·kg-1组大鼠致炎足跖肿胀明显减轻。D21,大鼠继发性炎症达到高峰。未发现注射弗氏佐剂的非致炎足出现红肿(图1)。

Fig.1 Effect of SCL on morphological changes of feet in AA model rats.See Tab.2 for the rat treatment.
2.3 SCL对AA大鼠足肿胀的影响
与模型组相比,模型+SCL组大鼠的足跖肿胀度明显减轻(图2)。D4开始,模型+SCL 100 mg·kg-1组大鼠足跖肿胀度显著降低(P<0.05,P<0.01)。从D24开始,模型+SCL 50 mg·kg-1组大鼠足跖肿胀度明显降低(P<0.05)。模型+Dec组大鼠从D4开始足跖肿胀度显著降低(P<0.01)。
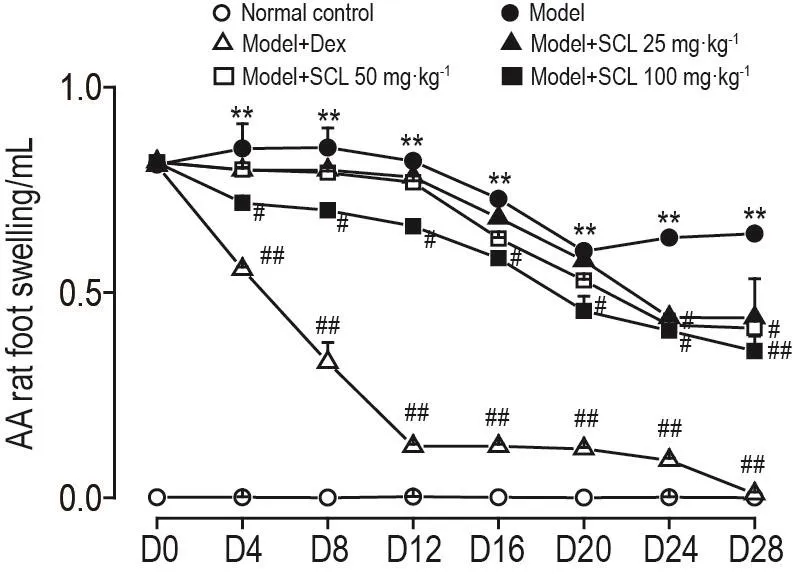
Fig.2 Effect of SCL on foot swelling in AA model rats.See Tab.2 for the rat treatment.±s,n=10.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model group.
2.4 SCL对AA大鼠胸腺和脾指数的影响
与正常对照组相比,模型组大鼠胸腺指数明显升高(P<0.01);与模型组相比,模型+SCL 25,50和100 mg·kg-1组大鼠胸腺指数显著降低(P<0.01),模型+Dex组胸腺指数明显降低(P<0.01)。与正常对照组相比,模型组大鼠脾指数明显升高(P<0.01);与模型组相比,模型+SCL50和100mg·kg-1组大鼠脾指数明显降低(P<0.01),模型+Dex组大鼠脾指数显著降低(P<0.01)(表3)。
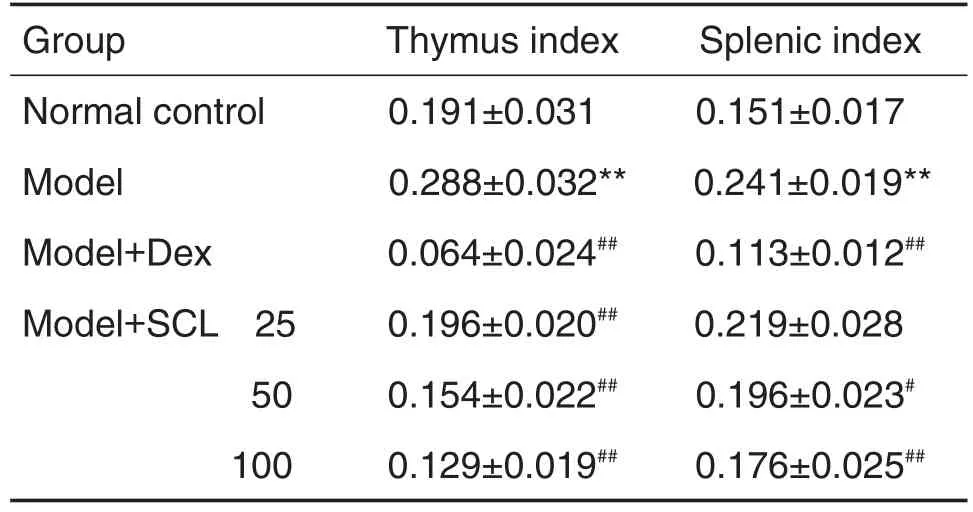
Tab.3 Effect of SCL on thymus and spleen index of AA model rats
2.5 SCL对AA大鼠关节组织的影响
HE染色结果显示(图3),正常对照组大鼠关节结构正常,软骨衬里、关节间隙及骨组织形态正常,滑膜内无炎症细胞浸润;模型组大鼠关节组织高度异常,滑膜明显增生,炎症细胞浸润,血管扩张。半定量关节病理评分结果显示,模型组炎症细胞评分、滑膜组织增生和OOCHAS评分显著升高(P<0.01)。与模型组相比,模型+Dex 0.25 mg·kg-1组大鼠关节组织炎症细胞浸润减少,炎症细胞评分明显降低(P<0.01),血管扩张减少,滑膜组织增生显著降低(P<0.01),趋于正常,软骨和骨侵蚀显著减轻,OOCHAS评分显著降低(P<0.01);模型+SCL 25 mg·kg-1组各病变改善不明显,模型+SCL 50 mg·kg-1组大鼠关节结构基本恢复正常,炎症细胞浸润减少,炎症细胞评分明显降低(P<0.05);模型+SCL 100 mg·kg-1组大鼠滑膜组织炎症细胞明显减少(P<0.01),滑膜组织增生显著减轻(P<0.01),软骨和骨侵蚀显著减轻,OOCHAS评分显著降低(P<0.01)。
2.6 SCL对AA大鼠足跖关节滑膜组织炎症因子mRNA表达水平的影响
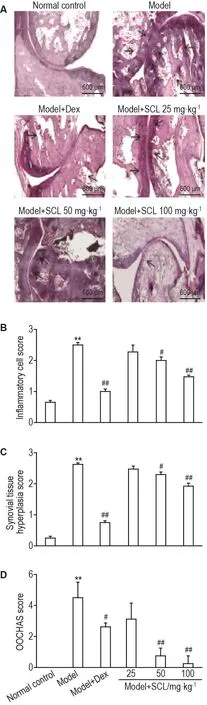
Fig.3 Effect of SCL on joint tissues of AA rats by HE staining.See Tab.2 for the rat treatment.Arrows show synovial hyperplasia,inflammatory cell infiltration,vasodilation,and cartilage destruction.±s,n=4.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model group.
与正常对照组相比,模型组COX-1,COX-2,TNF-α,IL-1β,IL-6和IL-17mRNA表达水平明显升高(P<0.05,P<0.01)。与模型组相比,模型+SCL 25,50和100 mg·kg-1组及模型+Dex 0.25 mg·kg-1组COX-1mRNA表达均无显著差异,模型+SCL 50 mg·kg-1组IL-1βmRNA表达显著降低(P<0.05),模型+SCL 100 mg·kg-1组IL-1β,COX-2,TNF-α和IL-6mRNA表达显著降低(P<0.05,P<0.01),模型+Dex 0.25 mg·kg-1组TNF-α,IL-1β,IL-6,IL-17和COX-2mRNA 表达水平显著降低(P<0.05,P<0.01)(图4)。
2.7 SCL对AA大鼠足跖关节滑膜组织自噬相关基因mRNA表达水平的影响
与正常对照组相比,模型组AMPK,Beclin1,LC3-Ⅱ,ATG5,ATG7和ATG12mRNA表达明显降低(P<0.05,P<0.01),mTORmRNA表达明显升高(P<0.01)。与模型组相比,模型+SCL 50和100 mg·kg-1组AMPK,Beclin1,LC3-Ⅱ,ATG5和ATG7mRNA表达明显升高(P<0.05,P<0.01);模型+SCL 100 mg·kg-1组mTORmRNA表达显著降低(P<0.05),模型+SCL 50和100 mg·kg-1组ATG12mRNA表达水平显著升高(P<0.01)(图5)。
2.8 SCL对AA大鼠足跖关节滑膜组织自噬相关蛋白表达水平的影响
与正常对照组相比,模型组AMPK,Beclin1和ATG12蛋白表达明显降低(P<0.05,P<0.01),mTOR,LC3-Ⅱ,ATG5和ATG7蛋白表达明显升高(P<0.05,P<0.01)。与模型组相比,模型+SCL 100 mg·kg-1组AMPK,Beclin1,LC3-Ⅱ,ATG5和ATG7蛋白表达明显升高(P<0.05,P<0.01);模型+SCL 25,50和100 mg·kg-1组mTOR蛋白表达明显降低(P<0.05,P<0.01),ATG12蛋白表达明显升高(P<0.05,P<0.01)(图6)。
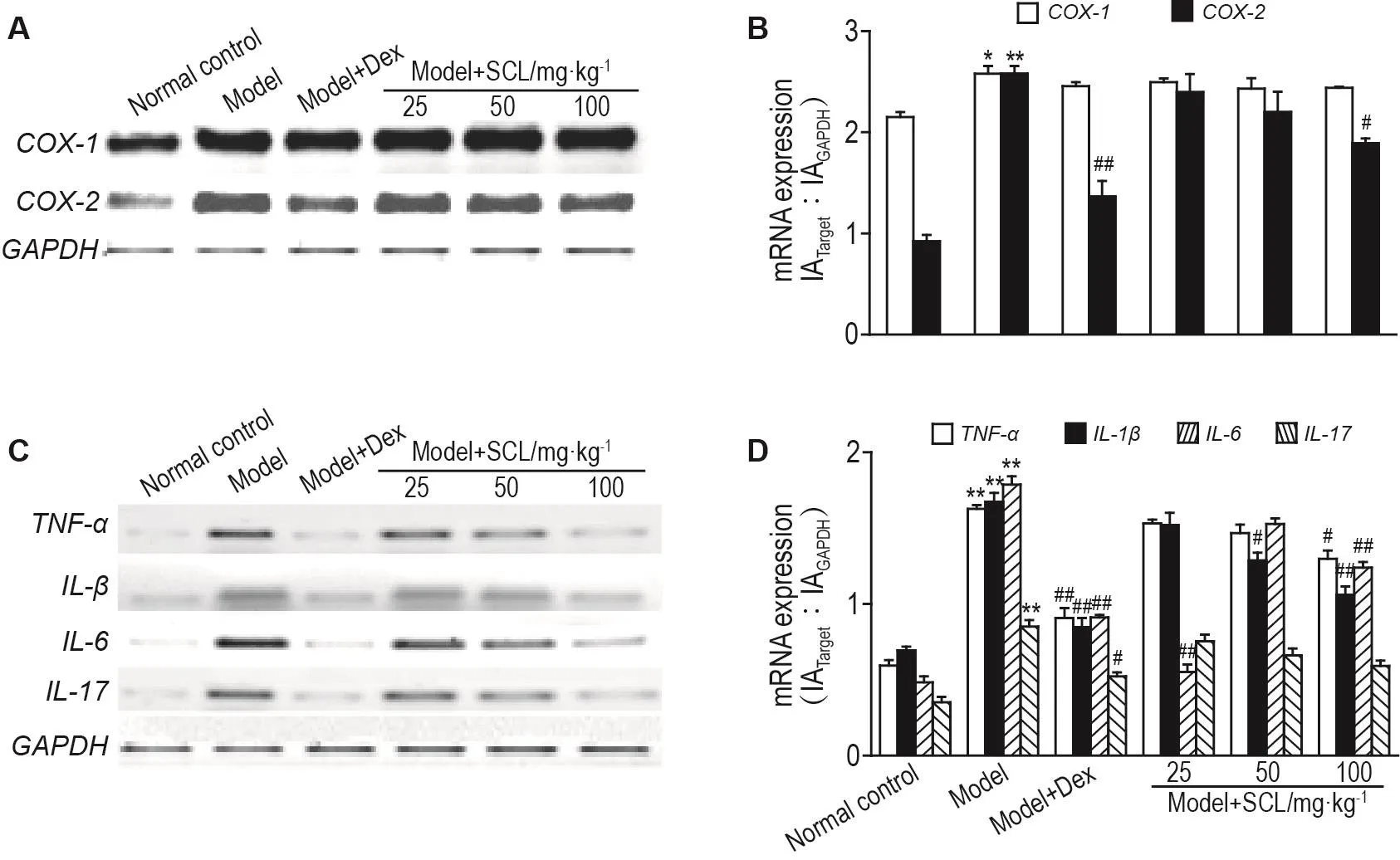
Fig.4 Effect of SCL on mRNA expressions of TNF- α,IL-1 β,IL-6,IL-17,COX-1 and COX-2 in joint synovial tissue of AA model rats by RT-PCR.See Tab.2 for the rat treatment.B and D was the semi-quantatitive result of A and C,respectively.±s,n=3.*P<0.05,**P<0.01,compared with normal control group;#P<0.05 ,##P<0.01,compared with model group.
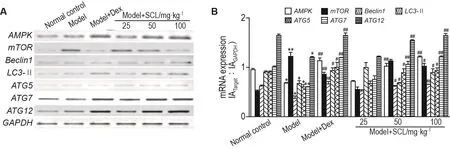
Fig.5 Effect of SCL on mRNA expressions of AMPK,mTOR,Beclin1,LC3-Ⅱ,ATG5,ATG7 and ATG12 in joint synovium of AA model rats by RT-PCR.See Tab.2 for the rat treatment.B was the semi-quantatitive result of A.±s,n=3.*P<0.05,**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model group.
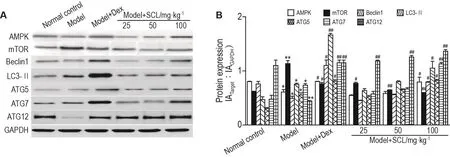
Fig.6 Effect of SCL on protein expressions of AMPK,mTOR,Beclin1,LC3-Ⅱ,ATG5,ATG7 and ATG12 in joint synovium of AA model rats by Western blotting.See Tab.2 for the rat treatment.B was the semi-quantatitive result of A.±s,n=3.*P<0.05,**P<0.01,compared with normal control group;#P<0.05 ,##P<0.01 ,compared with model group.
3 讨论
本研究结果显示,SCL可明显抑制AA大鼠足肿胀度;抑制AA大鼠关节滑膜组织增生和炎症细胞浸润,同时还可减少软骨损害,尤其是SCL 100 mg·kg-1组基本无炎症浸润现象。经过SCL治疗的AA大鼠致炎滑膜组织中TNF-α,IL-1β,IL-6,IL-17和COX-2mRNA表达显著降低。整体动物实验中SCL对炎症相关因子TNF-α,IL-1β,IL-6,IL-17和COX-2mRNA表达也具有抑制作用。提示SCL可抑制AA大鼠炎症反应。
RA患者体内由于糖酵解酶6磷酸果糖2激酶/果糖-2,6-二磷酸酶的不足使得T细胞糖酵解通量低和ATP缺乏[3,10],使得AMP与ATP的比值下降,使得患者体内细胞自噬相关AMPK-PI3K-mTOR信号转导途径激活,且使该途径的基因和蛋白表达异常[12]。而AMPK-PI3K-mTOR信号转导途径中AMPK和mTOR是启动细胞自噬通路的关键基因和蛋白。提示,RA患者体内的细胞自噬途径异常,可能成为RA发病的机制之一。
细胞自噬是通过降解细胞内长寿命蛋白和破损的细胞器来发挥保持细胞内环境稳定的作用[13]。巨自噬是自噬的主要形式,特别是依赖于自噬相关基因ATG调控的细胞生物学途径。一般情况下,自噬小体形成于内质网与线粒体之间的接触点。2个泛素类共轭系统(ATG12和ATG8/LC3-Ⅱ)将双膜自噬体延伸至胞质的一部分,利用与溶酶体相遇并融合的微管轨迹。AMPK活化并促进unc-51样激酶复合物的产生,并且阻滞mTOR生成,对细胞自噬产生促进作用。同时,unc-51样激酶复合物促进Beclin1的生成,进而激活自噬小体的产生,进一步促进LC3-Ⅱ的生成,此过程中,ATG7作为类E1泛素活化酶激活ATG12;然后ATG12被传递给类E2泛素转移酶,最后ATG12与ATG5结合形成复合物,促进自噬小体与溶酶体结合,使转运的物质与溶酶体结合,进而被细胞分解再利用[14]。ATG5,ATG7和ATG12存在一种级联关系,可能在表达时存在转录水平和翻译水平并不完全一致的情况,本实验结果中,正常对照组和模型组ATG5和ATG7 mRNA和蛋白表达结果存在差异,此差异可能是这种基因级联表达在AA大鼠模型中的体现,王亚黎[15]和李晓燕等[16]等在构建大鼠模型时也出现了相同的差异性。但这种差异性并不会影响基因的表达,这可能与自噬相关基因在AA大鼠模型中的合成和表达相关。本实验结果显示,SCL可以升高AMPK的表达水平,抑制自噬负调节蛋白mTOR的表达水平;同时也可使与AMPK级联的Beclin1和LC3-Ⅱ的表达水平显著升高。而调控自噬小体与溶酶体结合的ATG5,ATG7和ATG12表达水平也明显升高。说明SCL对AA大鼠致炎滑膜组织细胞自噬起到促进作用。
综上,SCL对CFA所致的AA大鼠的炎症反应具有治疗作用,其机制可能与其促进AA大鼠致炎滑膜组织中细胞自噬水平相关,为深入研究SCL的抗炎作用及其机制提供了实验依据。

