内皮细胞焦亡在心脑血管疾病中作用机制研究进展
吴昊霖,徐怡倩,方星悦,樊好飞,王 锐,易西南,刘启兵
(1.海南医学院基础医学与生命科学学院药理学教研室,海南省热带脑科学研究与转化重点实验室,海南 海口 571199;2.宁夏医科大学药理学系,宁夏 银川 750004)
内皮细胞(endothelial cells,EC)位于血液和间充质组织之间,是循环系统中率先感知相关内源性危险信号的细胞。结构完整和功能正常的EC构成保护屏障,能有效抵御各种危险因素,但过度刺激可诱发其损伤[1]。以往研究中,EC损伤的机制主要涉及炎症反应、氧化或硝化应激、物理及化学毒物刺激等,可导致细胞发生凋亡、坏死及自噬[2-3]。近年来,EC焦亡(pyroptosis)在心脑血管疾病中的作用日益受到关注。
焦亡是一种新细胞程序性死亡方式,可由多种因素诱发,包括缺氧、高糖高脂、氧化或硝化应激等,过度焦亡可进一步加重组织炎症及免疫反应,导致各种病理性损伤及相关疾病[4]。焦亡作为一种促炎症细胞死亡方式,在EC炎症损伤过程中占据重要地位[5]。最初对焦亡特征的描述是单核细胞或巨噬细胞中胱天蛋白酶1的激活[2]。然而,最近的研究表明,胱天蛋白酶家族其他成员,如胱天蛋白酶7、8和11也可引起焦亡,并且在EC中可观察到焦亡发生[4,6-7]。已证实,NF-κB、胱天蛋白酶1前体、胱天蛋白酶1、胱天蛋白酶4、5和11、消皮素D(gas⁃dermin D,GSDMD),白细胞介素1β(interleukin-1β,IL-1β)和IL-18等蛋白表达过度是EC焦亡发生的重要特征[2]。其中Nod样受体蛋白3(NLR family pyrin domain containing 3,NLRP3)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)和胱天蛋白酶1前体组成的NLRP3炎症小体通过感知细胞应激和病原体相关分子模式在EC胞浆中促进胱天蛋白酶募集和炎症因子激活,继而诱发或加重一系列心脑血管疾病[8-9]。
已有报道表明,EC焦亡可能与卒中、肺血管损伤和动脉粥样硬化等多种心脑血管疾病及糖尿病的发病机制有关[8,10-12]。2019年,ZENG等[2]发现,EC焦亡涉及各种血管功能的调节,这一过程在心脑血管疾病动物模型中被证实。通过药物或基因干预抑制这一过程具有一定的保护作用,是预防心脑血管疾病的潜在策略之一[3]。EC焦亡的发现拓宽了对心脑血管疾病损伤的认识,并为其治疗和预防提供了新的途径[8]。本文将综述EC焦亡的相关特征,阐明其在卒中、肺血管损伤和动脉粥样硬化等临床常见心脑血管疾病及糖尿病中可能的发病机制,并介绍部分潜在的干预靶点和动物模型。
1 EC焦亡与心脑血管疾病及糖尿病的关联性
1.1 缺血性卒中
脑缺血因血管出血或血栓形成阻塞血管引起脑供血紊乱,从而导致脑功能障碍[13]。目前治疗脑缺血的一线药物是重组组织型纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)[14]。然而,这也加剧了损伤部位的氧化应激和炎症反应。脑缺血状态下,氧气和营养物质供应减少,导致微血管EC肿胀,血脑屏障功能破坏,产生强烈炎症反应并触发脑组织损伤[12]。炎症产生的天然免疫反应在缺血性卒中的发病机制中起着基础性作用,也是脑缺血再灌注引起的微血管损伤和功能障碍的一个重要特征[15]。炎症环境使EC增殖和血管生成减弱,导致缺血预后恶化。2017年,GAO等[16]报道,在大脑中动脉栓塞脑缺血(middle cerebral artery occlusion,MCAO)模型中抑制胱天蛋白酶1能部分减少焦亡,并在模型中证实,脑EC中存在NLRP3蛋白高表达。随后,ZHANG等[15]研究表明,NLRP3是非临床卒中研究中研究最多的炎症-基质传感器分子之一,并发现GSDMD基因敲除小鼠的炎症因子IL-1β和IL-18下调,脑缺血卒中梗死面积缩小,改善了脑组织损伤。
1.2 出血性卒中
出血性卒中是一种高死亡率、高发病率的脑血管疾病。2020年,FANG等[17]发现,焦亡可能是出血性卒中病理进程的重要贡献者之一。此外,血脑屏障功能障碍与出血性卒中的发生发展至关重要[18]。EC一直以来都是出血性卒中研究的主要对象,并在血脑屏障中具有重要意义。焦亡参与了蛛网膜下腔出血和脑出血后的脑EC死亡过程,其引起的内皮功能障碍可能是血脑屏障损伤的关键因素[17,19]。他们还通过创伤性脑损伤(traumatic brain injury,TBI)动物模型显示出脑微血管EC出现焦亡,并检测到GSDMD被降解。同时,当焦亡过程被抑制时,血脑屏障功能得到改善。另一项研究表明,NLRP3和黑素瘤缺乏因子2(absent in melanoma 2,AIM2)炎症小体均在控制性皮质撞击(controlled cortical impact,CCI)小鼠模型被损伤的脑微血管EC中激活,并通过胱天蛋白酶1抑制剂有效地改善血脑屏障功能[20]。显示NLRP3/AIM2炎症小体介导的EC焦亡在出血性卒中的潜在治疗效果和调节血脑屏障损伤疾病相关进程中的特殊作用。
1.3 肺血管损伤
肺血管损伤是急性肺损伤(acute lung injury,ALI)和肺动脉高压(pulmonary hypertension,PAH)的核心组成部分,是疾病进程的标志之一[21-22]。EC排列在整个血管系统中,特别是肺EC约占所有肺细胞的50%,因此肺EC总是暴露于内毒素和脂多糖等病原体中,是肺病理性损伤中最先改变的细胞。肺EC通过影响肺和全身稳态,在宿主防御和微血管免疫监视功能中起基础性作用[23]。
ALI的特点是过度的宿主防御免疫反应,其核心致病特征是大量EC死亡和EC黏附连接解体导致肺内皮屏障功能破坏。研究发现,EC焦亡通过严重破坏内皮屏障、释放促炎细胞因子和肺水肿等方式参与肺血管损伤机制,进而影响ALI的病理性进程[21,24]。2017 年,CHENG 等[23]在 EC 特异性胱天蛋白酶11缺失(胱天蛋白酶11EC-/-)模型中证实,该基因缺失可阻止脂多糖诱导的肺血管EC通透性增加,显著提高ALI小鼠存活率。PAH是另一种与肺血管损伤相关的疾病,其特征包括肺动脉平滑肌增殖、EC增殖和功能障碍及上皮-间充质转化,并导致管腔变窄、血管阻力增加和肺动脉压升高,进而引起右心衰竭和死亡[10]。2019年,ZHANG等[22]研究发现,EC焦亡参与PAH肺主动脉血管损伤进程,并通过胱天蛋白酶1/11-/-小鼠模型和人脐静脉EC证实,抑制EC焦亡能部分改善PAH,但目前相关研究仍较少,有待进一步探讨。
1.4 动脉粥样硬化
动脉粥样硬化是一种与内皮功能障碍有关的慢性炎症性疾病[25],其特征是血栓形成、结构损伤以及血管壁增厚和硬化[9]。EC是线粒体功能障碍、氧化应激及炎症激活等引起动脉粥样硬化血管壁最先受损的细胞,功能失调的EC在动脉粥样硬化发生发展中起关键作用,并最终导致斑块破裂[7]。炎症小体通过激活细胞因子、分泌趋化因子和调控细胞死亡等方式对机体危险信号起重要作用。EC焦亡通过促进黏附因子的表达触发单核细胞黏附参与动脉粥样硬化的发生发展,并参与动脉内膜修复和损伤的过程,可促进脂质斑块形成,是内皮功能障碍和动脉粥样硬化形成的重要影响因素之一[25-27]。
2020年,ZENG等[28]报道,NLRP3-胱天蛋白酶1经典途径EC焦亡在动脉粥样硬化中起促进作用,几乎所有诱导NLRP3炎症小体的因素都被认为是诱发动脉粥样硬化的机制,抑制NLRP3炎症小体或EC焦亡可减轻动脉粥样硬化。血管EC通过组装和活化NLRP3炎症小体促进动脉粥样硬化炎症细胞浸润,导致斑块聚集,最终诱发动脉粥样硬化[26]。阿托伐他汀以剂量和时间依赖的方式在mRNA和蛋白质水平上抑制胱天蛋白酶1表达,通过NLRP3-胱天蛋白酶1信号通路抑制EC焦亡减轻动脉斑块聚集[26]。成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)通过改善动脉粥样硬化小鼠模型的脂质代谢,保护EC免受氧化低密度脂蛋白诱导的焦亡,并通过延缓小鼠动脉粥样硬化的恶化进程证实其具有调节动脉粥样硬化代谢紊乱的潜力[28]。动脉粥样硬化相关动物实验发现,EC焦亡引起的胱天蛋白酶1蛋白表达上调和GSDMD降解增多,并导致内皮炎症损伤,通过胱天蛋白酶1抑制剂和沉默NLRP3基因证实,EC焦亡通过激活NLRP3-胱天蛋白酶1信号通路诱发动脉粥样硬化[8,26]。因此,EC焦亡的机制可能为动脉粥样硬化的治疗提供新的思路。
1.5 糖尿病
EC焦亡贯穿于糖尿病整个过程,相关促炎因子与糖尿病进展密切相关。糖尿病肾病是糖尿病导致的一种严重微血管并发症,并且已成为终末期肾病最常见的诱发因素。2019年,GU等[11]报道,高血糖诱导活性氧通过NF-κB和硫氧还蛋白相互作用促进NLRP3炎症小体及其效应器活化,并发现激活的NLRP3炎症小体导致高糖处理的肾小球EC胞浆胱天蛋白酶1活化,质膜通透性增强和细胞核DNA损伤等。近期,YU等[29]又报道了糖尿病肾病患者和小鼠EC中NLRP3和胱天蛋白酶1的高表达,并表明其在糖尿病肾病中起关键作用。从而证实NLRP3-胱天蛋白酶1信号通路诱导的EC焦亡在糖尿病肾病的发生发展过程中起着重要作用。
2 EC焦亡的检测方法
2.1 形态学特征检测
从形态学上看,焦亡细胞具有坏死和凋亡双重特征[17]。2018年,LI等[30]通过荧光显微镜等手段观察到EC出现焦亡现象。同时,PEI等[5]通过共聚焦显微镜进一步观察形态学变化。EC焦亡经历了一系列细胞内变化,当细胞质排出时,细胞收缩,细胞骨架聚集,气球状小泡包裹细胞。细胞微丝开始出现边缘聚集,细胞骨架结构紊乱,随后细胞核固缩,DNA断裂,细胞完全收缩。
2.2 分子检测方法
单一的检测方法并不能很好验证焦亡的发生,合理选择焦亡检测方法对于研究EC焦亡发生发展及药物筛选具有重要意义。结合已有的研究结果对焦亡相关研究过程中的检测方法及分子指标进行总结(表1),可为抗EC焦亡药物的筛选提供参考。
3 EC焦亡相关的信号通路和药物靶点
3.1 消皮素D
GSDMD可被胱天蛋白酶1特异性切割成GSDMD-NT和GSDMD-CT,进而形成膜孔,参与EC焦亡的发生,被认为是控制EC焦亡的关键靶点之一[2,15,17,31]。2017 年,CHENG 等[23]发现,在 EC焦亡过程中,GSDMD被NLRP3-胱天蛋白酶1途径和AIM2-胱天蛋白酶1途径激活,同时还可直接被脂多糖诱导的胱天蛋白酶11激活。用脂多糖诱导EC焦亡,未结合GSDMD的表达减少,降解GSD⁃MD的表达增加。同时证实,通过敲除GSDMD可抑制体内和体外EC焦亡[5]。研究显示,GSDMD选择抑制剂(Ac-FLTD-CMK)和NLRP3/GSDMD抑制剂(MCC950)可显著减少EC细胞乳酸脱氢酶的释放,增强细胞活力,减轻细胞死亡,并抑制IL-1β的释放[4,32],表明GSDMD可能是一个特异性较高的干预靶点。
3.2 黑素瘤缺乏因子2
2018年,LUGRIN等[33]报道,AIM2通过N端热蛋白结构域相互作用招募ASC形成炎症小体,特异性检测受损DNA,以及胞浆中DNA的异常存在有助于启动并促进炎症小体组装。AIM2炎症小体不仅可作为病原体相关分子模式(pathogen-associ⁃ated molecular patterns,PAMP)的传感器激活NF-κB诱导NLRP3-胱天蛋白酶1信号通路,还可在干扰素诱导下特异性激活AIM2-胱天蛋白酶1通路介导GSDMD降解[34-35]。最近研究发现,AIM2在体外培养的人主动脉EC、平滑肌细胞和血管平滑肌细胞中均有表达[36]。AIM2在血管EC中的表达模式及其对心脑血管疾病中最显著的促炎细胞因子(IL-1β/IL-18)的上调,表明AIM2参与血管发病机制。同时还发现肿瘤坏死因子α、干扰素γ以及双链DNA是刺激主动脉EC中AIM2表达的诱因,EC可通过提高 AIM2 表达刺激促炎反应[33,36]。其后,GE等[20]研究发现,AIM2可促进小鼠EC中胱天蛋白酶1激活,其表达水平与胱天蛋白酶1水平呈正相关,胱天蛋白酶1水平与IL-1β的水平也呈正相关,提示在EC焦亡中存在AIM2-胱天蛋白酶1信号通路。
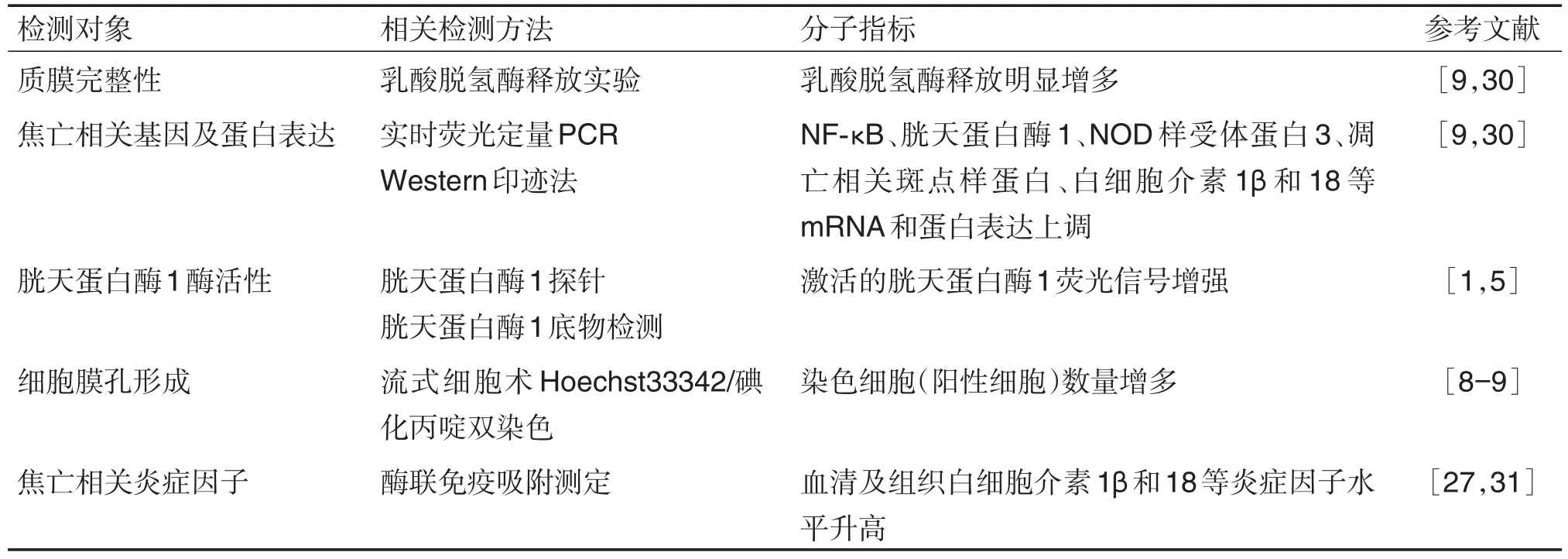
表1 焦亡相关检测方法及分子指标
3.3 Nod样受体蛋白3
NLRP3炎症小体是一种经典调控焦亡的大型多蛋白复合体,由N端热蛋白结构域相互作用招募适配器ASC,然后通过胱天蛋白酶-CARD和ASCCARD招募胱天蛋白酶1而形成[2]。NLRP3和胱天蛋白酶1作为上游标志物分子介导焦亡,通过激活下游关键因子IL-1β和IL-18的表达,产生炎症反应[30]。研究表明,NLRP3-胱天蛋白酶1信号通路被胞内活性氧诱导的NF-κB激活,参与多种心脑血管疾病,并在脑血管EC、动脉EC、静脉EC和肾微血管EC等多种EC中检测到其介导焦亡,参与并促进疾病发生发展过程[5,8,11,13]。NLRP3 炎症小体有着多种特殊靶点,包括抑制NLRP3炎症小体上游信号NF-κB、调节NLRP3炎症小体组装和抑制NLRP3炎症小体活化等。通过使用特定的siRNA对NLRP3、ASC或胱天蛋白酶1进行基因沉默可以实现NLRP3炎症小体各组分的抑制[1,37]。目前已有几种靶向NLRP3的药物用于非临床研究,如选择性NLRP3抑制剂(MCC950和BAY 11-7082)逆转细胞膜破裂和细胞溶解,显著减轻EC焦亡和炎症反应[1,4,32],显示靶向NLRP3炎症小体可抑制EC焦亡并降低心脑血管疾病风险的潜力。
3.4 胱天蛋白酶1
胱天蛋白酶1也是EC焦亡发生过程中的一个核心标志物蛋白,其参与了NLRP3-胱天蛋白酶1信号通路和AIM2-胱天蛋白酶1信号通路。目前以胱天蛋白酶1为靶点的研究已逐渐成熟,并出现多种相关靶点药物。胱天蛋白酶1特异性抑制剂(Ac-YVAD-cmk)特异性结合胱天蛋白酶1亚基,进而阻断NLR和AIM2炎症小体的组装,同时其还能抑制GSDMD的降解和ASC的寡聚,已证实Ac-YVAD-cmk能缓解大鼠受损脑微血管EC的炎症反应,是一种有希望参与临床试验的候选药物[20]。2015年,DENES等[38]报道,选择性胱天蛋白酶1抑制剂VRT-018858作为其拮抗剂pralnacasan前药的非肽活性代谢物,在卒中大鼠模型中显示出明显的保护作用。最近,LIU等[14]又报道了一种胱天蛋白酶1选择性抑制剂belnacasan(VX765)在体内转化为活性药物VRT-043198,通过抑制IL-18和IL-1β的成熟发挥强大的抗炎作用。
3.5 其他
EC还可能通过其他信号通路诱导焦亡,参与心脑血管疾病。2016年,YANG等[21]研究表明,脂多糖通过TLR4激活小鼠肺血管EC中的NLRP3炎症小体诱发焦亡,其EC特异性胱天蛋白酶11缺失(胱天蛋白酶11EC-/-)可阻止脂多糖诱导的胱天蛋白酶1降解,但对基础胱天蛋白酶1表达无影响。随后,CHENG等[23]报道,脂多糖可以直接激活胱天蛋白酶11参与EC焦亡,提示可能还有其他信号通路参与EC焦亡过程。心脑血管疾病中细胞焦亡相关靶点及动物模型总结见表2。
4 展望
近年来,内皮炎性损伤成为研究心脑血管疾病的新方向,焦亡在内皮屏障和心脑血管疾病中起重要作用,其中炎症、氧化应激、高血糖和缺氧均能通过不同的途径诱导EC焦亡(图1)。
图1展示了EC可通过典型和非标准信号通路引发焦亡,典型信号通路中细胞外病理环境(氧化应激、高血糖和缺氧等)、细胞内模式识别受体(DAMP和PAMP)以不同形式激活NLRP3和AIM2,招募衔接蛋白ASC和胱天蛋白酶1前体,诱导胱天蛋白酶1活化,继而降解GSDMD并释放促炎细胞因子IL-1β和IL-18,最终导致细胞肿胀和质膜破裂,诱发焦亡。氧化低密度脂蛋白可导致线粒体障碍,释放活性氧,促进NLRP3与ASC的相互作用,参与EC经典焦亡途径。非标准通路中,脂多糖降解EC膜激活ROSNF-κB信号通路和胱天蛋白酶11-GSDMD信号通路,触发GSDMD裂解和NF-κB活化诱发焦亡。
目前,EC焦亡影响心脑血管疾病发生发展的时空特性和促血管及周围组织炎性损伤的机制尚未明确。因此,需要进一步挖掘EC焦亡与心脑血管疾病关联性,以期为防治心脑血管疾病新型药物的开发提供参考。
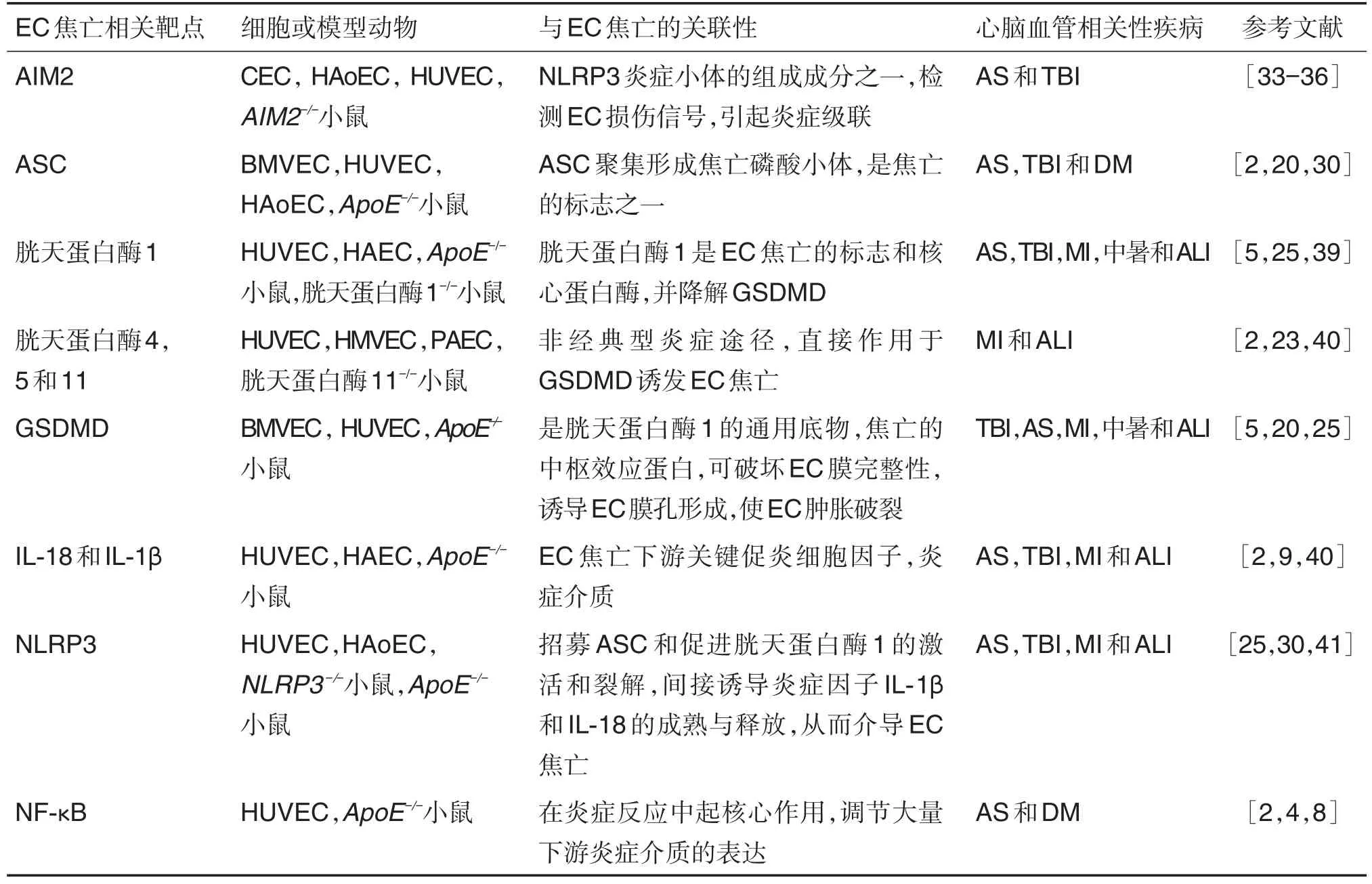
表2 心脑血管疾病中细胞焦亡相关靶点及动物模型
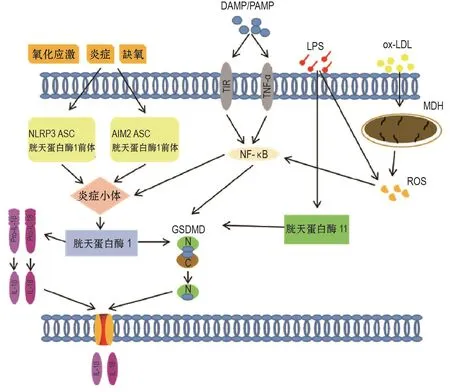
图1 多种危险因素及诱导因子介导焦亡通路.DAMP:损伤相关分子模式;LPS:脂多糖;MDH:线粒体障碍;ox-LDL:氧化低密度脂蛋白;pro-caspase-1:胱天蛋白酶1前体;pro-IL-1β:白细胞介素1β前体;PAMP:病原相关分子模式;ROS:活性氧;TNF-α:肿瘤坏死因子α.

