高效液相色谱-非特异性同位素稀释质谱联用技术定量分析全血中总血红蛋白含量
潘梦芸,冯流星,李红梅
(中国计量科学研究院,北京100029)
血红蛋白(HGB)是红细胞中负责运输和储存氧气的含铁蛋白,是判定贫血的重要标志物[1,2]. HGB含量水平低表示贫血,含量水平高通常可导致心力衰竭、心脏病发作或中风. 另外,HGB含量水平异常还会导致非常严重的遗传性疾病,如镰状细胞性贫血和地中海贫血. 鉴于HGB重要的生理功能,该项目的检测在临床检验中非常普遍. 根据法国健康保险(Sécurité Sociale)理赔统计,HGB 检测在血液生物标志物检测数量方面居首位,每年需花费约2.37亿欧元[3]. 因此,临床检验领域中HGB的准确测量对于相关疾病的诊断和健康评估具有重要意义. 目前,临床检验中针对总HGB含量的检测方法包括氰化高铁光度测定(HiCN方法)[4]和碱性羟基高铁血红素(AHD)方法等[5,6]. 大多数相关报道的HGB含量测量结果均通过上述方法检测得到. 但因前者使用剧毒的氰化钾而后者采用单一波长测定导致其使用受到限制,且结果无法追溯到国际单位制(SI)[7,8]. 近年来,欧盟IVD 指令及ISO17511,ISO17025等国际导则明确要求所有体外诊断产品的校准物和控制物的定值需具有溯源性,以确保测量结果的一致性和有效性[9~11]. 因此,需要建立准确、可靠且可溯源的全血中HGB的准确测量方法,以作为国际临床医学检验中的参考测量程序,从而促进全球医学检验领域HGB项目的等效测量和国际互认.
通过电感耦合等离子体质谱(ICP-MS)对蛋白质中的特征元素进行测量从而实现目标蛋白的定量分析,是近年来蛋白质定量技术研究的热点[12,13]. ICP-MS结合同位素稀释法(ID)及相关分离技术可以满足蛋白质高准确度定量的要求,通过元素定量可直接溯源到SI单位,溯源链短且更为清晰[8,14,15]. 因此,通过测定HGB中的铁(Fe)元素含量可以实现HGB绝对定量的目的. 文献[16~18]报道了采用57Fe浓缩同位素稀释剂定量HGB的HPLC-ID-ICP-MS方法,但其常应用于纯化的血细胞,鲜见对全血等复杂基体样品中HGB定量的报道. 此外,迄今尚未见对复杂全血基体中转铁蛋白(Tf)和HGB同时定量的研究报道,其主要困难在于样品基体复杂、存在其它蛋白的干扰且蛋白之间的含量差别较大,难以实现同时准确测量.
本文采用HPLC-ICP-MS与非特异性-ID相结合,通过测定目标蛋白中的Fe元素实现对全血中HGB的定量分析. 首先采用HGB 标准物质样品,通过在线HPLC-ID-ICP-MS 和样品整体消解后ID-ICP-MS进行测量并与标准值比较,验证了方法的准确性和可靠性. 在此基础上,应用到全血样品中HGB和Tf的定量分析,并考察了54Fe同位素稀释剂流速的影响,实现了2种蛋白的同时准确测量. 该方法准确、可靠,可直接溯源到SI单位,可作为国际临床医学检验中HGB检测的潜在参考测量程序.
1 实验部分
1.1 试剂与仪器
HGB 标准物质(IRMM/IFCC-467)购自欧盟标准物质与测量研究所(IRMM);人转铁蛋白(Tf)和人白蛋白(Alb)购自美国Sigma 公司;乙酸铵(NH4Ac)和三羟甲基氨基甲烷(Tris)均为色谱纯,购自美国Fisher Scientific公司;浓硝酸(HNO3,优级纯)购自北京化学试剂公司;全血样品、54Fe 浓缩同位素稀释剂(GBW04462,浓度为7.8337 μg/g,56Fe/54Fe 丰度比为0.11313)和铁单元素标准溶液[GBW(E)080123]由中国计量科学研究院提供.
Element 2型扇形磁场电感耦合等离子体质谱(ICP-MS,美国ThermoFisher Scientific 公司);高效液相色谱系统(HPLC,日本Shimadzu公司);Mill-Q超纯水系统(美国Millipore公司);TSK-Gel G3000SWxl凝胶柱(300 mm×7.8 mm,日本Tosoh公司).
1.2 实验过程
1.2.1 样品前处理 全血样品和HGB标准物质IRMM/IFCC-467均为液体,无需进行样品复溶. 使用前将这2 种样品在涡旋振荡器上进行均质化0.5 h,根据实验程序将样品稀释到合适的浓度进样. 在ID-ICP-MS分析过程中,所有制备步骤均通过重量分析完成,所有称量过程均经过空气浮力校正.
样品消解:准确称量0.02 g全血样品,添加1 g54Fe同位素稀释剂溶液,使混合样品中56Fe/54Fe丰度比约为1∶1. 加入3 mL HNO3,于185 ℃焖罐消解4 h后,将残留的HNO3蒸发至近干,并用去离子水稀释至约12 g,混合均匀后待测,平行制备5 个样品. IRMM/IFCC-467 样品的制备过程与全血样品相同.
HPLC-ID-ICP-MS分析样品前处理:将50 μL IRMM/IFCC-467样品溶液稀释至2 mL,涡旋15 min混合均匀进样至HPLC-ICP-MS中进行测量. 先将50 μL全血样品溶液稀释至2 mL,涡旋15 min使红细胞完全破裂并释放出HGB;然后,以8000 r/min 转速离心10 min 以去除细胞碎片并促进其均质化,重复3 次后进样至HPLC-ICP-MS 中进行测量[19,20]. 所有液相色谱样品在进样前均经过0.22 μm 有机相微孔滤膜过滤.
1.2.2 HPLC 分离条件 HPLC 分离采用TSK-gel G3000SWxl 色谱柱,流动相为12.5 mmol/L Tris 和125.0 mmol/L NH4Ac 的混合溶液,pH=7.8,紫外检测器波长280 nm,柱温30 ℃,流速0.35 mL/min,色谱分析时间程序:35 min,等度洗脱.
1.2.3 ICP-MS 分析条件 仪器功率1300 W,样品载气流速1.05 L/min,辅助气流速0.87 L/min,冷却气流速16.00 L/min,分辨率(m/Δm)4000,扫描次数700×1.
1.2.4 在线HPLC-ID-ICP-MS 定量分析实验 在测量HGB 中Fe 的含量时,通过岛津液相系统自带的LC-20AD 泵加入54Fe 稀释剂,与液相色谱的洗脱液经过三通混合后进入ICP-MS,在线测量混合溶液中56Fe/54Fe同位素比值Rm,并根据柱后同位素稀释公式(1),转化为待测元素在整个液相过程中的质量流(MFs)谱图[15].
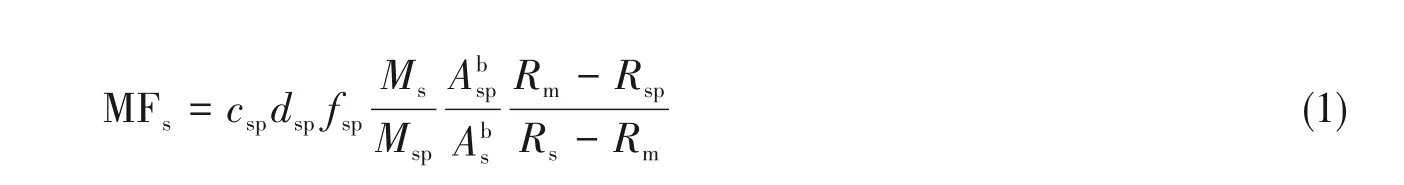
式中:csp和dspfsp分别表示富集同位素稀释剂的浓度(ng/g)和质量流速(g/min);Ms和Msp分别为蛋白质样品和同位素稀释剂中待测元素的相对原子质量;和分别为样品和稀释剂中核素b的丰度;Rs,Rsp和Rm分别为样品、稀释剂和混合样品中核素a与核素b的丰度比. 质量色谱图中相应蛋白质峰的积分可提供该蛋白质中Fe的绝对量. 根据每种蛋白质的进样量和其中Fe的物质的量之比,可以计算出目标蛋白质的浓度.
全血中HGB和Tf的含量差别较大(其中Tf为2.2~4.0 mg/g,HGB为100.0~150.0 mg/g),导致2种蛋白中Fe含量差别也很大. 为保证Rm比值合适,采用改变稀释剂流速的方法,在液相色谱时间程序的前22 min(Tf 出峰部分),选择54Fe 同位素稀释剂的流速为0.05 mL/min,然后增大至0.40 mL/min 以适应HGB中Fe含量的巨大差异,并且当流速改变时质谱信号也随之变化并逐渐达到稳定.
1.2.5 样品消解-ID-ICP-MS定量分析实验 首先将样品消解后采用ID-ICP-MS测定总Fe含量,然后根据尺寸排阻色谱(SEC)-HPLC-ICP-MS 检测的结果计算出HGB 中Fe 含量占总Fe 含量的比例,再根据HGB中Fe的物质的量之比换算即可得到HGB的浓度值. 样品测定结果的计算公式如下[21]:

式中:Rz,Ry和Rb分别为待测样品、稀释剂和混合后样品中被选定的2个同位素的丰度比;Riy和Riz分别为稀释剂和待测样品中第i个同位素与参考同位素的丰度比;n为最大同位素的序号;my和mz分别为混合时稀释剂和待测样品的质量;cy和cz分别为稀释剂和待测样品的浓度;Mi为第i个同位素的相对原子质量.
2 结果与讨论
2.1 标准物质IRMM/IFCC-467的绝对定量
采用SEC 分离IRMM/IFCC-467 样品的液相色谱图示于图1,可见HGB 的洗脱保留时间为26 min. 该样品是分离纯化后的HGB,因此其色谱图无其它杂质峰,且色谱峰峰型良好,表明该液相色谱分离条件合适,可用于下一步的实验分析.
采用富集同位素54Fe 溶液作为稀释剂,将标准蛋白用液相色谱柱洗脱后由LC-20AD 泵引入,ICP-MS 在线检测的Fe 信号强度谱图如图2(A)所示. 由于蛋白质中存在高丰度的Fe,经液相色谱洗脱后在线进入ICP-MS 中检测时,56Fe 会出现相应的质谱峰. 由于该样品为纯化的血细胞样品,其中的Fe 仅来自HGB,因此在ICP-MS 图谱中仅有1 个Fe 的信号峰. 由于LC-20AD 泵一直匀速向液相洗脱液中加入54Fe稀释剂溶液,因此54Fe信号强度基本保持稳定. 根据公式(1)对同位素比值进行数据处理可得到质量流谱图[图2(B)],对标准蛋白进行峰面积积分,计算出蛋白质中Fe的绝对质量,结合标准蛋白质中Fe的化学计量比和液相进样体积,即可计算出标准蛋白质的绝对浓度. 数据处理结果见表1.
由表1可知,测得的HGB浓度为(117.6±1.3)mg/g,测量值在标准值范围内,重复实验3次的RSD小于3%,证明实验结果及建立的方法可靠. 建立的柱后同位素稀释方法可通过直接测定金属蛋白中的金属元素来对蛋白质进行定量分析,具有精密度好、测量参数少且可溯源到SI单位等优点,实验过程中的仪器漂移及流动相的基体效应等因素对56Fe/54Fe测量的影响不大[22].

Fig.1 LC spectrum of IRMM/IFCC⁃467 reference material by SEC

Fig.2 ICP⁃MS spectra of IRMM/IFCC⁃467 via iron
为了对上述建立的方法进行补充,采用样品全消解的ID-ICP-MS 方法测量了HGB 样品中的Fe 含量. 由于使用的样品是由纯化血细胞制备而成,不含有其它含铁蛋白,因此其中的Fe全部来自于HGB. 通过公式(2)可计算出其中Fe的含量,进而根据Fe与HGB的摩尔比得到测量结果为(116.0±2.1)mg/g(表1). 通过比较发现2种方法的定量结果互相吻合,且在标准值的不确定度范围之内,证明了2种方法的准确性及可靠性.
2.2 全血样品中HGB和Tf的绝对定量分析
在前期建立的标准蛋白绝对定量方法基础上,将其应用于全血样品中HGB及Tf的绝对定量分析.与HGB 标准物质相比,全血样品基体复杂,其中的Fe不仅来自HGB,还可能来自于其它含有Fe的金属蛋白,因此所需要的实验条件更具有挑战性.为了实现全血样品中HGB及Tf的同时定量,首先采用SEC柱进行液相分离. 实验中考虑到HGB在色谱柱中的保留时间(见图1),可以通过优化的液相色谱条件分离2 种含Fe 的蛋白. 全血样品的液相色谱图如图3 所示,在保留时间为26 min 时洗脱了HGB. 对于21 min时的色谱峰,除了Tf外,其它分子量相似的蛋白质(如Alb)也有可能产生[23].但是,由于Alb中不含Fe原子,因此Alb的存在不会干扰到基于Fe元素的同位素稀释HPLC-ID-ICPMS方法中Tf的定量.
此外,通过ID-HPLC-ICP-MS同时定量Tf和HGB的另一个挑战是全血中HGB和Tf的含量存在较大差异,导致两者中Fe含量的巨大差异. 因此,在同时测量HGB和Tf中的Fe含量时,最佳56Fe/54Fe比值的选择尤其重要. 实验中,通过LC-20AD泵引入浓度恒定(100.4 ng/g)的54Fe富集同位素稀释剂溶液,并在线改变富集同位素稀释剂的流速以调整洗脱液中的最佳56Fe/54Fe比值. 如图4(A)所示,将54Fe富集同位素稀释剂的流速在前22 min(Tf 洗脱)中设置为0.05 mL/min,然后增大至0.40 mL/min 以适应HGB中Fe含量的巨大差异,并且当流速改变时,质谱信号随之变化并逐渐达到稳定,由此实现通过Fe在全血中同时测量Tf和HGB的目的.
图4(B)示出了由56Fe 和54Fe 的信号积分获得的56Fe/54Fe 比值以及通过公式(1)计算得出的Fe 元素的质量流量. 通过积分相应的峰,获得了HGB和Tf中Fe的绝对含量. 由于已知HGB和Tf中的Fe原子数,因此通过蛋白质中Fe的化学计量和进样量可以计算出全血样品中HGB和Tf的浓度. 由表2可见,总HGB和Tf含量分别为(115.3±2.4)mg/g和(4.6±1.4)mg/g,且均在人全血中的正常浓度范围内.

Table 1 Absolute quantitative results of IRMM/IFCC-467 reference materials(n=3)

Fig.3 LC spetrum of whole blood sample by SEC

Fig.4 Mass spectra of whole blood sample via iron
对于全血样品,由图4(A)中2 个Fe 元素峰计算得出Tf 贡献Fe 的质量分数为3.85%. 因此在采用样品消解-ID-ICP-MS测量过程中,扣除Tf中Fe 含量的贡献并结合公式(2),得到全血中HGB 含量为(115.5±2.1)mg/g,这与在线HPLCID-ICP-MS 方法的定量结果(图5)一致. 此外,根据流程空白值标准偏差的3倍计算可得该方法的检出限为1.0×10―7mg/g.
综上所述,以同位素稀释技术为基础,结合HPLC-ICP-MS 联用技术,通过对目标蛋白中Fe的测量,实现了复杂全血基体中Tf 和HGB 的准确定量. 该方法的RSD<3%,检出限为1.0×10-7mg/g,且可直接溯源到SI单位,克服了蛋白样品前处理复杂、定量偏差大及基体匹配标准物质匮乏等不足. 建立的基于ID-HPLC-ICP-MS 的复杂生物基体中大分子绝对定量技术可实现在基体样品中多种蛋白质的同时定量分析,为无机质谱定量蛋白质提供了切实可行的方法基础.

Table 2 Absolute quantitative analysis of total HGB and Tf in whole blood(n=3)

Fig.5 Comparison results of HGB measured by bulk⁃ID⁃ICP⁃MS and HPLC⁃ID⁃ICP⁃MS method

