荧光纳米探针用于细胞器pH检测的研究进展
公少华,张 霞,李 娜,唐 波
(山东师范大学化学化工与材料科学学院,分子与纳米探针教育部重点实验室,化学成像功能探针山东省高等学校协同创新中心,山东师范大学分子与纳米科学研究院,济南250014)
pH是一项重要的生理参数,它涉及细胞内吞、细胞增殖及离子转运等多种生物学过程,并且多数蛋白功能的发挥也只有在一定的pH范围内才能进行[1,2]. 因此,pH稳态对于活细胞的生物学过程以及细胞功能的发挥具有重要作用. 真核细胞内部pH的分布是不均一的,这主要是因为真核细胞内部存在不同的亚细胞器区室,这些亚细胞器以膜与周边细胞质隔开并发挥特定的功能,而这些特定功能的发挥需要依赖细胞器pH稳态[3,4]. 例如,细胞核的pH范围为7.2~7.4,高尔基体的pH范围为6.4~6.8,内体和溶酶体的pH范围为4.7~6.5,线粒体的pH≈8.0[5~8]. 细胞器pH稳态的破坏会导致细胞器功能的紊乱,最终可能诱发相关疾病[9]. 例如,溶酶体pH的升高与溶酶体贮积症有关,而免疫细胞成熟以及炎症的发生则会伴随溶酶体的酸化[10,11]. 线粒体pH 的紊乱与许多疾病的发生有关联,如阿尔兹海默症、雷氏症候群、癌症以及心血管疾病等[12,13]. 为了更好地阐明细胞器pH的变化在生理以及病理中的重要作用,发展有效的工具用于在亚细胞器水平上对pH的波动进行实时监测至关重要.
目前已有多种方法可用于pH 的测定,如H+渗透微电极法、核磁共振波谱法以及光学显微镜法等[14]. 但是这些技术通常需要使用高精度的仪器,并且样品的处理过程比较复杂,从而限制了其在活细胞水平上进行pH分析的应用. 荧光光谱分析具有响应速度快、信噪比高、非侵入及时空分辨率高的优点[15,16]. 因此,荧光探针非常适合用于活细胞细胞质以及亚细胞器pH的检测. 可以用于亚细胞器pH波动检测的荧光探针类型较多,有荧光蛋白变异体、小分子荧光探针及荧光纳米探针等. 荧光蛋白变异体的荧光发射在一定范围内受pH影响,因此可以用于在亚细胞器水平上对pH进行检测[17,18]. 然而,这些荧光蛋白变异体需要进行转染表达,增加了操作的复杂性,限制了其进一步应用[8]. 除荧光蛋白外,小分子荧光探针也可用于亚细胞器pH 波动的检测. 近年来,靶向线粒体[18,19]、溶酶体[20,21]、内质网[22,23]以及高尔基体[24,25]进行pH 检测的分子荧光探针被相继报道. 小分子荧光探针虽然能够实现检测,但其制备过程相对复杂,容易从细胞中外排,存在水溶性问题,有潜在的生物毒性[15,26~28]. 相对而言,荧光纳米探针易于制备,灵敏度、特异性及靶向能力更好,并且可在纳米颗粒上修饰多种荧光颜料分子,实现对多种分子的同时检测[29,30].
对于利用荧光探针进行pH成像的研究工作,2017年,Kim等[2]综述了利用荧光探针对亚细胞器pH进行成像的研究进展,对小分子荧光探针的研究工作进行了全面、详细的介绍,但对于荧光纳米探针的研究工作涉及较少. 2019年,Barati等[31]总结了利用不同种类的纳米传感器对细胞pH进行成像的研究工作. 本综述总结了近年来利用荧光纳米探针在细胞器水平上对pH 进行定量检测与成像的策略,并对该领域的前景以及所面临的挑战进行了展望.
1 细胞器pH检测
1.1 线粒体pH检测
线粒体是一种具有双层膜结构的亚细胞器,在细胞能量代谢、氧化还原调节、信号通路、钙离子稳态和细胞凋亡中起关键作用[32,33]. 其中,线粒体pH对于线粒体功能的发挥十分关键,只有维持线粒体pH在一定范围内,才能使线粒体正常发挥功能. 线粒体pH失衡会导致线粒体功能紊乱,并可能最终引发阿尔兹海默症、心血管疾病及癌症等疾病[34,35]. 因此,实时监测活细胞线粒体pH的变化对于深入研究相关疾病的致病机理十分重要.
1.1.1 基于硅纳米颗粒的荧光纳米探针 基于非侵入、高分辨检测的优势,荧光纳米探针非常适用于亚细胞器pH 的检测. 荧光纳米探针的制备需要以纳米颗粒作为载体,其中,介孔二氧化硅纳米颗粒(MNPs)具有良好的生物相容性、较高的负载能力,且其表面易修饰其它分子,适合作为荧光纳米探针的载体[36]. 此外,荧光纳米探针的设计还需要考虑检测准确性的问题. 基于单发射荧光信号峰的荧光纳米探针,其荧光信号容易受到探针浓度、激发条件、光漂白、环境和仪器条件等因素的影响. 相比之下,比率荧光探针可以产生2个不同发射波长的荧光信号,能够有效减少外界因素的干扰,实现对pH的荧光定量检测,提高检测的准确性[37,38]. 为了实现线粒体内pH的精准、定量测定,Tang等[39]发展了一种能够靶向线粒体的比率荧光纳米探针,他们选用介孔硅纳米颗粒(MSNs)作为纳米探针的载体,对其表面进行羧基化,进而修饰能对pH响应的氨基荧光素(AF,发射峰:515 nm)和作为参比单元的溴化乙锭(EB,发射峰:595 nm),形成MSNs-EB-AF. 为了防止染料的泄露以及进一步修饰线粒体靶向基团,在MSNs-EB-AF表面继续包覆一层氨基化的介孔二氧化硅. 然后,进行线粒体靶向基团(4-羧丁基)溴化三苯基磷(TPP)的修饰,最终形成能够靶向线粒体进行pH响应的比率荧光纳米探针. 实验结果表明,以488 nm作为激发波长,该比率荧光纳米探针的荧光强度比在pH 5.0~8.3范围内与pH呈线性相关,在pH 4~9范围内能够实现可逆变化. 在活细胞水平上,该探针能够靶向线粒体. 在MCF-7细胞营养剥夺的条件下,利用该探针能够检测出线粒体pH的降低.
线粒体是细胞内活性氧的主要产生部位,这些活性氧分子可以分为超氧阴离子自由基()、过氧化氢(H2O2)和羟基自由基(•OH)等不同种类. 线粒体活性氧的失衡会导致细胞损伤,并且与许多疾病的发生密切关联. 线粒体活性氧的变化通常伴随着线粒体pH的波动,因此同时检测活性氧和pH的变化非常重要[40~42]. 为了实现在线粒体内同时对H2O2和pH变化进行实时原位检测,Tang等[43]发展了一种荧光纳米传感器. 该纳米传感器以介孔硅纳米颗粒(MSN)作为载体,在其孔道内装载能够分别检测H2O2和pH 的分子荧光探针Cy-O-SeH 和荧光素,再利用静电相互作用将聚乙烯亚胺(PEI)包覆在MSN表面,用于封闭MSN的孔道,防止分子荧光探针泄露. 最后,利用酰胺键作用将三苯基膦修饰到纳米探针的表面,用于线粒体靶向. 实验结果表明,该荧光纳米探针可以靶向MCF-7活细胞线粒体,并且能在一定范围内实现对pH和H2O2波动的检测(pH:5.3~8.2,H2O2:0~150 μmol/L). 小分子药物二氯乙酸盐能够抑制线粒体丙酮酸脱氢酶激酶活性,将糖酵解代谢途径转变为葡萄糖氧化途径. 用二氯乙酸盐对MCF-7 细胞进行处理后,利用该探针能够对H2O2水平的上升和pH 的降低进行实时可视化成像.上述实验结果表明,该纳米探针能够实现活细胞线粒体H2O2和pH变化的实时原位检测(图1).

Fig.1 Schematic of the nanoprobe for imaging of mitochondrial pH and H2O2[43]
细胞自噬和凋亡是细胞自我毁灭的2种过程. 自噬是细胞处于饥饿状态下溶酶体降解相关物质的过程,用于提供三磷酸腺苷,维持细胞的营养与能量. 凋亡是一种编码细胞死亡形式,用于维持细胞稳态[45]. 这些生物学过程中往往伴随着活性小分子的变化,研究其动态变化对于阐释疾病的活性分子调节机制十分重要[46]. 为了检测细胞自噬和凋亡这2种生物学过程中pH和的动态变化,Tang等[47]设计了一种双比率荧光纳米探针,该纳米探针以掺杂有罗丹明B的MNPs作为参比内核,在其外层继续包覆一层二氧化硅,外层的二氧化硅层中掺杂有能够分别检测pH 和的Tpy-Cy 和DBZTC 分子. 为了防止荧光分子泄露,在二氧化硅的外层包覆壳聚糖,之后,通过共价键连接的方式修饰上三苯基膦,用于靶向细胞线粒体. 实验结果显示,该探针的相对荧光强度在0~1.7 μmol/L 范围内与浓度呈现线性变化,在pH 5.5~8.5范围内与pH呈现线性变化. 该研究通过饥饿状态诱导HeLa细胞发生自噬过程,通过L-丁硫氨酸亚砜亚胺(BSO)诱导HeLa 细胞发生凋亡过程,利用该探针进行检测. 结果显示,在自噬过程早期pH会下降,的水平几乎不变;而在晚期pH会持续下降,的水平会升高. 对于凋亡过程而言,凋亡过程早期pH会降低,的水平升高,晚期pH几乎保持不变,而的水平会持续升高(图2).

Fig.2 Schematic of the nanosensor formation and the structures of RhB,DBZTC and Tpy⁃Cy[47]
1.1.2 基于DNA四面体的荧光纳米探针 线粒体对于维持钙离子稳态也具有重要作用,此功能的发挥同样也需要维持相应的pH值[48]. 在脑缺血疾病模型中,钙离子稳态被打破,其水平的变化与pH的变化相关[49]. 因此,对这2 种活性小分子进行实时原位成像有助于理解其在生理病理过程中的作用.DNA四面体的形状和尺寸可以精准控制,生物相容性好,有多个位点可进行分子修饰,可用于多种活性分子的检测,并且被修饰分子的间隔距离可控,能够有效避免多种响应分子同时修饰到纳米颗粒上时荧光共振能力转移(FRET)产生的影响[50]. 为了解决神经元细胞线粒体中钙离子和pH变化的实时原位检测问题,Tian 等[51]在DNA 四面体纳米探针的4 个端点分别修饰三苯基膦、异硫氰酸荧光素(FITC)、AF660 以及钙离子探针(CD@CaL). 三苯基膦用于将该纳米探针靶向到线粒体;FITC 分子亲水、稳定且无毒,不受细胞器内酶的干扰,可以用于pH的检测[52];AF660作为参比荧光分子;钙离子荧光探针由合成的钙离子配体(CaL)和量子点(CDs)组成,可用于钙离子的检测(图3). 实验结果表明,该探针对钙离子的检出限为0.3 μmol/L,荧光强度比在1~390 μmol/L范围内与钙离子浓度呈线性关系,在pH 5.51~8.02范围内与pH呈现线性关系,证明该探针能够实现神经元细胞线粒体pH以及钙离子的检测. 作者利用该四面体比率荧光纳米探针研究了在诱导下神经元细胞死亡的信号通路.结果表明,的刺激能够诱导神经元细胞细胞质暂时性的酸化,进而激活线粒体膜ASIC1a通道,导致线粒体碱化以及钙离子过载. Aβ的聚集会导致细胞质pH的降低以及钙离子的爆发式增多,进一步通过ASIC1a导致线粒体酸化以及钙离子过载.

Fig.3 Schematic illustration of the working principle of the developed DNA nanoprobe for Ca2+and pH sensing[51]
1.1.3 基于聚合物的荧光纳米探针 聚合物纳米探针具有单颗粒亮度强、光稳定性好及毒性低的优点[53,54]. 基于聚合物纳米探针的优势,Gao等[32]首次利用半导体聚合物点作为载体,发展了一种比率荧光纳米传感器,对活细胞线粒体的pH进行了检测和成像. 在该策略中,三苯基膦被修饰到聚乙烯醇壬基苯基酯上形成TTO-CO-520,然后TTO-CO-520、聚(9,9-二-N-辛基芴基-2,7-二基)(PFO)、聚(9,9-二辛基芴)-(4,7-二-2-噻吩基-2,1,3-苯并噻二唑)(PF-DBT5)和聚(苯乙烯-顺丁烯二酸酐)(PSMA)通过共沉淀的方法形成荧光聚合物点. 该聚合物点含有羧基与线粒体靶向基团,可用于进一步修饰能够响应pH的非荧光指示剂(刚果红,CR). 在该比率荧光纳米探针中,PFO与PF-DBT5作为荧光能量供体,CR作为能量受体,当pH 发生变化时,CR 与PFO,CR 与PF-DBT5 的FRET 效率会发生改变. 利用380 nm的光对该探针进行激发,能够获得2 个发射波长(PFO:442 nm,PF-DBT5:616 nm),随着pH 的降低(8.96~2.57),PFO的荧光强度不会发生明显变化,PF-DBT5的荧光强度会降低,从而实现比率荧光检测. 实验结果表明,该探针的相对荧光强度比在pH 2.57~8.96范围内与pH呈线性相关;在pH 2.5~9范围内可实现可逆变化. 该探针能够靶向Raw 264.7细胞线粒体,并对线粒体pH进行定量检测(图4).

Fig.4 Schematic illustration of the mitochondria⁃targeted Pdots for ratiometric detection of pH in mitochondria[32]
为了解决荧光纳米探针的毒性问题,Wang等[5]发展了一种以低毒性的β环糊精聚合物为骨架的比率荧光纳米探针,用于成像活细胞线粒体pH变化. 2种亲酯性的染料——金刚烷标记的荧光素和金刚烷标记的罗丹明分别用作pH检测单元和参比单元,金刚烷标记的三苯基膦用作线粒体靶向基团. 基于主客体作用,β环糊精聚合物能够与亲酯性染料以及金刚烷标记的三苯基膦通过自组装形成比率荧光纳米颗粒. 该探针的相对荧光强度比在pH 4.0~9.0 之间能够呈现可逆变化. 利用该探针能够靶向HeLa细胞线粒体,对线粒体内pH的变化进行定量检测.
1.1.4 基于量子点的荧光纳米探针 利用光动力学疗法(PDT)治疗癌症,主要依赖于光敏剂产生活性氧对癌细胞进行杀伤[55]. 其中,过量的活性氧会导致线粒体过氧化,进而导致线粒体功能紊乱、凋亡,是治疗癌症的一种主要机制. 而细胞凋亡与线粒体pH 的变化密切相关,实时检测pH 的变化能够对PDT的治疗效果进行更好的评估[56]. 碳量子点作为一种荧光纳米材料,具有良好的光稳定性、化学稳定性及生物相容性,并且易于进行修饰[57,58]. 基于自然生物质制备的碳量子点被称为生物质量子点(BQDs). 这种生物质量子点成本低、易于大规模制备且环境友好[59],可以用于生物传感和成像. 为了实时监测PDT过程中pH的变化,Liu等[60]设计了一种基于BQDs 的诊疗一体化比率荧光纳米探针. 该探针既可以用于靶向癌细胞线粒体进行PDT,又能够对PDT过程中线粒体pH的变化进行监测. 其中,BQDs以碳量子点为基础,利用含叶酸的桂花叶制备,以单波长进行激发可获得双波长发射. 在BQDs上修饰聚氧乙烯二胺及叶酸分子,形成比率荧光纳米探针BQD-FAs. 叶酸分子能够使探针靶向癌细胞,探针表面的正电荷能够促进探针靶向线粒体. 由于探针表面富含叶绿素,所以在近红外光的照射下能够产生单线态氧,用于对癌细胞进行杀伤. 此外,在pH 3~8 范围内,该探针的荧光强度比(F490/F650)与pH值呈线性关系,可用于线粒体pH变化的检测(图5).
1.2 溶酶体pH检测
溶酶体是一种细胞内的酸性细胞器,内含水解酶,能够降解大分子和相关的细胞组分[61]. 溶酶体参与质膜修复、蛋白降解、病原体清除以及细胞内吞与自噬等过程,对于维持细胞稳态具有重要作用[62]. 这些功能的发挥都依赖于溶酶体pH稳态. 溶酶体pH的异常会导致溶酶体功能缺陷,进而导致相关疾病的发生[63]. 因此,对溶酶体pH进行检测十分重要.

Fig.5 Schematic illustration of the preparation and application of BQD⁃FAs[60]
1.2.1 基于硅纳米颗粒的荧光纳米探针 pH响应的荧光纳米探针可以通过2种方式聚集到细胞的溶酶体部位. 一种方式是在纳米颗粒表面修饰溶酶体靶向基团,使纳米颗粒能够主动靶向到溶酶体的位置;另一种方式是通过细胞内吞作用,使纳米颗粒能够最终自动聚集到溶酶体的位置. Tang等[39]报道了一种能够靶向溶酶体进行pH检测的比率荧光纳米探针. 该探针由MNPs修饰参比分子EB、pH响应分子AF以及溶酶体靶向基团3-(4-吗啉酰基)盐酸丙酸(MPP)而成,可定位于MCF-7细胞溶酶体,结合其它纳米颗粒,利用单一激发波长(488 nm)进行激发,能对溶酶体、线粒体以及细胞质pH的变化进行检测(图6). 在另一种策略中,Han等[64]利用MNPs作为载体,修饰对pH不敏感的分子罗丹明内酰胺以及pH敏感分子FITC,制得pH响应探针. 该探针的pH响应范围为3.5~6,并且能够通过内吞的方式聚集到L929 细胞溶酶体,对pH 进行检测. Bossi等[65]发展了一种具有良好生物相容性的pH 检测荧光纳米探针,螺罗丹明酰胺作为pH 响应分子被修饰到具有核壳结构的硅纳米颗粒上,使纳米探针能够快速、可逆、高灵敏且高选择性地进行pH检测. 实验结果表明,该荧光纳米探针能够定位于溶酶体,实现对pH的检测.
为了解决对溶酶体内pH 的实时、长时间成像问题,He等[66]发展了一种基于荧光硅纳米颗粒的pH 纳米探针. 在该探针中,荧光硅纳米颗粒上偶联有pH敏感的多巴胺分子以及pH不敏感的异硫氰酸罗丹明B 染料(RBITC)分子. 该纳米传感器与溶酶体染料的皮尔森相关系数高(0.9),能够在较宽的pH范围内(4~10)对pH的波动进行检测,具有良好的光稳定性,在长时间的紫外光照射下,不会发生明显的光强度减弱,适用于对溶酶体内长时间pH波动的检测(图7). 为了解决荧光探针光稳定性的问题,He等[67]利用免标记的荧光硅量子点作为载体,在其上共价连接AS1411适配体. AS1411是一种富含鸟嘌呤的DNA适配体,能够与癌细胞上过表达的核仁蛋白特异性结合. AS1411的末端修饰有pH敏感单元FAM,荧光硅纳米颗粒能够作为荧光参比单元. 该探针水溶性和光稳定性良好,荧光响应强度高,能够特异性地靶向MCF-7癌细胞并定位于溶酶体,结合流式细胞术,可对溶酶体的pH进行成像和定量分析.
溶酶体pH是反映溶酶体活性的一个重要参数,其变化也会受到其它因素的影响. 有研究[20]显示,局部的温度升高会上调溶酶体pH,所以测定pH时对温度的影响进行补偿非常重要. 细胞内的热量分布是不均一的,不同位置的温度相差约1 ℃,所以同时对pH和温度进行精准成像非常重要. Wang等[63]基于硅纳米颗粒发展了一种同时对pH和温度进行测定的纳米探针. 在该探针中,参比铕复合物和对温度敏感的探针罗丹明B被共价固定到硅纳米颗粒的内部,表面进行氨基修饰,氨基的修饰致使硅纳米颗粒表面带正电,能够促进探针被细胞摄取,并使探针最终聚集于溶酶体. 此外,氨基可进一步用于pH敏感探针荧光素的修饰. 实验结果表明,该纳米探针可在pH 3.0~9.0范围内对pH进行响应,在20~60 ℃范围内对温度进行响应. 该纳米探针能够被HeLa细胞摄取并主要定位于溶酶体,适用于监测溶酶体内温度和pH的动态变化.
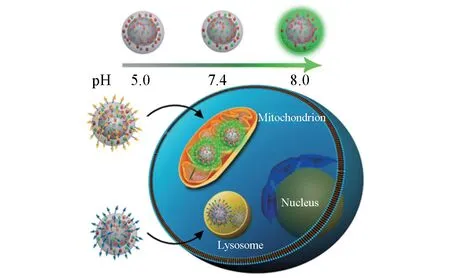
Fig.6 Illustration of the ratiometric fluorescence nano⁃sensors for imaging of subcellular pH[39]

Fig.7 Design of dual⁃modified SiNPs(DMSiNPs)⁃based pH nanoprobe[66]
1.2.2 基于金纳米颗粒的荧光纳米探针 为了解决溶酶体pH 精准测定的问题,Russell 等[9]发展了一种基于金纳米颗粒的比率荧光纳米探针. 在该探针中,蒽衍生物配体基于光诱导电子转移(PET)原理能够对pH 进行响应,罗丹明衍生物配体则作为荧光参比分子. 为了防止金纳米颗粒对2种分子荧光的猝灭,分别对这2种分子进行烷基链的修饰,使荧光分子与金纳米颗粒之间能够保持一定的距离. 最后,修饰有烷基链的2种分子通过金硫键连接到金纳米颗粒的表面,形成最终的比率荧光pH 纳米探针. 通过用364 nm 波长光激发,能够获得2种荧光分子的荧光发射峰. 该纳米探针的荧光强度比(I421/I580) 在pH 3.73~8.11 范围内随pH而变化. 该纳米探针能够被中国仓鼠卵巢(CHO)细胞摄取并最终聚集在溶酶体内,可以用于溶酶体pH的定量测定(图8).
1.2.3 基于聚合物的荧光纳米探针 为了解决聚合物纳米探针因聚集而导致的荧光猝灭问题,Smet 等[68]发展了一种基于超支化聚合物的聚集诱导发光的荧光纳米探针. 基于1,8-萘二甲酰亚胺染料分子具有的聚集诱导发光性质,将2种基于1,8-萘二甲酰亚胺的染料分子修饰到超支化聚合物纳米颗粒上,其中一种能够对pH进行响应,另外一种作为参比单元,制成比率荧光纳米探针对pH进行检测. 在水相中,该纳米探针能够发出荧光,并且能够在pH 4.5~8.4范围内响应pH的变化. 共定位实验结果表明,该探针可定位于HeLa细胞溶酶体,对溶酶体的pH进行测定. 为了拓宽纳米探针对pH的检测范围,实现活细胞内低pH条件下的比率测定,Søndergaard等[69]将3种pH敏感的荧光团二氟俄勒冈州绿、俄勒冈州绿、荧光素以及pH不敏感荧光团Alexa 568共价修饰到水凝胶中,构建了比率pH 荧光纳米探针. 多荧光团的使用拓宽了荧光纳米探针的pH 检测范围,使荧光探针能够在pH 1.4~7.0范围内响应pH的变化,从而用于溶酶体内pH的检测. Almdal等[70]发展了一种基于聚丙烯酰胺聚合物的比率荧光纳米探针,以罗丹明作为参比单元,俄勒冈绿作为pH敏感单元,利用反相微乳液技术形成聚合物纳米探针. 该探针能够在pH 4.1~5.7范围内对pH进行响应,并且可以通过内吞途径到达溶酶体,对溶酶体的pH进行检测. 为了更好地实现溶酶体内pH的比率荧光成像,Jiang等[71]通过微乳液聚合及表面修饰法构建了一种基于FRET 的比率荧光聚合物纳米探针(RFPNS). 在该探针中,4-乙氧基-9-烯丙基-1,8-萘二甲酰亚胺(EANI)作为供体,FITC 作为受体,同时也作为pH 响应单元. 当pH升高时,FITC能转变为一种环打开的状态,此时,EANI能够与开环状态的FITC发生FRET,从而实现对pH的比率荧光识别. 该纳米探针水溶性良好,能够定位在HeLa细胞的溶酶体内,可视化成像溶酶体pH的变化.
1.2.4 基于量子点的荧光纳米探针 量子点作为一种荧光纳米材料,其水溶性与光稳定性良好,本身可以用作荧光纳米探针的载体,并且由于其自身的荧光可以作为荧光纳米探针的参比,不需要利用其它的荧光分子作为参比单元. 基于量子点特有的优势,Wu等[72]将pH敏感单元FITC直接连接到碳量子点上,碳量子点与FITC分子构成FRET系统,从而构建了比率荧光纳米探针. 当pH降低时,413 nm处碳量子点的荧光发射强度会下降,531 nm 处FITC 的荧光发射强度会升高. 二者荧光强度的比值(I531/I413)随着pH的变化而变化. 该探针能够通过内吞的方式进入细胞并且聚集在溶酶体,可以对溶酶体pH进行检测.
为了解决量子点探针靶向溶酶体的问题,Wang等[73]合成了一种氨基功能化的碳量子点(ACDs)用于溶酶体pH的检测. 该量子点由柠檬酸和尿素制备而成,纳米颗粒表面羧基的含量高于氨基的含量,能够响应4.0~5.4范围内pH的变化. 该探针无需靶向基团的修饰,能够通过网格蛋白介导的内吞进入细胞并最终定位于溶酶体,与溶酶体染料的皮尔森相关系数为0.95. 利用该量子点荧光纳米探针,能够实现MCF-7细胞内溶酶体pH成像,在氯喹的刺激下可检测出溶酶体pH的升高. Xie 等[74]制备了一种能够靶向溶酶体的碳量子点荧光纳米探针,适用于在活细胞和活体水平上进行pH的检测. 该量子点由对苯二胺和硫脲制备,受到pH的影响时,量子点表面的电荷会发生变化,从而引起荧光强度的变化. 随着pH的升高,荧光强度会逐渐减弱,能够在pH 4~8的范围内响应pH的变化. 该探针可通过内吞作用进入HeLa 细胞的溶酶体内对pH的变化进行成像. 此外,作者以LPS诱导炎症模型,利用该探针在活体水平上对炎症过程中pH降低的变化进行了检测.
1.2.5 基于上转化纳米颗粒(UCNPs)的荧光纳米探针 UCNPs 是一类掺杂镧系离子的独特的纳米材料,能够将2 个或者更多低能量的光子转变成为1 个高能量的光子[75]. UCNPs 可以通过近红外光激发来获取可见光以及紫外光发射. 近红外光与可见光及紫外光相比,组织穿透深度更深,对于组织损伤小,可有效避免检测过程中光漂白以及背景荧光干扰等问题,从而提高荧光检测的准确性[76]. 基于上转换纳米颗粒特有的优势,Schäferling 等[77]发展了一种比率荧光纳米探针,pH 敏感分子pHrodo™红染料分子被共价修饰到包覆有硅壳层的上转化纳米颗粒表面用于检测pH的变化. 该纳米探针以980 nm的近红外光作为激发光,激发UCNPs发射550 nm波长的荧光,该荧光可以进一步用于pHrodo™红染料分子的激发,构成上转化共振能量转移(UC-RET),形成pHrodo™红染料分子590 nm处的荧光发射峰.由于受体染料分子少,所以UCNPs发出荧光的强度基本不会变化,因此上转化纳米颗粒本身可以作为参比单元. 该探针的荧光强度比在pH 3~6.7范围内与pH变化呈线性关系,能够用于测定溶酶体pH.基于类似原理,Kong等[78]将pH敏感分子FITC修饰到上转化纳米颗粒表面,构建了比率荧光探针用于溶酶体pH的检测. 不同的是,该UCNPs在980 nm的近红外光激发下,可获得475和645 nm 2个发射波长的发射峰,其中475 nm 的发射光可用于激发FITC 分子,645 nm 的光可作为参比荧光.I475/645在pH 3~7范围内与pH值呈线性相关. Li等[79]报道了一种基于双光子激发的比率荧光纳米探针. 该探针包含对pH不敏感的UCNP核,其在810 nm具有发射峰,可作为荧光参比单元. UCNP核上包覆介孔二氧化硅壳,在壳层的孔道中装载pH敏感的双光子染料分子反式-4-[对-(N,N-二乙氨基)苯乙烯基]-碘化甲基吡啶鎓(DMI),然后在二氧化硅壳层上进一步修饰β-环糊精,用于提高纳米探针的亲水性和生物相容性. 利用920 nm波长光进行激发,可获得610 nm处DMI的荧光发射峰及810 nm处上转化纳米颗粒的发射峰. 当pH升高时,DMI的荧光强度会显著上升,而上转换纳米颗粒的荧光几乎不变. 荧光强度比例I610/I810在pH 4.0~6.5范围内随着pH的升高而增大. 该纳米颗粒能够选择性地聚集在溶酶体内,对药物刺激下溶酶体pH的变化进行测定(图9).

Fig.9 Schematic of sensing mechanism of the TPE ratiometric fluorescent nanoprobe for intracellular pH measurement[79]
1.3 内质网pH检测
内质网是细胞中一类重要的细胞器,在钙离子稳态、脂质合成及折叠、膜的成熟和蛋白的分泌方面具有重要作用. 当内质网的功能受到外界条件干扰时,会产生内质网压力,内质网压力会诱导自噬过程的发生,导致内质网的酸化,这种酸化的过程与内质网诱导的疾病的发生有密切关系[80~82]. 因此,实时成像内质网的pH变化对于探究相关疾病的病理十分重要.
为了实现内质网pH 的检测,Wang 等[73]利用柠檬酸和尿素合成了一种表面带有氨基的碳量子点(ACDs),然后进一步修饰月桂胺,获得月桂胺修饰的碳量子点(LCDs). 该LCDs 能够响应6.2~7.2 范围内pH的变化,通过脂筏内吞作用和网格蛋白介导的内吞作用进入MCF-7细胞,聚集于内质网,与内质网定位染料的皮尔森相关系数可达0.92. 在抗炎药物地塞米松的刺激下,该探针可实现对内质网pH降低的检测.
2 总结与展望
本文综述了近年来利用不同类型的荧光纳米探针对细胞器内pH 进行实时成像与检测的研究进展. 这些荧光纳米颗粒具有自身特有的优势:介孔二氧化硅纳米颗粒易于合成、修饰且成本低;聚合物纳米颗粒水溶性良好且毒性低;量子点具有自发光性质与良好的光稳定性;上转化纳米颗粒可以利用近红外光进行激发,减少检测背景干扰. 总体而言,荧光纳米颗粒易于合成、光稳定性好、特异性强且受环境的干扰小,通过在荧光纳米颗粒上修饰多种响应分子,可用于实时、原位研究pH与其它活性分子之间变化的关系. 这对于研究由细胞器pH变化引起的相关疾病的致病机理具有重要意义. 但是,对于细胞器内pH 的检测还面临如下问题与挑战:(1)纳米颗粒易于合成、修饰,但经过多步修饰后,纳米颗粒往往容易发生聚集,其批次间合成的质量控制问题需要进一步解决.(2)荧光纳米探针在细胞内的不稳定性可能导致其在细胞内的分布不均,从而对pH的测定产生影响.(3)荧光染料分子修饰到纳米颗粒上,染料分子聚集所产生的猝灭效应会影响pH检测的准确性,进一步消除基于不同纳米材料荧光纳米探针的荧光猝灭效应,对于提高pH检测的准确性具有重要意义.(4)特定细胞器内pH的变化通常会与其它多种活性分子的变化相关联,需要进一步发展能够同时对pH和其它多种活性分子进行成像的荧光纳米探针,用于研究疾病发生过程中各种活性分子的实时变化.(5)活细胞细胞器pH的波动范围较小,需要进一步发展高灵敏的pH荧光纳米探针,对于细胞器内微小pH的变化进行精准检测.(6)目前的细胞器pH荧光纳米探针主要利用细胞器靶向基团实现细胞器的靶向,检测的细胞器多集中于线粒体和溶酶体,缺少对于内质网、高尔基体及细胞核等细胞器pH检测的荧光纳米探针,进一步发展靶向这些细胞器的荧光纳米探针进行pH检测,可为研究细胞器内的pH与相关疾病的关系提供合适的工具.

