安乃近代谢产物4-乙酰氨基安替比林的水生急性毒性研究
刘敏,殷浩文,王绿平,王樱芝,沈璐,朱慧
上海市检测中心生物与安全检测实验室,上海 201203
安乃近具有较强的解热镇痛功效,很长一段时间内大量用于临床治疗。但是该药具有较严重的毒副作用,比如,再生性贫血等,逐渐退出临床用药。发达国家如美国等禁止该药用于食源性动物中。欧盟规定其在肌肉中的限量为200 μg·kg-1[1]。在我国,安乃近由于价格低廉,仍大量用于猪、牛等食源性动物疾病防控。2002年,我国也将其列入限制清单,规定其在食源性动物组织中的限量为200 μg·kg-1[2]。
安乃近具有快速水解特性,水解产物4-甲氨基安替比林(MAA),安乃近的药理作用主要通过MAA产生。MAA的代谢产物主要为4-甲酰氨基安替比林(FAA)和4-氨基安替比林(AA),AA继续代谢,并最终代谢为4-乙酰氨基安替比林(4-AAA)[3]。早在1967年,Banerjee等[4]发现奶牛的血浆和尿液中存在大量的4-AAA。Martínez-Piernas等[5]发现废水中4-AAA浓度高达1.46 μg·L-1。采用此废水浇灌的萝卜和莴笋中的浓度为0.08~1.13 ng·g-1。Wiegel等[6]在欧洲中部的Elbe河中普遍检测出高水平的4-AAA,其最高浓度达939 ng·L-1。笔者之前的研究也发现,在上海市水源中,4-AAA浓度高达344 ng·L-1[7]。
然而,目前缺乏有关4-AAA的生态毒性报道,无法对其生态风险进行评估。为此本研究采用经济合作与发展组织(OECD)标准测试方法,从3个营养级水平,选取典型试验生物藻、大型溞和鱼,对其毒性效应进行评估,为后续生态风险评估提供数据。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
电子分析天平(Mettler Toledo AL204,梅特勒-托利多集团,瑞士),电子分析天平(Mettler Toledo ME204E/02,梅特勒-托利多集团,瑞士),智能光照空气恒温振荡器(TS-211GZ,常州恒隆仪器有限公司,中国),细胞颗粒计数器(Casy TT,Innovatis公司,德国),手持式pH计(HANNA HI98128,哈纳公司,意大利),照度计(KIMO LX100,凯茂公司,法国),偏光显微镜(Zeiss Axio Scope.A1,卡尔蔡司公司,德国),溶解氧测定仪(Oxi7310,WTW公司,德国),超高效液相色谱仪(Waters AcquityTMH-class/PDA eλDetection,沃特世公司,美国),恒温水浴槽(自制)。4-乙酰氨基安替比林,纯度97%,购自百灵威(中国);甲醇为色谱级,购自西格玛公司;其余试剂均为分析纯,购自国药集团。
1.2 试验生物
近头状伪蹄形藻引自中国科学院水生生物研究所。藻在实验室培养,试验前,在试验条件下培养藻细胞3 d,试验开始时,藻细胞处于对数生长期,浓度为1.09×106个·mL-1。2018年6月1日,用参比样品重铬酸钾进行质量控制试验,得72 h-ErC50值为1.00 mg·L-1(0.92~1.28 mg·L-1),在可接受范围之内((1.10±0.48) mg·L-1)[8]。
大型溞原种是引自MicroBioTests Inc.的大型溞休眠卵。试验用大型溞为实验室自行繁育的大型溞,经孤雌繁殖后所得的是溞龄小于24 h的非头胎幼溞。其各世代大型溞均饲养于Elendt M4中,投喂栅藻(Desmodesmussubspicatus)和近头状伪蹄型藻(Pseudokirchneriellasubcapitata),每日一次,每个成体每日0.1~0.2 mg有机碳。2018年9月,用参比样品重铬酸钾进行质量控制试验。重铬酸钾的24 h-EC50为1.42 mg·L-1,在可接受的范围内(0.6~2.1 mg·L-1)[9]。
稀有鮈鲫(Gobiocyprisrarus)由上海市检测中心生物与安全检测实验室自行繁育。试验鱼在试验条件下已驯养14 d以上。驯养条件为:活性炭过滤、紫外灭菌的自来水,同时也用作试验用水;21~25 ℃,变化不超过2 ℃;pH范围为6.0~8.5;溶解氧浓度>80% ASV(即大于空气中饱和氧含量的80%);光照周期L∶D=12 h∶12 h;每天喂食丰年虾薄片,试验开始前24 h停止喂食。驯养期间未发现疾病。试验开始前7天内试验鱼死亡率为0%。2018年6月,用参比样品重铬酸钾进行质量控制试验。重铬酸钾对稀有鮈鲫的96 h-LC50值为257 mg·L-1(95%置信限为207~309 mg·L-1),在实验室内部质量控制的标准之内(82.2~310 mg·L-1)。
1.3 急性毒性试验
4-AAA的水生急性毒性通过藻类生长抑制试验[10]、大型溞活动抑制试验[11]以及鱼类急性毒性试验[12]进行评估。
1.3.1 溶液制备
称取一定量的样品直接溶解于各试验用水中,避光连续磁力搅拌72 h,产生漩涡高度为样品液柱高度的1/3,经0.45 μm硝酸纤维素膜过滤后配制成浓度为1 500 mg·L-1或3 000 mg·L-1的样品母液。用试验用水稀释样品母液,配制成各浓度的试验溶液。
1.3.2 藻类生长抑制试验
预试验结果表明,1 500 mg·L-14-AAA暴露条件下,未观察到明显的生长抑制现象;因此,以1 500 mg·L-1的配制浓度进行限度试验,试验溶液体积100 mL,每组设6个平行。以藻类培养液作为空白对照组,设6个平行。藻细胞初始浓度约为104个·mL-1,试验持续72 h。试验条件为:22.8~23.1 ℃;培养基表面保持连续光照,光照强度4 988~5 554 lux;0 h和72 h,试验溶液pH范围分别为8.01~8.02和9.12~9.16。在试验开始后0、24、48和72 h,从各样品组中选取1个容器,从中各取2 mL试验溶液用于浓度分析。试验开始后0、24、48和72 h,对各试验容器内的藻类数量和形态进行测定。
1.3.3 溞类急性运动抑制试验
预试验结果表明,1 000 mg·L-1的4-AAA对大型溞的活动存在明显抑制;因此,开展系列浓度暴露的正式试验。试验开始前测得样品母液(3 000 mg·L-1)pH值为6.78,不需要调节pH。用Elendt M4稀释样品母液,配制成各浓度试验溶液。试验设置1个空白对照组和5个暴露组,暴露组的配制浓度分别为188、375、750、1 500和3 000 mg·L-1。各组均设置4个平行,各平行试验样品体积为250 mL,试验持续48 h,试验方式为静态。试验用水硬度为145 mg·L-1;pH值6.68~7.01;温度20.1~20.5 ℃;溶解氧浓度7.03~8.31 mg·L-1;光照周期L∶D=16 h∶8 h;每个平行5只溞,试验期间不饲喂。在0、24和48 h分别观察并记录试验幼溞的活动抑制数。在试验开始和结束时从空白对照组和样品组各选取1个容器分别取20 mL试验溶液进行样品浓度分析。
1.3.4 鱼类急性毒性试验
预试验结果表明,1 500 mg·L-1暴露条件下,鱼未发生死亡现象。以1 500 mg·L-1的配制浓度进行限度静态试验,试验溶液体积4 L。同时设置空白对照组,不设平行。在每个试验组容器中分别放入10尾试验鱼,试验持续96 h,试验期间不喂食。承载量约0.5 g·L-1(以鱼体质量计)。温度21.8~22.4 ℃;光照周期L∶D=12 h∶12 h;溶解氧为84.4%~91.2% ASV;pH 7.03~7.57。试验开始和结束,分别从暴露组和空白组各取2 mL试验溶液用于浓度分析。试验结束时,试验鱼体长为(2.4±0.1) cm(Mean±SD),体重为(0.24±0.04) g(Mean±SD)。
1.4 化学分析
采用超高效液相色谱对试验溶液进行分析。首先对各试验介质进行系统的方法验证,主要包括线性范围、回收率、精密度、检测限和定量限。试验开始和结束时,样品测试中均添加加标样品进行质量控制。分析条件如下:色谱柱为BEH C18(2.1 mm×50 mm, 1.7 μm);检测波长为257 nm;流动相流速0.4 mL·L-1,流动相为甲醇(A)和水(B),梯度洗脱程序为初始比例V甲醇∶V水=98∶2,保持0.5 min,2 min内甲醇含量增加到30%,保持3 min,0.5 min之内回到起始点并平衡1.5 min。
1.5 数据统计
采用t-Test比较样品组与空白对照组之间的平均特定生长率和生长量的差异,从而获取无可观察效应浓度(NOEC)和最低可观察效应浓度(LOEC)值。采用Maximum Likelihood-Probit进行浓度效应拟合,计算效应浓度(ECx)。数据分析用软件Toxcalc v5.0.32完成。
2 结果与讨论(Results and disscussion)
2.1 浓度分析
对藻、溞和鱼试验各试验基质中的分析方法均经过系统的方法验证。线性范围为0.0535~1.07 mg·L-1,线性方程为Y=1.07×104X+33.8,相关系数为0.9999。空白均不存在干扰,0.0642 mg·L-1和0.856 mg·L-1藻、溞和鱼基质加标样品的回收率分别为97.0%和96.3%、95.6%和95.1%、98.1%和99.5%;对应的精密度分别为1.49%和0.46%、0.84%和0.33%、1.30%和0.58%。方法检测限和定量限均为0.0268 mg·L-1和0.0535 mg·L-1。质量控制样品的回收率为99.8%~104%。
藻类抑制试验、大型溞活动抑制试验和鱼类急性毒性试验中,各试验溶液的样品实测浓度与配制浓度偏差均小于20%,分别-2.47%~2.80%、-8.27%~0.00%和2.00%~2.13%(表1)。
2.2 毒性效应
2.2.1 藻类生长抑制效应
空白对照组藻细胞浓度从1×104个·L-1增加到1.14×106个·L-1,增加至114倍(表2);平均特定生长率1.58 d-1,空白对照组各时间段特定生长率的变异系数平均值为19.7%(表3);整个试验期间,空白对照组各平行的平均特定生长率的变异系数为2.31%。整个试验满足OECD 201质量控制要求[10]。
暴露组藻细胞浓度从1×104个·L-1增加到1.10×106个·L-1,增加至110倍;跟对照组相比,生长量抑制率为-13.5%~13.7%(表2)。平均特定生长率1.59 d-1,空白对照组各时间段特定生长率的变异系数平均值为17.6%;跟空白对照组进行比较,特定生长率抑制率为-2.53%~3.16%,平均抑制率仅为0.63%(表3)。统计结果表明,4-AAA对近头状伪蹄形藻(Pseudokirchneriellasubcapitata)的72 h生长抑制效应,若以平均特定生长率和生长量表示,72 h-NOEC均≥1 502 mg·L-1,LOEC、EC10及EC50均>1 500 mg·L-1。
2.2.2 大型溞活动抑制效应
试验结束时,空白对照组大型溞活动受抑制率为0%,试验溶液的溶解氧浓度最低值为7.62 mg·L-1。满足OECD 202试验所有质控要求[11]。
整个试验过程中,375 mg·L-1及以下浓度组在试验期间未观察到明显的活动抑制。但24 h后,750 mg·L-14-AAA暴露组,3只大型溞出现活动抑制,1 500 mg·L-1的暴露组,抑制数量达到11只,而最高暴露组中,80%的大型溞的运动能力明显受到抑制。暴露48 h后,抑制率明显增加,750 mg·L-1组,运动能力受抑制的数量增加到8只,而1 500 mg·L-1和3 000 mg·L-1暴露组的抑制率分别达到70%和95%(图1)。
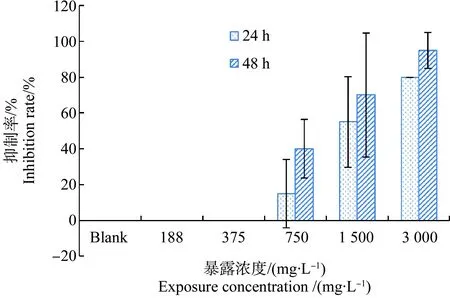
图1 不同4-乙酰氨基安替比林(4-AAA)暴露浓度下大型溞的活动抑制率Fig. 1 Mobility inhibition rate of daphnia when exposed to different concentrations of 4-acetamidoantipyrine (4-AAA)
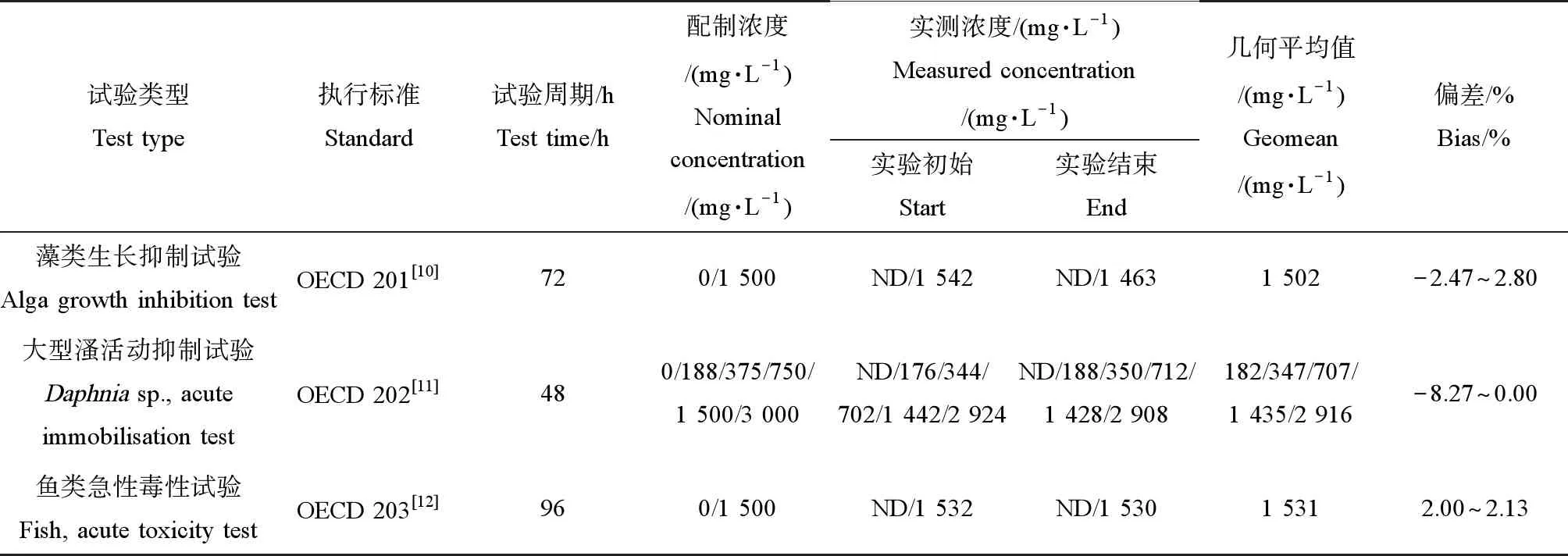
表1 样品的浓度分析结果Table 1 The results of samples analysis
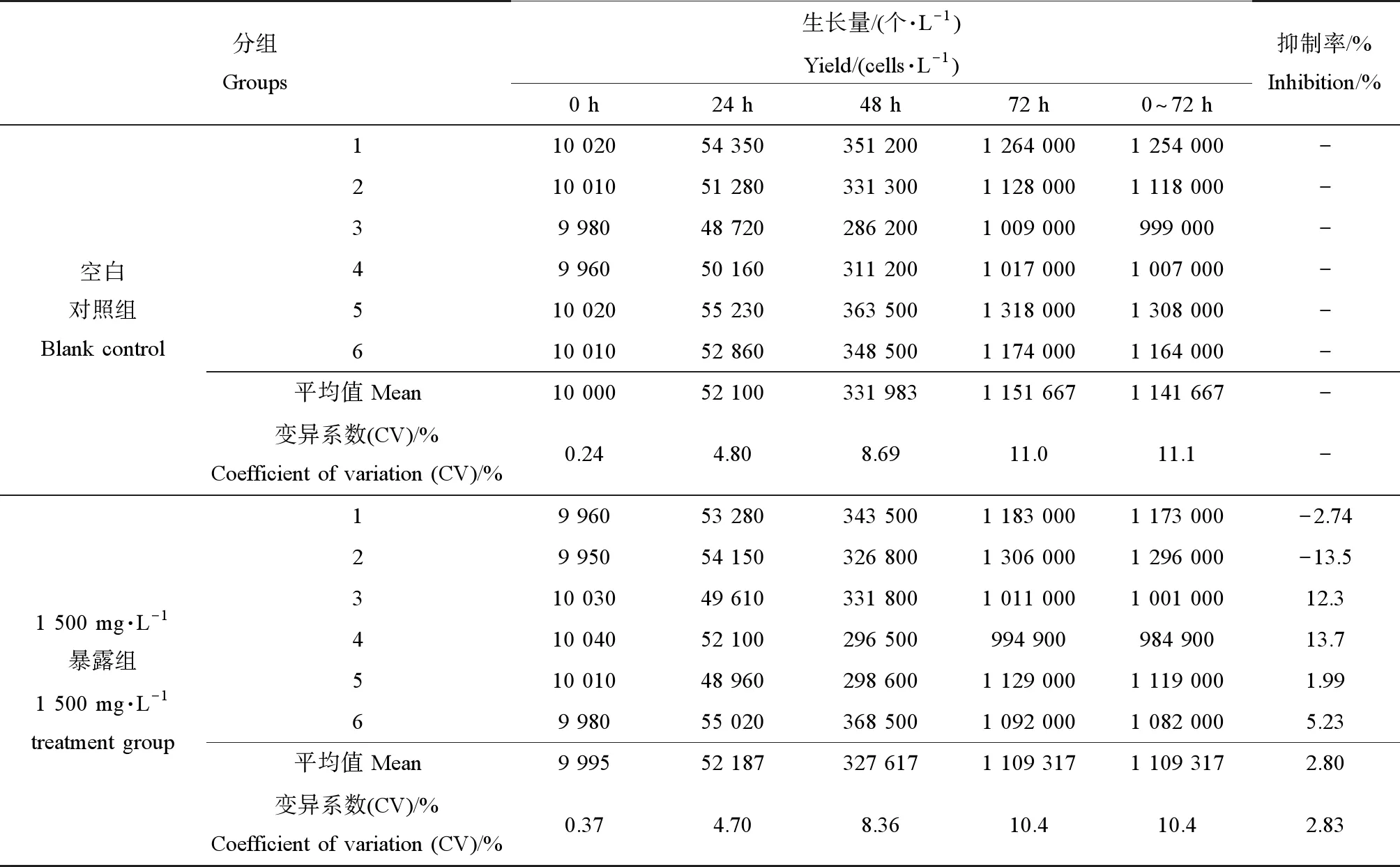
表2 72 h内藻的生长量Table 2 Yield of alga in 72 h
浓度效应拟合曲线(图2)分析结果表明,对大型溞(Daphniamagna)活动抑制的24 h-EC50值为1 538 mg·L-1,95%置信区间为1 217~2 017 mg·L-1;48 h-EC50值为1 041 mg·L-1,95%置信区间为834~1 304 mg·L-1。
2.2.3 鱼类急性致死效应
试验结束时,空白对照组鱼无死亡现象。试验溶液的溶解氧为79.1%~91.3% ASV。满足OECD 203试验所有质控要求[12]。
试验过程中,暴露组试验鱼均未出现死亡和异常行为。试验溶液中样品实测浓度的几何平均值为1 531 mg·L-1。因此,4-AAA对鱼类无急性毒性,96 h-LC50为≥1 531 mg·L-1。
Zhou等[13]采用ECOSAR软件估算其对藻和鱼的急性毒性,测算得到的EC50和LC50分别为2.53 mg·L-1和6.05 mg·L-1。这可能是由于ECOSAR数据库中与4-AAA结构类似的化合物数据较少,导致预测结果偏差较大。Gong等[14]的研究表明,其母体化合物安替比林及其催化降解产物对普通小球藻(Chorellavulgaris)在1~50 μmol·L-1范围内没有抑制效应。另外,催化降解过程中,随着安替比林的降解,对丰年虾(Artemiasalina)的致死效应降低。这表明,其降解产物毒性下降。
2.3 分类及风险评估
根据全球化学品统一分类和标签制度(GHS)分类[15],急性毒性终点>100 mg·L-1,无明显急性毒性,急性毒性不归类。根据欧盟风险评估导则,获得3个急性毒性数据的情况下,风险评估因子为1 000[16]。选取急性毒性最大的终点值,即大型溞活动抑制的48 h-EC50为1 041 mg·L-1,由此计算4-AAA的预计无效应浓度(PNEC)为1.04 mg·L-1。其类似物4-甲基氨基-安替比林的PNEC为961 μg·L-1[17]。笔者列出了国内外地表水中4-AAA的浓度(表4)。将地表水的测试浓度除以PNEC得到风险商值(RCR)。由表4可知,我国地表水中由4-AAA引起的风险值处于较低水平。尽管欧洲污水受纳河中4-AAA高达3 675 ng·L-1,其最大风险值为3.53×10-3,表明风险较低。由此判断,水中4-AAA污染引起的生态风险较低。北京的生活污水处理厂的出水中4-AAA浓度达1 300~2 240 ng·L-1[18]。西班牙的污水处理厂出水中4-AAA更是高达25 μg·L-1[19]。Shao等[20]采用Toolox软件计算的方法筛选基因毒性化合物,认为4-AAA具有潜在的基因毒性。同时检测出基因毒性的地表水中也鉴别出了4-AAA。因此,尽管从现有的测试数据来看,生态风险较小,但仍需关注其对地表水的影响。因为,现有的生态毒性数据有限,评估存在较大的不确定性,后续需关注其慢性毒性。
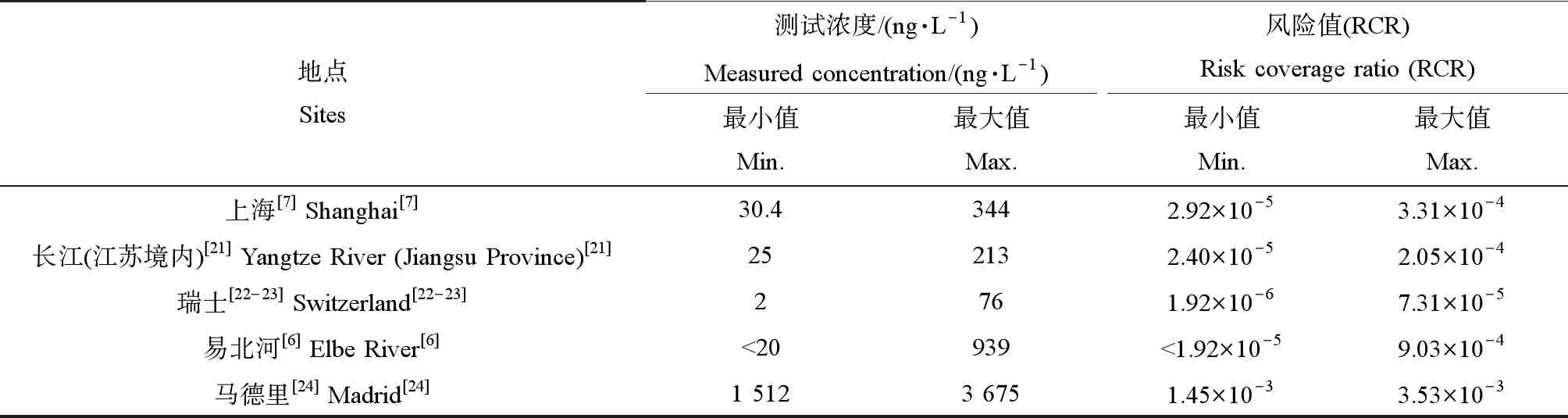
表4 地表水中4-AAA的风险评估Table 4 Risk assessment of 4-AAA in surface water

