恩诺沙星在鲫鱼肝微粒体中的代谢及代谢关键酶
刘婉玉,Tadiyose Girma Bekele,赵洪霞
大连理工大学环境学院,工业生态和环境工程教育部重点实验室,大连 116024
恩诺沙星(enrofloxacin, ENR)是第三代人工合成的氟喹诺酮类广谱抗菌药物,具有抗菌谱广、杀菌性强的特点而被大量应用于人类和兽类疾病的预防与治疗[1]。在实际生产中,不遵守休药期的药物滥用情况十分严重[2-3]。这不仅会给动物机体造成伤害,更会随着食物链的传递危害人类健康。恩诺沙星进入生物体内后,会在生物体药物代谢酶的作用下发生代谢转化,可能会产生毒性更强的代谢产物,从而影响其生态毒性。细胞色素P450酶(CYP450)又被称为多功能氧化酶,是一类广泛分布于生物体内的药物代谢酶,能够参与外源性物质如抗生素、农药和麻醉剂等的生物转化,在污染物的生物转化过程中起着十分关键的作用[4]。目前,关于恩诺沙星的生物代谢研究大多是关于其在生物体内的消除规律及其在不同组织中的代谢产物识别[5-8],对于其在水生生物体CYP450作用下的代谢转化机制尚不清楚,恩诺沙星代谢的关键酶还未确定,因此,有必要对其在水生生物体CYP450酶作用下的代谢转化进行深入研究。本研究采用鲫鱼肝微粒体体外孵育法,探究恩诺沙星在CYP450酶的作用下的代谢转化过程及参与其代谢的关键酶,以期为评价其生态和健康风险提供基础数据。
1 材料与方法(Materials and methods)
1.1 实验动物
实验动物为鲫鱼,购于大连市中山公园花鸟鱼虫市场,个体质量为240~300 g。实验前将其暂养10 d,养殖水为自来水,使用前连续曝气24 h,水温为(28 ± 1) ℃。
1.2 主要试剂
恩诺沙星及环丙沙星标准品(大连美仑生物技术有限公司);乙腈、甲醇、二氯甲烷、酮康唑、双硫仑和二甲基亚砜(色谱纯,美国Sigma公司);还原型辅酶Ⅱ(NADPH)、三羟甲基氨基甲烷和甘氨酸(分析纯,北京索莱宝科技有限公司);磷酸氢二钠、磷酸二氢钠、氯化钾和氯化钙(分析纯,天津市大茂化学试剂厂);乙二胺四乙酸二钠(分析纯,天津市科密欧化学试剂有限公司)。
1.3 主要仪器设备
高效液相色谱仪(美国Agilent公司,Agilent 1100);高效液相色谱串联三重四级杆质谱仪(美国Waters公司,Xevo TQ-S);荧光分光光度计(日本Hitachi公司,F4500);冷冻离心机(湖南湘仪实验室仪器开发有限公司,H1750R);紫外分光光度计(上海美谱达仪器有限公司,UV 6100);手持式匀浆机(上海净信实业发展有限公司,F6/10);全温振荡培养箱(天津莱玻特瑞仪器设备有限公司,ZQPW-70)。
1.4 缓冲溶液配制
0.1 mol·L-1磷酸缓冲液(PBS):称取11.18 g KCl、80 g NaCl、32.3 g Na2HPO4·12H2O、4.5 g NaH2PO4·2H2O和0.029 g 乙二胺四乙酸二钠(EDTA),用超纯水溶解,浓HCl调节pH至7.4,定容至1 L。
匀浆缓冲液为含10%(V∶V)甘油的0.1 mol·L-1PBS缓冲溶液。保存缓冲液为含20%(V∶V)甘油的0.1 mol·L-1PBS缓冲溶液。0.1 mol·L-1的Tris-HCl缓冲溶液:称取12.11 g三羟甲基氨基甲烷(Tris),用超纯水溶解,浓盐酸调节pH至7.4,定容至1 L。
1.5 肝微粒体制备
鲫鱼肝微粒体制备参照沈梦楠[9]的方法。取健康的鲫鱼,置于冰上解剖得到鲫鱼的肝脏组织,用5 mL预冷的缓冲溶液反复冲洗3次,洗去血红蛋白,用滤纸擦去多余的液体,称重。组织剪碎后按1∶4 (m∶V)加入预冷的匀浆缓冲液,用内切式组织匀浆机于冰浴中制成匀浆。将匀浆液转入预冷离心管中,4 ℃、10 000 g离心30 min,小心取出全部上清液,按10∶1(V∶V)加入88 mmol·L-1的CaCl2溶液,混匀后,于4 ℃、15 000 g离心60 min。弃上清,沉淀即为微粒体组分。将微粒体沉淀取出后加入少许保存缓冲液,保持冰浴环境涡旋振荡1 min,进行2次,充分混匀,分装于冻存管中,置-80 ℃保存,以备检测用。
1.6 体外孵育实验
恩诺沙星暴露浓度、微粒体蛋白含量和反应温度的设置参照文献[10]。样品组设置3个浓度组,恩诺沙星终浓度分别为1、5和10 mg·L-1。样品体系主要包含0.1 mol·L-1的Tris-HCl缓冲溶液(pH=7.4),1 mmol·L-1NADPH、10 mg微粒体蛋白和恩诺沙星(1、5或10 mg·L-1),反应体系总体积为1 mL。除样品组外还设置空白对照组,即不含目标化合物组,在体外孵育体系中加入100 μL超纯水代替恩诺沙星。反应体系于28 ℃预孵5 min后,加入NADPH以启动反应,反应温度为28 ℃,分别孵育0、5、15、45和90 min,加入2 mL预冷的二氯甲烷终止反应。所有样品均设置3组平行。
1.7 代谢抑制实验
代谢抑制实验中,选择双硫仑和酮康唑作为抑制剂。样品组抑制剂设置2个浓度组,分别为5 μmol·L-1和50 μmol·L-1。样品体系主要包含0.1 mol·L-1的Tris-HCl缓冲溶液(pH 7.4)、1 mmol·L-1NADPH、10 mg微粒体蛋白、恩诺沙星(1、5或10 mg·L-1)和抑制剂(5 μmol·L-1或50 μmol·L-1),反应体系总体积为1 mL。对照组不含抑制剂,在体外孵育体系中加入25 μL 二甲基亚砜(DMSO)代替抑制剂。代谢抑制实验中,首先在反应体系中加入25 μL抑制剂和NADPH,28 ℃预孵5 min后加入恩诺沙星,反应体系28 ℃孵育90 min后,加入2 mL预冷的二氯甲烷终止反应。所有样品均设置3组平行。
1.8 样品前处理
将终止反应的体外孵育样品置于涡旋混合器振荡混合1 min,于4 ℃、8 000 r·min-1离心5 min,取二氯甲烷有机相,移入氮吹管中,剩余残渣加入1 mL的二氯甲烷,再次涡旋混合后离心。重复2次后,合并有机相,在40 ℃氮气流下吹干,以1 mL超纯水定容,过0. 22 μm滤膜后,检测分析。
1.9 酶活性测定方法
1.9.1 苯胺4-羟化酶(AH)活性测定
AH活性测定参照Burkina等[11]的方法。4-氨基酚标准曲线制备:分别取10 μmol·L-14-氨基酚0、0. 2、0. 4、0. 6、0. 8和1. 0 mL,用质量分数为6%的三氯醋酸(TCA)补足至1.0 mL,加入体积分数为1%的苯酚1 mL,混匀后再加入1 mol·L-1的Na2CO3溶液1 mL,充分混匀后,放置30 min,空白调零,于630 nm处测定各管的吸光度值,绘制4-氨基酚标准曲线。AH活性测定:取10 mmol·L-1NADPH溶液0.1 mL和10 mmol·L-1盐酸苯胺溶液0.5 mL,置于试管中,混匀,对照管加0.5 mL超纯水代替苯胺,28 ℃孵育2 min。各管均加0.5 mL微粒体悬液,28 ℃再孵育30 min,加1 mL冰冷的质量分数为20%的TCA终止反应。冰浴5 min,11 000 r·min-1离心,取上清液1 mL于另一试管中,加体积分数为1%的苯酚1 mL,混匀,再加入1 mol·L-1的Na2CO31.0 mL,充分混匀后,放置30 min,空白调零,于630 nm处测定各管的吸光度值,根据标准曲线计算4-氨基酚浓度,以nmol(4-氨基酚)·min-1·mg-1表示其酶活性。
1.9.2 7-乙氧基香豆素-O-脱乙基酶(ECOD)活性测定
ECOD活性测定参照李阳等[12]的方法。7-羟基香豆素标准曲线制备:分别取1.62 mg·L-1的7-羟基香豆素溶液0、0.25、0.5、1、1.5和2.0 mL,用Tris-HCl溶液补足到5.0 mL,混匀后于390 nm激发波长和440 nm发射波长下测定上述各浓度7-羟基香豆素对应的荧光强度,绘制7-羟基香豆素标准曲线。ECOD活性测定:取0.5 mL微粒体蛋白悬液,加入20 μL的底物7-乙氧基香豆素(终浓度为1.0 mmol·L-1),混匀后以0.1 mol·L-1、pH 7.4的Tris-HCl缓冲液补充到1 mL,28 ℃孵育2 min后,测定管加入10 mmol·L-1NADPH 0.1 mL,空白管加入超纯水0.1 mL。28 ℃孵育20 min后迅速取出并置于冰上,加入1 mL质量分数为20%的TCA终止反应。反应完毕后,将反应混合液于4 ℃、10 000 r·min-1下离心5 min,取上清,加入2 mL 甘氨酸-氢氧化钠(Gly-NaOH)溶液(0.6 mol·L-1,pH 10.5),震荡混匀后,在激发波长为335 nm、发射波长为455 nm下测定产物的荧光值,根据标准曲线计算7-羟基香豆素浓度,以nmol(7-羟基香豆素) ·min-1·mg-1表示其酶活性。
1.10 检测条件
1.10.1 HPLC检测条件
色谱柱为Agilent Eclipse XDB-C18 (4.6 mm×150 mm,3.5 μm),流动相为体积分数为0.1%的甲酸水溶液和乙腈(V∶V=7∶3),流速为0.4 mL·min-1,进样量为20 μL,柱温为30 ℃,检测波长为283 nm。
1.10.2 高效液相色谱串联质谱(HPLC-MS/MS)检测条件
色谱柱为Waters Symmetry C8 (50 mm×2.l mm,5 μm),柱温为25 ℃,流速为0.3 mL·min-1,进样量为10 μL,流动相A为0.005 mol·L-1醋酸铵溶液(用甲酸调节pH至2.5),B为乙腈,梯度洗脱条件:0~5 min,3%~25% B;5~6 min,25%~35% B;6~7 min,35%~55% B;7~8 min,55% B;8~9.5 min,55%~3% B;9.5~12.5 min,3% B。
质谱条件:电离模式为ESI+,离子源温度为150 ℃,多溶剂气温度为350 ℃,锥孔电压为25 V,碰撞能为15 eV,扫描模式为SIR和子离子扫描。
2 结果与讨论(Results and discussion)
2.1 恩诺沙星体外代谢
2.1.1 恩诺沙星体外代谢动力学
恩诺沙星暴露浓度参照文献中的浓度设置[10],当恩诺沙星体外暴露浓度为1、5和10 mg·L-1时,恩诺沙星体外代谢过程符合一级动力学方程lnCt/C0=-kt,动力学拟合曲线图1所示。拟合得到恩诺沙星在鲫鱼肝微粒中的代谢动力学参数,包括消除速率常数(k)、半衰期(t1/2),如表1所示。当恩诺沙星体外暴露浓度为1、5和10 mg·L-1时,恩诺沙星在鲫鱼肝微粒体中的k分别是0.00303、0.00204和0.00266 min-1,半衰期t1/2分别是228.8、339.8和260.6 min,其中当恩诺沙星暴露浓度为1 mg·L-1时,其在肝微粒体中的k最大,为0.00303 min-1,t1/2最短,为228.8 min。本研究中恩诺沙星在1、5和10 mg·L-13个暴露浓度条件下的t1/2均比Shan等[13]的研究中恩诺沙星在鲫鱼体内t1/2(64.66 h)的值低,这可能是体外代谢实验中的恩诺沙星能够与代谢酶直接接触,避免了体内复杂生理因素的干扰,使其代谢转化速率变高,半衰期缩短。

图1 恩诺沙星代谢动力学拟合曲线Fig. 1 Fitting curve of enrofloxacin metabolic kinetics
2.1.2 恩诺沙星体外代谢产物
恩诺沙星暴露浓度为10 mg·L-1,孵育90 min,采用HPLC-MS/MS技术,对恩诺沙星及其在鲫鱼肝微粒体中的代谢产物进行识别。首先,通过对比空白组与实验组的色谱图,共筛选出2种可能存在的代谢产物(M1和M2),其保留时间等信息如表2所示。然后,根据其二级质谱图(图2)的碎片信息,结合母体化合物的结构,初步推测出产物的分子结构。

图2 恩诺沙星代谢产物二级质谱图Fig. 2 MS2 spectra of enrofloxacin metabolite
通过与恩诺沙星标准品的保留时间及碎片离子的比对,可以确定M0为母体化合物恩诺沙星,其保留时间是3.26 min,分子式是[C19H23N3O3F]+,主要碎片离子是342 [MH-F]+、316 [MH-CO2]+和245 [MH-CO2-C2H4NC2H5]+。环丙沙星是恩诺沙星常见的代谢产物,根据与环丙沙星标准品的保留时间及碎片离子的比对,可以确定M1为环丙沙星,保留时间2.97 min,分子式[C17H19FN3O3]+,主要碎片离子是245 [MH-CO2-C2H4NH]+和231 [MH-CO2-C2H5N2]+。M2的保留时间是3.12 min,准分子离子是372 [C20H26N3O4]+,主要碎片离子是297 [MH-CO2-O-CH3]+、257 [MH-CO2-O-CH3-C3H4]+和241 [MH-CO2-O-C2H5N-C2H4]+,其分子量比母体化合物增加了12 Da,推测是恩诺沙星脱氟后羟基化,再进一步发生甲基化得到的产物。

表1 恩诺沙星在鲫鱼肝微粒体中的代谢动力学参数Table 1 Metabolic kinetic parameters of enrofloxacin in liver microsomes of crucian carp (Carassius auratus)

表2 恩诺沙星及其在鲫鱼肝微粒体中代谢产物的保留时间、分子量和分子式Table 2 Retention time, molecular weight and molecular formula of enrofloxacin and its metabolites in liver microsomes of crucian carp (Carassius auratus)
恩诺沙星在鲫鱼肝微粒体中的代谢是在CYP450酶的作用下发生的。细胞色素P450酶有很多亚型。其中,在CYP3A4亚型作用下,外源污染物能够发生脱甲基、脱乙基反应[14],在CYP2E1亚型作用下外源污染物发生羟基化反应[15]。因此,推测M1是在CYP3A4作用下的产物,M2是CYP2E1作用下的产物,CYP3A4和CYP2E1是主要参与恩诺沙星体外代谢的P450亚型酶。
2.2 恩诺沙星体外代谢关键酶的确定
为了确定参与恩诺沙星代谢关键酶,首先分析了在体外孵育条件下,恩诺沙星对CYP3A4和CYP2E1亚型酶活性的影响。7-乙氧基香豆素是一种CYP3A4亚型的特异性底物,通过ECOD反映CYP3A4总酶活性,苯胺是CYP2E1亚型的特异性底物,以AH反映CYP2E1总酶活性[16-17]。在不同浓度恩诺沙星体外暴露的条件下,AH和ECOD酶活性随时间变化趋势如图3所示。

图3 苯胺4-羟化酶和7-乙氧基香豆素-O-脱乙基酶活性随时间的变化Fig. 3 The change of aniline 4-hydroxylase (AH) and 7-ethoxycoumarin-O-deethylase (ECOD) activities with time
恩诺沙星对AH和ECOD的活性均有一定的抑制作用。AH活性随时间呈线性下降趋势。当恩诺沙星浓度增加时,对AH活性抑制作用增强;ECOD活性在0~5 min时,下降趋势明显,在5 min后ECOD活性下降趋势逐渐变缓。为了进一步考察恩诺沙星浓度对AH和ECOD活性的影响,利用SPSS对恩诺沙星浓度和酶活性作相关性分析。结果表明,ECOD活性与恩诺沙星浓度显著性负相关,皮尔逊相关系数为-0.617;AH活性与恩诺沙星浓度无显著性相关关系(α=0.05)。恩诺沙星对ECOD和AH酶活性有抑制作用。这说明,恩诺沙星具有与CYP3A4和CYP2E1酶结合的能力,CYP3A4和CYP2E1参与了恩诺沙星的代谢。
代谢抑制实验中,加入特异性抑制剂与恩诺沙星共同孵育,根据实验结果可初步判断参与恩诺沙星代谢的CYP450酶亚型。选择酮康唑(KTZ)和双硫仑(DIS)分别作为CYP3A4和CYP2E1的抑制剂,抑制剂浓度为5 μmol·L-1和50 μmol·L-1,这2个浓度的选择参考了文献[18-19],这是能够有效抑制相应CYP450亚型活性的浓度。加入不同浓度的KTZ和DIS后,恩诺沙星在鲫鱼肝微粒体中的代谢转化率有不同程度的降低,其抑制情况如图4所示。
如图4所示,当恩诺沙星暴露浓度为1、5和10 mg·L-1时,5 μmol·L-1的KTZ和DIS对恩诺沙星代谢均有较弱的抑制作用。KTZ和DIS的浓度增加至50 μmol·L-1时,KTZ对恩诺沙星代谢的抑制率明显增加,抑制率最高可达80%,而DIS的浓度改变对恩诺沙星代谢抑制率影响较小。因此,与CYP2E1亚型相比,CYP3A4在恩诺沙星代谢过程中作用更大,CYP3A4亚型是恩诺沙星在鲫鱼肝微粒体中代谢的关键亚型酶。
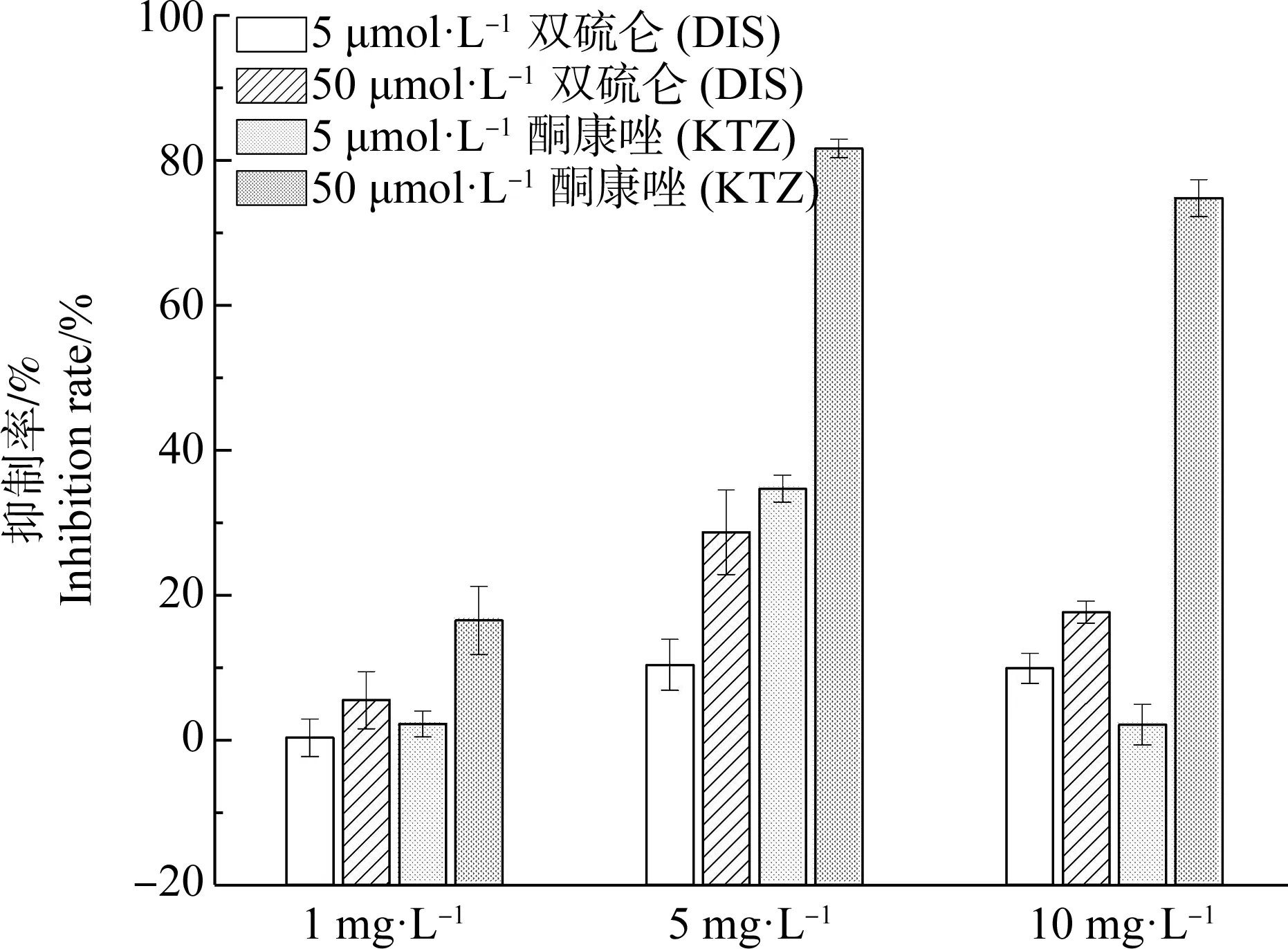
图4 双硫仑(DIS)和酮康唑(KTZ)对恩诺沙星体外代谢的影响Fig. 4 Effects of disulfiram (DIS) and ketoconazole (KTZ) on the in vitro metabolism of enrofloxacin
综上所述,恩诺沙星在鲫鱼肝微粒体中的代谢符合一级动力学方程,体外代谢过程中恩诺沙星对CYP3A4和CYP2E1亚型酶活性有一定的抑制作用,CYP3A4亚型酶活性与恩诺沙星呈显著性负相关关系,CYP3A4是参与恩诺沙星代谢的关键亚型酶。本研究结果为探究恩诺沙星在水生生物体内代谢转化路径及其生态风险提供基础数据。

