真菌感染致移植肾动脉破裂一例并文献复习
徐鸿,赵法亮,梁天才,李浩,杜江,谭州科,胡婷婷,赵静,李玉,杜洋,付梓峰,陈安健,颜晓勇,梁国标
遵义医科大学附属医院泌尿外科1、肾内科2,贵州 遵义 563000
肾移植术后移植肾动脉破裂,临床上较少见,是肾移植术后相关并发症中较为严重的一种,多发生于肾移植术后1~3周内[1-2]。肾移植后血管并发症占所有并发症的5%~10%,而移植肾动脉破裂约占2.1%[3]。肾移植术后导致移植肾动脉破裂的原因很多,感染是其主要原因,包括细菌、真菌及其他致病微生物的感染,由侵袭性真菌感染导致的术后移植肾动脉破裂约占1.4%[3-5]。侵袭性真菌感染早期诊断较为困难,容易延误诊治,且该病危害较大,故提高临床医师对该并发症的认识,对防止移植肾的丢失及挽救患者生命具有重要意义。我院2018年6月收治1例肾移植术后24 d因近平滑假丝酵母菌感染致移植肾动脉破裂患者,现报道如下:
1 临床资料
1.1 供者资料 男性,41岁,因“头疼、意识障碍”入院。入院前无外伤史,为自发性脑出血,诊断为“急性小脑幕切迹疝(晚期)”。根据“脑死亡判定标准(成人)”和“脑死亡判定技术规范”确诊为脑死亡,在完成国际标准无偿器官捐献知情同意程序后施行供肾获取。术前查血清肌酐82 μmol/L,血/尿培养及真菌D-聚糖检查阴性,相关传染性疾病检查阴性。
1.2 受者资料 男性,38岁,因“慢性肾功能衰竭(尿毒症期)”入院。患者为首次肾移植,供受者血型相同,术前配型示群体反应性抗体(PRA)阴性,淋巴细胞毒试验(CDC)<10%。术前肌酐:1 494 μmol/L,胸部CT 和心电图未见明显异常。术前抗人类胸腺球蛋白(ATG)50 mg诱导治疗,入院后第2天于我院顺利行同种异体肾移植术。围手术期常规免疫抑制方案为:术中和术后3 d 甲泼尼龙500 mg 冲击治疗,之后改为泼尼松片50 mg 口服(每日递减5 mg,至10 mg/d 维持)。术后3 d 开始口服他克莫司+吗替麦考分酯分散片+泼尼松三联抗排斥治疗,根据药物浓度调整他克莫司剂量。术后除常规抗感染治疗外,另予米卡芬净钠50 mg 持续使用12 d 预防真菌感染。术后第12 天查肌酐176 μmol/L,术区引流液一般细菌培养提示少量丝状真菌生长,调整米卡芬净钠为100 mg 持续2周。术后第17 天,血真菌(1-3)B-D-葡聚糖检测示可疑阳性,术区引流液菌培养+药敏提示:屎肠球菌,根据药敏结果调整抗生素为美罗培南,同时加用替加环素抗感染治疗,并继续予米卡芬净钠抗真菌治疗。此时患者肌酐升高为350 μmol/L,尿量2 150 mL,移植肾彩色多普勒超声检查示:包膜下未见积液,移植肾动脉吻合口通畅,肾主动脉阻力指数(RI)0.72。考虑为术后急性排斥反应引起,予甲强龙500 mg冲击抗排斥治疗持续3天后肌酐降至235 μmol/L。
术后第24 天,患者突发术区胀痛、压痛明显,伴气促、心悸,面色苍白、神志尚清楚、血压下降,四肢末梢冰冷,切口处见大量渗血,血肌酐急剧升高达604 μmol/L,术区引流液菌培养结果示丝状真菌生长。在输血抗休克的同时紧急行移植肾彩色多普勒超声检查提示:移植肾边界欠清,形态欠佳,肾上极下方见范围约49 mm×39 mm低回声区,内未见明显血流信号,考虑移植肾破裂可能。遂急诊行移植肾探查术。术中见:切口见大量血液溢出,迅速游离移植肾,发现移植肾呈褐色肿大明显,多处肾实质破溃感染但无出血,髂内动脉与肾动脉吻合口处破裂出血,即刻钳夹吻合口近端髂内动脉切除移植肾。术毕,将移植肾送病理检查。术后予美罗培南+万古霉素二联抗感染、米卡芬净钠100 mg 抗真菌治疗。行血细菌培养+药敏提示为近平滑假丝酵母菌,痰液真菌涂片检测为大量真菌孢子,治疗上抗生素及抗真菌药物已覆盖。但在术后第4 天,术区引流管短时间内引流出血性液体1 500 mL,再次手术探查术区未见明显出血点,考虑为陈旧性出血引起。因患者病情危重转入ICU 进一步治疗,患者于ICU 治疗期间出现真菌性败血症,因经济原因放弃治疗并出院。
1.3 术后病理 移植肾脏130 mm×80 mm×60 mm,表面包膜欠完整,肌壁见脓性物附着,切面灰白灰红,局部见坏死,皮髓质欠清,送检(移植)肾及输尿管真菌感染伴急性化脓性炎。HE染色见图1,特殊染色示:PAS(+)(图2);六胺银(+)(图3)。

图1 肾组织HE染色(×400),可见空泡状的孢子和丝状的菌丝
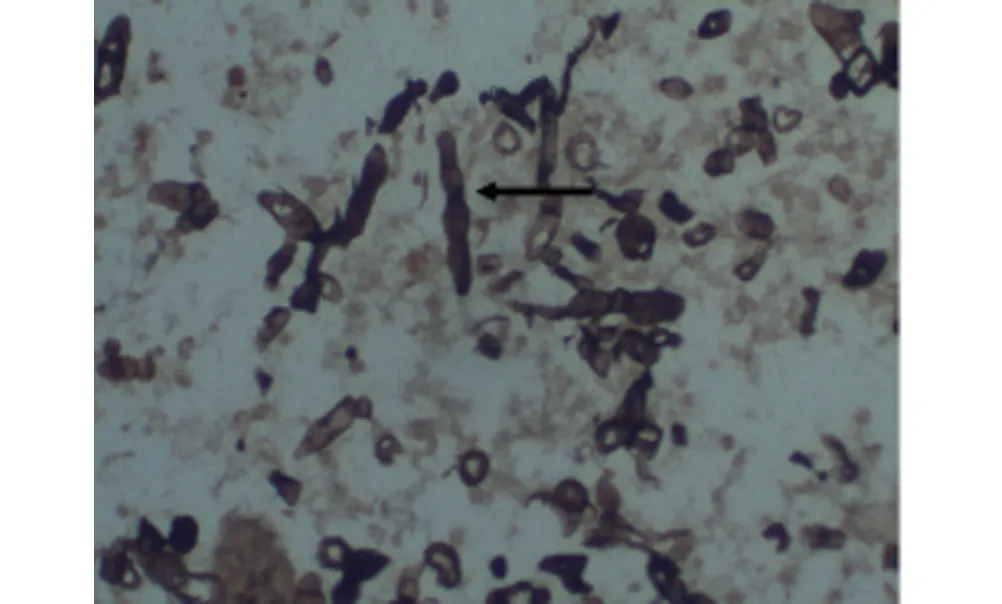
图2 肾组织六胺银染色(×400),可见孢子被染成黑色

图3 肾组织PAS染色(×400),可见空泡状的孢子和丝状菌丝
2 讨论
移植肾动脉破裂是肾移植术后严重的血管并发症,虽然在临床较少发生,但起病急、症状重且病情进展迅速,如果未能及时诊治,移植肾丢失率高,甚至危及患者生命[6-7]。
临床上导致移植肾血管破裂原因较多,其中较常见原因有:(1)由真菌或细菌感染侵袭移植肾动脉引起血管破裂出血,其感染源可能来源于供者本身及供肾的获取、保存、修肾和植入过程[8-9],也可能来源于受者;(2)外科操作因素,包括取肾、修肾及吻合过程中损伤血管内膜及吻合技术不过关等,除了导致吻合口动脉破裂外,还可以形成假性动脉瘤,进而导致肾动脉破裂[8];(3)肾移植术后急、慢性排斥反应的发生会增加真菌感染风险,进而导致移植肾动脉破裂出血[2];(4)移植肾动脉粥样硬化及高血压等因素。感染是引起肾移植后肾动脉破裂出血的主要原因,而较早报道的侵袭性真菌感染占45%,目前的报道其发病率已较前明显下降,最低为1.5%[10]。但其病死率较高,肾移植术后并发真菌感染的病死率可高达40%~100%[11]。近年来由于免疫抑制剂、广谱抗生素、细胞毒药物的广泛使用,器官移植术、导管技术、静脉高营养技术的开展,使深部真菌感染率呈上升趋势,真菌感染已经成为这类疾病患者致死的主要原因[12-13]。
真菌属于嗜血管性微生物,具有较强的嗜血管性,对血管损害极大。嗜血管性微生物感染导致肾移植术后移植肾动脉破裂在临床较为少见,国内外仅见个案报道,其中常见的致病微生物主要为毛霉菌、曲霉菌、白色念珠菌等真菌,其次为某些需氧的革兰氏阳性和阴性菌、厌氧菌等细菌[9,12,14-18]。假丝酵母菌又称念珠菌,属革兰染色阳性的真菌,目前已发现200多种分支,其中以白色念珠菌感染为主(又称白假丝酵母菌),近平滑假丝酵母菌属于致病性假丝酵母菌属的一个分支,在深部真菌感染中并不常见,其检出率约占3.8%[19]。国内目前尚无在真菌感染致移植肾动脉破裂的病例中培养出近平滑假丝酵母菌的报道,国外虽然有报道在真菌感染的移植肾中分离出近平滑假丝酵母菌[20-21],但尚无引起移植肾动脉破裂的报道。
结合本例患者,为了减少肾移植术后真菌感染,应做好以下几个方面:(1)做好供者来源性感染的评估,据相关统计,实体器官移植供者来源性感染约占0.2%~1.7%[22-23]。应增加对供体潜在感染的检测,包括普通细菌和真菌的检测,并对供肾灌注液进行相关培养,尽可能除外供体来源的感染因素。研究证实供者器官保存液的致病菌与受者手术区分离的致病菌有着接近的遗传关系,认为器官的真菌感染最可能发生在器官获取时,并推测大部分器官污染是供者腹腔感染的后果,随后再导致器官保存液的污染[24];(2)针对移植术后治疗,应早期使用抗真菌药物降低侵袭性真菌感染率,避免长时间使用广谱抗生素,造成体内菌群失调进而增加真菌感染风险[25-26];(3)严格进行相关无菌操作,避免外源性因素感染;(4)根据患者具体情况,酌情调整抗排斥药物剂量,避免过度免疫抑制进而增加真菌感染风险等。
移植肾动脉破裂属于急症,破裂前无特殊临床表现。移植肾动脉吻合口破裂常表现为突发的移植术区的胀痛、压痛明显,伴气促、心悸等,可根据失血量大小表现为神志模糊或神志尚清,或者血压进行性下降,四肢末梢冰冷,切口处见大量渗血等。患者查体一般可见面色苍白,精神差等。辅助检查时移植肾彩色多普勒超声(彩超)检查常提示移植肾周血肿。当临床上患者出现上述症状时,再结合相关辅助检查,首先应考虑为移植肾破裂或移植肾动脉破裂出血引起,应积极手术探查,及时挽救移植肾。若术中发现移植肾无功能及感染较重者,需将移植肾切除。
总之,肾移植术后移植肾动脉破裂出血的早期诊断及治疗极为关键,一经发现,应急诊手术探查,这对防止移植肾丢失及挽救患者生命至关重要。

