一例疑似重症新冠肺炎患者救治经验
徐 静 胡明冬 蒋云秋 张明周 郭宇航 李 琦 王关嵩
2019年12月突然爆发新型冠状病毒(SARS-CoV-2)肺炎[1-2]。SARS-CoV-2是一种高度传染性且可能致命的病毒,比流感更具传染性,更致命[3]。2020年2月11日WHO将新冠病毒引发的疾病正式命名为冠状病毒病(corona virus disease 2019, COVID-19)。我国已将该病纳入《中国人民共和国传染病法》规定的乙类传染病,采取甲类传染病预防控制措施[4-6]。疫情期间,若有不确切的流行病学史,每一个有呼吸道感染证据的危重病患者,均应该考虑存在COVID-19的可能性,需要在单人间隔离治疗,尽快釆集标本进行新型冠状病毒核酸检测,同时在确保转运安全前提下立即将疑似病例转运至定点医院。若因病情严重存在转运风险,则需要在单间病房暂时按照标准防护进行隔离与救治。2020年2月28我院呼吸与危重症医学中心收治1例疑似患者,救治成功,现报告如下。
病例资料
患者男性,43岁,因“发热、咳嗽10余天,呼吸困难4 d”于2020年2月28日由我院发热门诊转入我病区。患者入院前10余天因“血尿”在某医学院附属医院住院,期间不明原因出现畏寒、发热,体温最高达38.2 ℃,热型不规律,伴有咳嗽、咳少量白色粘痰,无其他特殊不适。先后2次行胸部CT提示双肺多发斑片状、网格状高密度影,见图1~2。当地医院考虑新冠肺炎疑似病例,于当地疾控中心(CDC)先后行3次咽拭子新冠病毒核酸检测均为阴性。巨细胞病毒DNA:阳性,5.36×103。遂在透析(隔日透析,每次透析滤液2 000~2 500 ml)治疗基础上,予以抗感染(更昔洛韦、莫西沙星、利奈唑胺、卡泊芬净、甲强龙40 mg)等综合治疗,仍有发热,体温在37.5~37.8 ℃波动。4 d前患者出现活动后呼吸困难,吸氧不能缓解症状,遂来我院救治,发热门诊检查:血常规 白细胞总数4.46×109/L,L 0.29,Hb 71 g/L,血小板92×109/L,降钙素原 0.57 ng/ml ;胸部CT提示:双肺胸膜下散在磨玻璃渗出影。门诊留观期间行2次鼻咽拭子新冠病毒核酸检测均为阴性。门诊予以无创呼吸机辅助通气、“莫西沙星、头孢哌酮-舒巴坦钠、磺胺”抗感染及透析等治疗,患者呼吸困难仍然持续加重,复查胸部CT(2020年2月27日)提示双下肺弥漫性渗出病变加重,见图3,遂转我科。
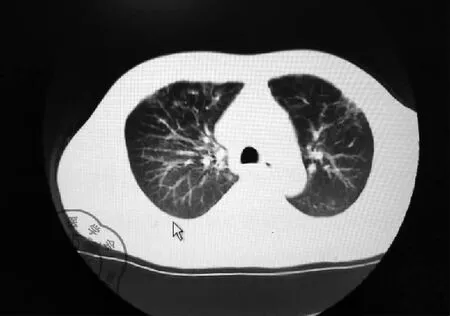
图1 2020-2-18
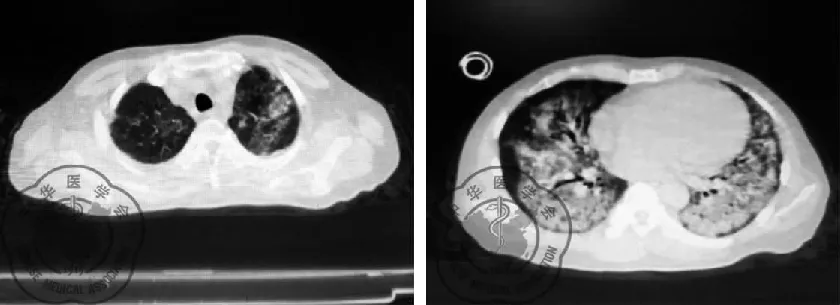
图3 2020-2-27
既往史及流行病学史:患者罹患慢性肾炎10余年,2019年8月在“xx大学附属医院”行“同种异体肾移植术”, 术后长期规律使用“他克莫司+泼尼松+麦考酚酯”治疗。2020年2月8日开始规律透析(隔日1次),入院前2 d停抗排异治疗。否认武汉、湖北旅游、居住史。在某医学院附属医院住院期间不能明确是否与医院新冠确诊患者有直接或间接接触史。所住小区无确诊及疑似病例,患者周围无聚集性发病。
入院查体:体温37.5 ℃,脉搏122次/min,呼吸35次/min,血压123/79 mmHg,经皮血氧饱和度70%(转运呼吸机,100%氧浓度)。急性面容,左前臂见一动静脉瘘,双上肢可见多处散在瘀斑。呼吸急促,口唇发绀。胸廓无畸形,呼吸音粗,双肺闻及湿啰音。心率齐,未闻及病理性杂音。腹软未见异常,双下肢轻度凹陷性水肿。神经系统未见异常。
理化检查:血生化:白蛋白:27.3 g/L;真菌G实验:275 pg/ml;痰培养未查见酵母样孢子及假菌丝;肺炎支原体IgM:阴性;血沉:116 mm/h;肝功能、凝血功能、糖化血红蛋白基本正常;脑钠钛前体:2 432 pg/ml;肌酐:1 135 μmol/L,乳酸:0.5 mmol/L;D-二聚体:0.54 mg/L;TORCH: 巨细胞病毒抗体:IgM阴性,IgG 阳性,单纯疱疹病毒抗体:IgM阴性、IgG 阳性。EB病毒核酸阴性;肺炎支原体IgM阴性;甲型、乙型流感病毒核酸阴性。
入院诊断:①重症肺炎 新冠肺炎疑似患者不除外; ②急性呼吸窘迫综合症;③呼吸性碱中毒;④慢性肾功能衰竭;⑤高钾血症; ⑥低蛋白血症; ⑦肾移植术后;⑧肾性高血压;⑨中度贫血 。
治疗经过:予以无创呼吸机辅助通气,“美罗培南、莫西沙星、膦甲酸钠、磺胺”抗感染治疗,甲泼尼龙80 mg抗炎、降压、纠正低蛋白血症、床旁持续血液透析、营养支持等综合治疗。于2月29日行痰、鼻咽、口咽拭子检查:阴性;血清抗体IgM:弱阳性;3月2日:气道分泌物二代基因测序(NGS):未查见新冠病毒。3月3日 再次行痰、鼻咽、口咽拭子检查:阴性;血抗体IgM:弱阳性;3月5日采用我院新试剂、同时标本送外院行新冠病毒血清抗体检测:IgM(阴性),IgG 阴性;肛拭子新冠病毒核酸阴性,于3月6日解除隔离。经积极综合治疗,病情逐渐好转,于3月21日转至普通病房。
讨 论
43岁男性患者,肾移植术后半年,平日抗排异治疗,因移植肾出现功能不全已行规律透析治疗。此次因“发热、咳嗽10余天,呼吸困难4 d”入院,经救治成功,我们想分享下在救治过程中的一些体会。
一、明确发热部位
对于肾移植术后患者,长期口服免疫抑制剂抗排异治疗,属于免疫功能受损人群,一旦出现发热,首先应考虑感染性因素所致。患者虽有尿血,但化验并没有泌尿系感染依据,根据常规生化检查可以排除其他系统感染。因患者伴有咳嗽、咳痰等呼吸道症状,呼吸频率快,大于30次/min,结合胸部CT变化、氧合指数小于250 mmHg,需要机械通气,故考虑感染定位在肺,临床诊断重症肺炎,符合内科学第8版诊断标准[7]。
二、分析可能存在的病原体
明确肺炎诊断及严重程度后,需进行病原学诊断。肾移植术后机体处于免疫抑制状态,很容易引起机会性感染,如细菌、真菌、病毒、叶氏肺孢子菌(PCP)感染等。从患者起病后血象不高,淋巴细胞下降,结合影像学特征,主要考虑病毒感染可能,巨细胞病毒、腺病毒可能性大,不排除流感病毒,从影像学上看PCP不太典型,但不能完全除外。围绕病毒检查先后发现巨细胞病毒DNA:阳性,5.36×103,巨细胞病毒抗体IgG 阳性、单纯疱疹病毒抗体IgG 阳性,未发现甲流、乙流病毒感染依据,因条件限制腺病毒无法检测。此次患者入院期间正值新冠疫情在国内爆发流行阶段,因血尿起病后住院,不明原因出现发热,所在医院有确诊新冠病毒肺炎患者,外院虽予抗病毒、抗细菌、激素抗炎、透析等综合治疗,病情仍在持续加重,不排除该患者为新冠疑似病例。按照《新型冠状病毒肺炎诊疗方案(试行第八版)》[8]内容,新冠疑似病例需结合流行病学史和临床表现综合分析,有流行病学史中的任何一条,同时必须符合临床表现中任意2条。若无明确流行病学史的,则必须符合临床表现中的3条。该患者14 d内在当地住院期间不排除与该院新冠确诊患者有接触史,故流行病学史不明确,临床症状主要为发热伴有咳嗽、进行性加重的呼吸困难,实验室检查提示早期白细胞总数正常,淋巴细胞计数下降至0.29,胸部CT提示:双肺多发斑片状、网格状高密度影,少量条索状高密度影,部分病灶在胸膜下。从临床表现来看,符合第七版诊疗方案第1条、第3条临床表现,影像学并非典型特征,但考虑到该患者长期口服免疫抑制剂,应考虑混合感染可能,故考虑该患者为疑似病例,从临床分型来看,该患者此次急性起病,迅速发生呼吸衰竭,需要无创呼吸机辅助通气,符合危重型的诊断标准。后期降钙素原(PCT)、C反应蛋白(CRP)和血沉升高,反映机体存在混合感染可能,考虑到患者肺部病灶进展迅速,呼吸衰竭加重,病原微生物尚不能完全明确,故在不断查找病原学依据上暂时予以广覆盖治疗。
三、进一步明确或排除新冠肺炎
按照第七版诊疗方案内容,一旦发现符合病例定义的疑似病例后,应当立即进行单间隔离治疗,并釆集标本进行新型冠状病毒核酸检测。若疑似病例连续两次新型冠状病毒核酸检测阴性(釆样时间至少间隔24 h)且发病7 d后新型冠状病毒特异性抗体IgM 和IgG仍为阴性可排除疑似病例诊断,但因该患者2次血清抗体IgM均为弱阳性,故排除过程变得比较困难。由于患者入科后肾功能衰竭,尿少、代酸严重,氧合较差,通过持续透析可以改善氧合,故暂未中途转院治疗,遂将其置于隔离区的单间,医护标准防护。同时再次完善多部位复检,如鼻咽拭子、肛拭子、痰NGS、血清新冠病毒抗体。经过2次气道分泌物、鼻咽拭子、口咽拭子新冠病毒核酸检测、气道分泌物NGS、3次新冠血清学抗体及1次肛拭子检测,第6天排除疑似,解除隔离。那么在临床中我们如何看待核酸假阴性和血清抗体假阳性呢?在2月9日针对新冠肺炎患者核酸检测出现“假阴性”的情况,北京大学人民医院呼吸与危重症医学科主任高占成在国务院联防联控机制举行新闻发布会上指出,任何病毒核酸检测的检出率都不可能是100%,对新型冠状病毒的核酸检测也不例外,出现“假阴性”在所难免。检出率还可能与患者病情轻重程度、病程发展阶段、样本取材和实验室检测条件等多种因素有关。国家卫健委发布《新冠肺炎实验室检测技术指南》[9]特别指出,阴性结果也不能排除新型冠状病毒感染,需要排除可能产生假阴性的因素,包括:样本质量差,比如口咽等部位的呼吸道样本;样本收集的过早或过晚;没有正确的保存、运输和处理样本;技术本身存在的原因,如病毒变异、PCR抑制等。对于还没确诊的患者,会被列为疑似患者,在后续诊治过程中,需要多次进行核酸检测和鉴别诊断,最终得到明确结果。因此在这例患者院外核酸阴性,但仍不能完全排除新冠肺炎情况下,我们复查新冠病毒核酸,并持续跟进了血清抗体。入科后新冠病毒血清抗体IgM检测结果为弱阳性,这样的结果困扰了我们的临床决策。在2020年3月3日国家卫健委发布的“新型冠状病毒肺炎诊疗方案(试行第七版)“中,新型冠状病毒特异IgM和IgG抗体检测被作为临床确诊标准。但在临床实践中发现存在较多的假阳性。从机体对病原体的体液免疫应答来看,最早出现的抗体是IgM,然后是IgG抗体,当IgG抗体出现后,浓度会持续增高,IgM则持续降低,直至消失,IgG抗体会较长时间存在。因此,特异IgM和IgG抗体是一对出现有序,此消彼长的一个关系。因此正确地利用及观察IgM/IgG的动态变化,有助于在病毒核酸检测这个临床诊断“金标准” 失效后(因病程、标本采集等所致的假阴性)的2019-nCoV感染的诊断[10]。新型冠状病毒特异性IgM抗体多在发病 3~5 d后开始出现阳性,IgG抗体滴度恢复期较急性期有4倍及以上增高,通过动态变化来判断IgM和IgG检测阳性的真假,从而避免假阳性结果对临床诊断的误导。
四、重视原发病的治疗
这是治疗所有疾病的关键,患者移植术后半年,此次因血尿就诊,分析病因应该考虑到移植肾排斥反应、移植肾肾病复发,泌尿系感染、结石、肿瘤,凝血功能障碍,自身免疫系统疾病等。该患者在当地医院和我院均围绕血尿进行了相关的病因排查,最后考虑主要系移植肾排斥反应所致,因考虑继发肺部感染较重,外院已停用抗排异药(他克莫司+泼尼松+麦考酚酯)。若持续血尿,贫血难以纠正,则需要外科干预,对移植肾动脉进行栓塞治疗。近年来,关于激素治疗病毒性肺炎的报道多是针对流感病毒的,尤其是几次流行性流感大爆发,除 SARS 及流感等爆发性流行性病毒性肺炎外,激素治疗其他病毒性肺炎的报道较少[11]。糖皮质激素在COVID-19中的应用由于没有RCT研究证据,具有争议。研究结果显示,中低剂量的糖皮质激素可降低重症病毒性肺炎患者的病死率和缩短住院时间,而不会导致继发感染或其他并发症[12]。国内回顾性研究结果显示,中低剂量糖皮质激素对病毒清除时间未见明显影响,重症型患者可能有潜在受益[13]。由于初期我们未能完全排除新冠病毒感染,故我们给予患者甲泼尼龙针剂5 d 80 mg,尔后为改善肾移植术后排斥反应,甲泼尼龙片16 mg/日维持,为后续移植肾动脉进行栓塞治疗提供可能。
五、加强ARDS治疗
ARDS是指在多种原发疾病的发展过程中继发的,以呼吸窘迫、顽固性低氧血症和非心源性肺水肿为特征的一种急性进行性呼吸困难。肺部感染除创伤、休克外居于三大诱因之首。该患者氧合指数≤200 mmHg,with PEEP≥5 cmH2O,按照2012柏林定义[14],该患者病情分级为中度ARDS,需警惕发展至重度ARDS。在治疗过程中,肺保护性通气策略贯穿ARDS机械通气治疗始终[15],其目的是让呼吸肌休息并且保持充足的气体交换,同时减轻呼吸机相关性肺损伤(VILI)的不利影响。该患者入科后使用无创呼吸机辅助通气,3月2日床旁胸片。发现纵膈、右侧颈部皮出现少量积气,原设置 6 ml/kg小潮气量,平台压在30 cmH2O左右,仍发生了呼吸机相关肺损伤。曾有Terragni研究表明,将部分ARDS患者的潮气量进一步降低至4 ml/kg左右、平台压控制在25~30 cmH2O时,肺损伤会明显减轻。于是我们在pH、二氧化碳水平可控情况下调节呼吸机支持参数,进行更小潮气量通气策略,提高氧浓度,减少低氧对呼吸中枢的驱动,降低跨肺压,从而减轻气压伤,并密切关注皮下气肿消退情况,定时床旁胸片检查,床旁胸穿闭式引流包备用,同时辅以镇咳治疗,保持大便通畅,避免引起气胸加重的诱因。3月4日床旁胸片提示:左侧(少量)气胸。但接下来随着病情逐渐好转,患者呼吸频率逐渐下降趋于平稳,气胸逐步吸收,经过11 d的治疗,纵膈、皮下,胸膜下气体完全吸收。对该患者的恰当处理,避免发生严重气胸,进一步加重呼吸衰竭。
六、其他治疗
定期监测各脏器功能,维持内环境稳定,营养支持治疗,关注心理健康。该患者入科前已规律透析,对于此类肾功能衰竭患者应注意水电解质平衡。在营养支持治疗方面应考虑到氮平衡、热量和微量元素等补充。该患者入科后立即透析,解决了高钾血症、肺水肿、水负荷过重问题,对多器官功能不全时的液体管理发挥了重要作用。该患者早期住院期间,由于新冠疑似诊断待进一步明确,患者常存在焦虑、恐惧情绪[7],也会有悲观失落甚至自杀念头,在对这个患者救治过程中均发现有上述情绪的变化,及时与患者加强心理疏导,最终情绪逐渐稳定下来。
新冠疫情期间,我科收治的这例肾移植术后抗排异治疗患者,由于流行病学史不明确,有咳嗽伴发热、呼吸困难症状,肺部影像学不能完全排除新冠感染,临床诊断重症肺炎,新冠肺炎疑似不除外,在新冠病毒排查阶段我们将多次的新冠病毒核酸与血清抗体检测相结合,最大程度地避免了假阳性对临床的误导,提高了诊断准确率,同时在救治过程中始终坚持以患者为中心,不轻言放弃,尽最大努力救治,最终逆转病情,使患者转危为安。

