基于SAT技术分析浦江镇地区儿童肺炎支原体感染的流行病学特点
温超超 卢燕鸣
肺炎支原体(mycoplasmapneumonia, MP)是儿童社区获得性肺炎(community acquired pneumoniae, CAP)的重要病原体之一,主要通过呼吸道飞沫传播,其发病情况与性别、年龄、季节、地域有一定相关性[1]。近年来,MP在儿童呼吸道感染中有逐年上升趋势[2]。MP感染人体后症状不典型,部分患儿无明显临床症状,容易漏诊误诊而延误治疗。因此,了解本地区人群 MP 感染的流行病学特点对疾病的早期诊断、积极预防具有重要的意义。RNA 实时荧光恒温扩增技术(simultaneous amplification and testing, SAT)是新一代核酸检测技术,扩增效率高,反应时间短,属于活菌检测技术,直接以病原体特异性RNA为扩增靶标进行恒温扩增,敏感度及特异性高,且RNA仅在活菌中存在,因此该方法的阳性可提示MP的近期感染[3]。目前已成功应用于结核分枝杆菌、沙门菌属、肠道轮状病毒和泌尿生殖道沙眼衣原体等病原的检测,效果良好。近年来,SAT也开始应用于儿童肺炎支原体肺炎检测,并取得良好预期[4-5]。但相关报道主要集中于方法学研究,目前基于SAT技术的关于MP感染的流行病学研究甚少。为进一步了解上海浦江镇地区因CAP住院儿童MP感染的流行病学特点,提高本地区对此类疾病的综合预防和治疗,本研究选取2018年7月至2019年6月在上海交通大学医学院附属仁济医院南院(以下简称我院)诊断为CAP的住院患儿967例,对其MP-RNA检测结果及其他临床资料进行比较分析,现报道如下。
资料与方法
一、一般资料
收集2018年7月至2019年6月在我院住院治疗的CAP患儿967例,其中男性患儿533例,女性患儿434例,男女比例1.23︰1.00。年龄在4月~15岁之间,平均年龄(3.96±2.45)岁,其中年龄为0~3岁的婴幼儿429 例,>3~6岁的学龄前患儿381例,>6岁的学龄患儿157例。所有患儿均存在发热和/或咳嗽等临床症状,且胸部影像学提示有肺炎表现。全部病例标本均采用SAT技术进行MP-RNA检测,以检测结果阳性判为MP感染的依据。CAP诊断标准参照第8版《诸福棠实用儿科学》[6]。
二、研究方法
收集所有CAP患儿的临床资料,包括性别、年龄、发病季节以及MP-RNA检测结果,分析本地区住院儿童MP感染与季节的关系,比较不同性别、不同年龄组患儿MP感染分布情况。
MP-RNA的测定: 采用MP核酸检测试剂盒(上海仁度生物科技有限公司,批号:20081588)进行检测。患儿入院当天由经过培训的专业人员采集咽拭子,并将其融于9 g/L盐水后加入等量裂解液制成待测样本。样本加入内标后,采用磁珠法提取靶标RNA,配置扩增检测液转至实时荧光定量PCR仪进行扩增,42 ℃ 1 min为 1个循环,共40个循环,荧光通道为FAM(样本通道)和HEX(内标通道)。
结果判读:样本曲线与阈值曲线交叉点的横坐标读数(监测时间)为dt,dt≤35 min 为 阳性,dt>40 min为阴性;35
三、统计学方法
采用SPSS 22.0软件进行数据处理和统计分析,计数资料以例数和百分率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
结 果
一、不同性别组患儿MP感染阳性率比较
共检测临床诊断为CAP的住院患儿967例,其中MP-RNA检测结果阳性者252例,总阳性率为26.06%(252/967)。男性患儿MP感染阳性率为24.20% (129/533),女性患儿MP感染阳性率为28.34%(123/434)。 两者之间无统计学差异(χ2=2.126,P>0.05)。
二、不同年龄组患儿MP感染阳性率比较
婴幼儿组、学龄前期组和学龄期组患儿MP感染阳性率分别为9.56%(41/429)、28.61%(109/381)和 64.97%(102/157),不同年龄组MP感染阳性率比较差异有统计学意义(χ2=185.266,P<0.05),其中婴幼儿组最低,学龄期组最高,MP感染阳性率随着年龄的增大逐渐升高。
三、不同月份(季节)患儿MP感染阳性率比较
图1所示为2018年7月至2019年6月浦江镇地区因CAP住院的儿童各个月份MP感染阳性率分布,可见6月份阳性率最高,达46.43%,9月份阳性率最低,为14.63%。根据上海市气象特征划分四季,我们发现春(3~5月)、夏(6~8月)、秋(9~11月)、冬(12~2月)四季MP感染阳性率分别为31.82%(63/198)、31.96%(62/194)、22.94%(64/279)和21.28%(63/296),不同季节间MP感染阳性率差异有统计学意义(χ2=11.825,P<0.05)。其中春夏季MP感染总阳性率(31.89%,125/392)显著高于秋冬季(22.09%,127/575)(χ2=11.620,P<0.05)。
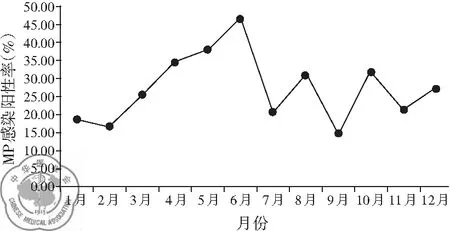
图1 浦江镇地区不同月份患儿MP感染阳性率
讨 论
MP是一种介于细菌与病毒之间的最小原核细胞型微生物,是引起儿童CAP的重要病原体之一[7]。MP主要经呼吸道飞沫传播,不仅可引起呼吸道感染,也可引起肺外其他器官病变[8]。MP感染人体后症状不典型,部分患儿无明显临床症状,早期影像学表现亦不具有特征性,因此,MP的诊断主要依赖实验室检测[9]。分离培养是诊断的金标准,但其检出率低、培养复杂而周期长,缺乏早期诊断价值,临床应用受限[10]。以往儿童MP感染流行病学分析多采用血清特异性抗体检测,但其受年龄、免疫功能的影响,难以鉴别急性感染及既往感染[11]。PCR检测敏感度及特异性高,但无法区分感染和携带,因为健康人群中MP携带率达0.1%~13.5%,并且MP感染后MP-DNA可在上呼吸道存在7周至7个月[12]。因此,该方法无法有效区分“活菌”和“死菌”, 可造成临床过度诊疗。本研究采用的SAT技术直接以病原体特异性RNA为扩增靶标进行恒温扩增,敏感度及特异性高,由于RNA只存在于增值存活的病原体内,MP死亡后RNA快速降解,在死亡的病原体中几乎检测不到RNA,因而能够即时反映病原体感染情况,有利于MP感染的早期诊断[13]。
有文献报道,MP全球感染率达9.6%~66.7%不等[14]。本文采用SAT法测得MP感染阳性率为26.06%,与梁伟等[15]报道2012年至2016年安徽地区儿童呼吸道MP感染的发病率28.02%接近,低于张新星等[16]报道的苏州地区儿童MP感染的发病率36.08%,高于石伟先等[17]报道的2011年至2015年北京地区MP感染的阳性率13.6%。这可能与MP检测方法不同,以及各地区气候条件、人群免疫力、呼吸道感染的病原体分布差异及年度流行趋势等不同有关。由此可见,各地区积极开展符合本地实际情况的儿童 MP感染流行病学分析,对临床制定针对性的预防和治疗方案具有重要价值和意义。此外本文结果还显示MP感染无显著的性别差异,这与殷勇[18]、陈萍[19]等学者报道相符,但有研究显示女性患儿MP感染阳性率高于男性[20-21],可能是女性对MP易感性较男性强,其具体机制有待于进一步研究。
MP感染可发生于各个年龄段的儿童, 以学龄前和学龄儿童多见[22-23]。本研究显示婴幼儿组、学龄前期组和学龄期组患儿MP感染阳性率分别为9.56%、28.61%和 64.97%,其中学龄期组阳性率最高,婴幼儿组最低,MP感染阳性率随着年龄的增大逐渐升高。这种年龄分布特点与陈正荣等[24]研究相符,可能与MP感染主要以气溶胶形式传播有关,学龄前及学龄儿童常在幼儿园及学校等人群密集的地方生活,并且活泼好动,与同学之间的接触机会较多,使交叉感染的机会增加。
MP感染全年可见,由于各地区气候、环境的不同,MP感染高发季节存在一定差异。温州、广州地区夏秋季高发[25-26]。苏州地区以春季及冬季为发病高峰[27]。北京、台湾地区则以秋冬季多发[28-29]。而我院资料显示MP感染阳性率夏季最高,冬季最低,与Xu等[30]报告的杭州市情况一致。一方面可能是由于上海市、杭州市夏季高温、湿润,适合MP的生存和传播,另一方面,儿童在夏季户外活动相对更多,交叉感染的机会相应增加。
综上所述,上海浦江镇地区因CAP住院儿童MP感染与患病年龄及发病季节有关,不同性别之间无显著差异。MP感染可发生于各个年龄段的儿童,以学龄前及学龄儿童多见,MP感染阳性率随着年龄的增大逐渐升高。MP感染全年散发,以春季、夏季为高发季节。

