高通量测序分析五倍子发酵用酒曲与酒糟微生物多样性
黎江华 刘超兰 冯 兴 杨晓雁 郭义东
(成都大学, 四川抗菌素工业研究所, 四川成都610052)
传统中药百药煎是由五倍子经发酵制备而成,其始载于《丹溪心法》,炮制方法则最早被记载于《本草蒙筌》,另在《医学入门》 《本草纲目》 等亦有记载。然历代文献记载的发酵制法中主要辅料为酒麯或酵糟或两者均未加入;另有桔梗、甘草,水红廖、乌梅煎,细茶,小廖汁、细茶及真茶汁加入之异[1]。进一步查阅历版《中国药典》、全国各地炮制规范,仅浙江、四川和江西中药炮制规范及北京中药材标准,京帮、武汉文帮记载了其炮制方法,同样存在辅料的不同记载,如北京用白酒曲,浙江和四川用酒糟,江西用米酒等[1⁃5],尚无规范化、标准化的百药煎的制备工艺。目前,已有文献对五倍子发酵过程中酒曲的筛选和发酵工艺优化进行了报道[6⁃7],探讨了绿茶及其不同加入方式对五倍子发酵的影响[8],而主要辅料酒曲与酒糟的差异性相关研究报道较少,且两者的微生物多样性差异分析尚无报道。
传统研究微生物方法多为分离培养法,分离得到的微生物在种类和数量上均有限;随着分子生物技术的发展成熟,尤其是高通量测序技术的研发与应用,已逐步成为微生物研究领域强有力的工具。该方法无需培养分离菌群,却能方便快捷、客观还原实验样品中微生物菌群结构,并已成熟应用到环境微生物[9]、茶叶发酵微生物[10]、食醋与酒等酿造微生物[11⁃12]的分析。因此,本实验以宜宾某酒厂生产白酒前后的酒曲与酒糟为研究对象,拟采用高通量测序技术对比分析两者的微生物多样性。以期通过微生物多样性的差异分析,探讨主要辅料不同而均能得到百药煎(五倍子发酵品) 的科学依据,以期为后续建立五倍子发酵百药煎的微生物体系指标(功能微生物群) 及进一步优化其制备工艺奠定基础。
1 材料
1.1 材料 酒曲与酒糟样品取自四川省宜宾市某浓香型白酒酒厂。Tris⁃酚购于美国Sigma 公司;RNA 酶、Ex Taq 酶购于日本TaKaRa Biotechnology公司。GeneJET 胶回收试剂盒购于美国Thermo Sci⁃entific 公司;Qubit2.0 DNA 检测试剂盒购于美国Life 公司。氯仿、异戊醇、无水乙醇等均为分析纯。
1.2 仪器 MastercyclerPCR 仪 (德国Eppendorf公司);PowerPac3000 电泳仪 (美国Bio⁃Rad 公司);Iontorrent 高通量测序平台、Pico⁃21 台式离心机(美国Thermo Fisher 公司);GL⁃88B 漩涡混合器(海门其林贝尔仪器制造有限公司)。
2 方法与结果
2.1 方法
2.1.1 样品准备 分别取酒厂的酒曲与酒糟各约10 g,迅速粉碎并密封于无菌袋中,-20 ℃保存备用。
2.1.2 样品基因组DNA 提取 采用CTAB 法分别提取酒曲与酒糟中微生物基因组DNA。具体步骤为样品预处理,CTAB 法提取缓冲液,采用Tris酚、氯仿、异戊醇抽提,异丙醇沉淀,70%乙醇洗涤,DNA 溶解及RNA 酶酶解等。再用1% 琼脂糖凝胶电泳检测DNA 纯度和浓度,-20 ℃保存备用。
2.1.3 PCR 扩增及高通量测序 利用引物(341F、806R) 和引物(ITS1F、ITS2R) 分别对细菌16S rDNA 的V3⁃V4 区和真菌内源转录间隔ITS1 区进行PCR 扩增,产物使用2%琼脂糖凝胶进行电泳检测回收,并用GeneJET 胶回收试剂盒纯化,利用单端测序的方法,构建小片段文库,构建好的文库经过Qubit 定量和文库检测合格后,再采用IonS5TMXL 测序平台进行上机测序(北京诺禾致源科技股份有限公司)。
2.1.4 序列数据处理与分析 使用Cutadapt(V1.9.1) 对Reads 进行过滤,截去Barcode 和引物序列并去除嵌合体序列,得到最终的Clean Reads[13];利用 Uparse 软件 (V7.0.1001) 对Clean Reads 在97%的相似度水平下进行聚类成为OTU (Operational taxonomic unit)[14]。根据OTU 的聚类结果,以SSUrRNA 数据库对OTU 序列进行物种注释分析[15],获得分类学信息和酒曲与酒糟在不同分类水平上的菌群组成,用柱状图或饼图进行可视化。同时,使用Qiime (V1.9.1) 进行OTU丰度与Alpha 多样性指数的计算。
2.2 结果
2.2.1 样品OTU 聚类分析 由表1 可知,本次高通量测序结果充分反映了酒曲与酒糟的微生物多样性。酒曲中得到的可用于后续数据分析的细菌有效序列80 065 条,有效率为95.92%;真菌的有效序列31 898,有效率为95.71%。酒糟中得到的可用于后续数据分析的细菌有效序列80 096 条,有效率为97.32%;真菌的有效序列21 504,有效率为97.01%。酒曲与酒糟中细菌的ACE 和Chao1 指数均大于真菌,表明两者中细菌菌群丰富度大于真菌菌群,提示细菌可能将在后续的五倍子发酵过程中发挥着重要的作用。从Shannon 指数和Simpson 指数来看,酒曲与酒糟中细菌群落的多样性也高于真菌,且酒糟的细菌和真菌菌群的多样性均高于酒曲。另外,两者Coverage 指数都非常接近1,表明本实验测序结果能真实有效地反映酒曲与酒糟中微生物多样性。

表1 样品OTU 聚类和多样性指数Tab.1 OTU clustering and diversity index of samples
2.2.2 样品OTU 物种统计 将酒曲与酒糟中OTU以门、纲、目、科、属、种的秩序依次进行分类信息统计,分析两者在各水平上的菌群结构,见表2。

表2 样品各分类水平OTU 物种统计Tab.2 Statistics of OTU species in each grade samples
由表2 可知,本研究的酒曲样品中细菌菌群分布在6 个门、9 个纲、18 个目、23 个科、29 个属中;真菌菌群分布在在4 个门、6 个纲、10 个目、16 个科、21 个属中。而酒糟样品中细菌菌群则分布在9 个门、12 个纲、25 个目、36 个科、56 个属中;真菌菌群则分布在4 个门、9 个纲、14 个目、19 个科、28 个属中。以上结果进一步表明,酒曲与酒糟中细菌菌群多样性均高于真菌菌群,且酒糟中细菌与真菌菌群多样性则分别高于酒曲。另外,表2 中显示酒曲与酒糟中微生物种水平的数据比属水平少,特别是细菌种属表现尤为明显,这可能与16S rDNA 对于亲缘关系较近的种属分辨率不高,部分微生物的分类鉴定仅到属水平相关;但采用16S rDNA 和ITS 的高通量测序法基本可在属及以上水平准确划分微生物[16]。
2.2.3 样品中微生物在门水平的组成 对酒曲与酒糟中微生物在门分类水平上进行分析,并将菌群丰度大于或等于1% 划分为优势菌门,其他菌门(丰度<1.0%) 归纳为其他(Others),结果见图1。酒曲细菌群主要包括厚壁菌门 (Firmicute,72%)、变形菌门 (Proteobacteria,20%) 及拟杆菌门(Bacteroidetes,7%),其他细菌菌门丰度值均小于1% (图1 S1⁃B);真菌群主要包括接合菌门 (Zygomycota,64%)、担 子 菌 门(Basidiomycota,25%)、子囊菌门 (Ascomycota,10%),其他真菌菌门丰度值小于1% (图1 S1⁃F)。酒糟细菌群主要包括厚壁菌门(Firmicute,38%)、放线菌门(Actinobacteria,24%)、变形菌门(Proteobacteria,22%)、蓝细菌门(Cyanobac⁃teria,8%)、拟杆菌门 (Bacteroidetes,1%),另有未得到分类学注释的菌群丰度值为5%,其他细菌菌门丰度值均小于1% (图1 S2⁃B);真菌群主要包括担子菌门(Basidiomycota,57%)、子囊菌门(Ascomycota,25%)、接合菌门 (Zygomycota,9%),另有未得到分类学注释的菌群丰度值为8%,其他真菌菌门丰度值小于1% (图1 S2⁃F)。相对于酒曲,酒糟中细菌在门分类水平上还包括相对丰度值较大的放线菌门和蓝细菌门,并有未得到分类学注释的菌群;而真菌群中两者在门分类水平上种类差异较小,但各菌门的相对丰度值差异较大。

图1 样品中细菌和真菌在门水平分布图Fig.1 Bacteria and fungus species distribution map of samples in the phylum lever
2.2.4 样品中微生物在属水平的组成 由于高通量测序技术分析酒曲与酒糟检测出大量微生物,多数菌群相对丰度值较低,为方便直观查看,拟选择在属水平上的优势菌属(丰度≥1.0%) 进行统计,其他菌门 (丰度<1.0%) 同样归纳为其他(Others),结果见图2。
酒曲中细菌属的分类水平按其丰度值排序,主要包括乳杆菌属(Lactobacillus,31%)、魏斯氏菌属 (Weissella,15%)、芽孢杆菌属 (Bacillus,11%)、不动杆菌属(Acinetobacter,9%)、片球菌属(Pediococcus,8%)、食单胞菌属 (Stenotroph⁃omonas,2%)、Chishuiella(7%)、葡萄球菌属(Staphylococcus,5%)、克雷伯菌属 (Klebsiella,2%) 及泛菌属(Pantoea,1%) 等,其他菌群丰度均小于1%,约占总菌群丰度的9% (图2 S1⁃B)。酒曲中乳酸菌作为优势细菌对于白酒中风味物质的产生至关重要[17]。真菌属则主要包括根霉属(Rhizopus,64%)、丝孢酵母属(Trichosporon,24%)、假丝酵母属 (Candida,3%)、曲霉属(Aspergillus,2%)、伊萨酵母属 (Issatchenkia,2%)、嗜热真菌属 (Thermomyces,1%)、热子囊菌属(Thermoascus,1%) 等;其他菌群丰度均小于1%,约占总菌群丰度的3% (图2 S1⁃F)。已有学者通过优选百药煎的炮制工艺研究,发现以根霉曲发酵五倍子的发酵效果最好[7],而本实验检测出酒曲中根霉属真菌相对丰度高达64%,是否意味着酒曲中根霉属真菌为五倍子发酵百药煎的功能微生物及酒曲中的细菌菌群,在发酵过程中的作用均需进一步研究。
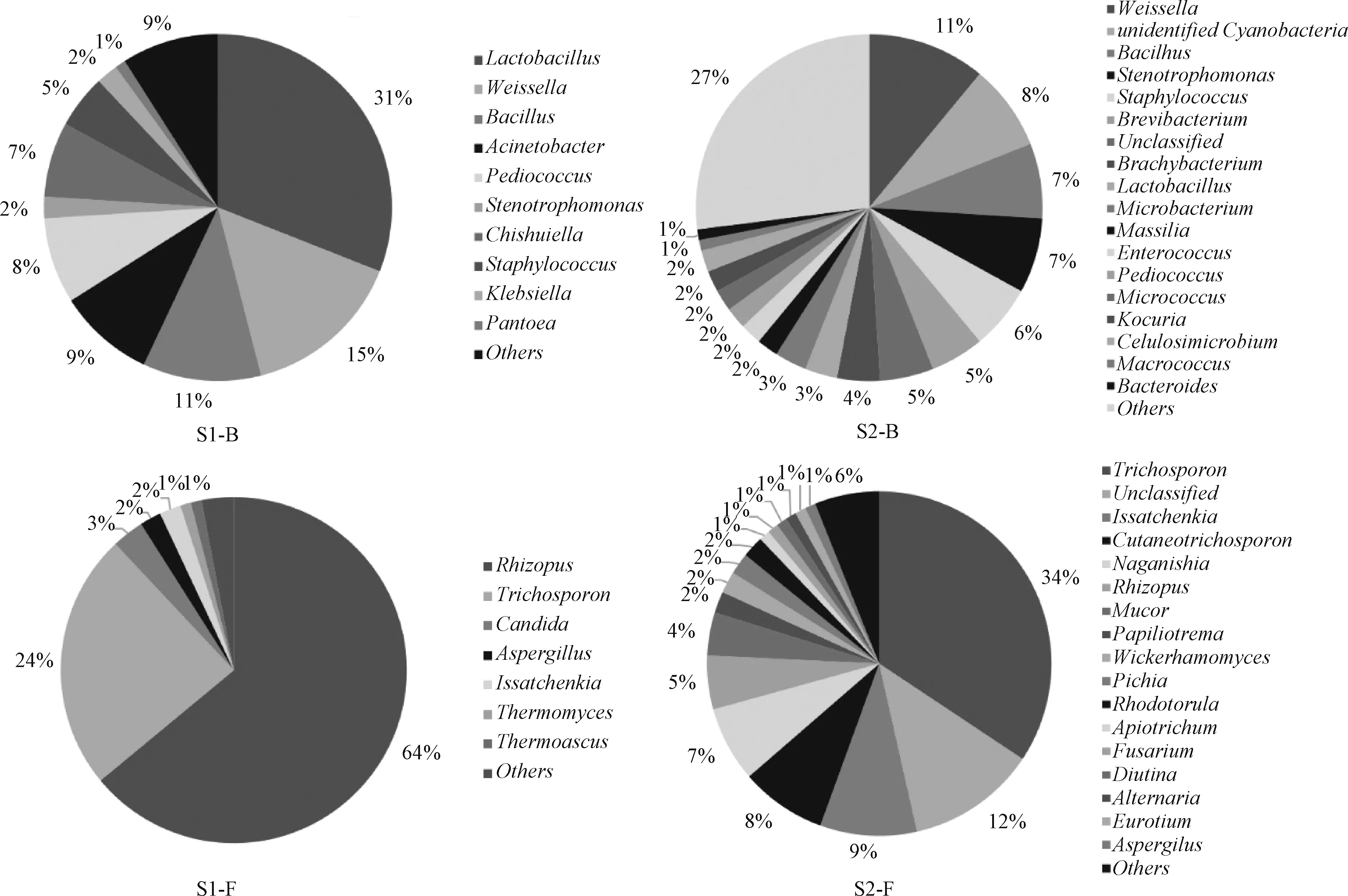
图2 样品中细菌和真菌在属水平分布图Fig.2 Bacteria and fungus species distribution map of samples in the genus level
酒糟中细菌属的分类水平按其丰度值排序,主要包括魏斯氏菌属(Weissella,11%)、未定义蓝细菌(Unidentified Cyanobacteria,8%)、芽孢杆菌属 (Bacillus,7%)、食 单 胞 菌 属(Stenotrophomonas,7%)、葡萄球菌属 (Staphylo⁃coccus,6%)、短杆菌属 (Brevibacterium,5%)、短状杆菌属 (Brachybacterium,4%)、乳杆菌属(Lactobacillus,3%)、微杆菌属 (Microbacterium,3%)、马赛菌属(Massilia,2%)、肠球菌属(En⁃terococcus,2%)、片球菌属 (Pediococcus,2%)、微球菌属 (Micrococcus,2%)、库克菌属(Kocuria,2%)、纤维菌属 (Cellulosimicrobium,2%)、巨球菌属(Macrococcus,1%) 及拟杆菌属(Bacteroides,1%) 等,另有未得到分类学注释的菌群丰度为5%,其他菌群丰度占总菌群丰度的27% (图2 S2⁃B)。真菌属则主要包括丝孢酵母属(Trichosporon,34%)、伊萨酵母属 (Issatchenkia,9%)、Cutaneotrichosporon(8%)、Naganishia(7%)、根霉属 (Rhizopus,5%)、毛霉属(Mucor,4%)、Papiliotrema(2%)、威克汉姆酵母属 (Wickerhamomyces,2%)、毕 赤 酵 母 属(Pichia,2%)、红酵母属 (Rhodotorula,2%)、Apiotrichum(1%)、镰刀菌属 (Fusarium,1%)、Diutina(1%)、链格孢属(Alternaria,1%)、散囊菌属(Eurotium,1%)、曲霉属(Aspergillus,1%)等,另有未得到分类学注释的菌群丰度为12%,其他菌群丰度占总菌群丰度的6% (图2 S2⁃F)。从真菌属的分类水平来看,酒糟中主要优势真菌属包括丝孢酵母属和伊萨酵母属,其中丝孢酵母属是一种非酿酒酵母,但其具有丰富的酶系(如蛋白酶和脂肪酶),可以参与并促进葡萄酒发酵而形成特有的品质与风味[18]。
2.2.5 样品OTU⁃Venn 图 从图3 中可知,酒曲与酒糟中高相似度细菌OTU 有90 个,占酒曲总OTU 的84.11%,占酒糟总OTU 的22.84%;而高相似度真菌OTU 有65 个,占酒曲总OTU 的85.53%,占酒糟总OTU 的35.52%。

图3 样品中细菌和真菌OTU⁃Venn 图Fig.3 OTU⁃Venn of bacteria and fungus species in samples
高相似度细菌和真菌OTU 数占酒曲总OTU 的比均较高,表明酒曲与酒糟共同的菌群可能是酒曲自有的微生物,也可能是宜宾地区酒曲特有的微生物体系,这与当地的制曲独具地域性特色密切相关。而对于酒曲和酒糟间存在微生物体系的较大差异性,则可能与厂家发酵生产白酒的环境(原料、用水、空气、窖池等) 及样品的加工与储存环境相关。因此可以认为,酒曲与酒糟中微生物的多样性,不仅与所处的地理环境有关,还可能与白酒生产过程、样品的加工与储存有紧密联系。
3 讨论
本实验采用高通量测序技术系统分析了同一酒厂的酒曲与酒糟细菌和真菌菌群结构。Alpha 多样性分析结果表明,2 样品的测序深度均足以覆盖其微生物的种类,也能有效地反映其微生物的多样性。OTU 物种统计结果表明,酒曲与酒糟中细菌菌群多样性均高于真菌菌群,且酒糟中细菌与真菌菌群多样性则分别高于酒曲。对微生物的相对丰度进行统计表明,在门的分类水平上酒曲与酒糟真菌菌群的种类差异较小但各菌门的相对丰度差异较大;相比于酒曲,酒糟细菌菌群多了放线菌门和蓝细菌门。在属的分类水平上,酒曲中的优势细菌类群主要包括乳杆菌属、魏斯氏菌属、芽孢杆菌属等,而酒糟中优势细菌类群则主要包括魏斯氏菌属、未定义蓝细菌、芽孢杆菌属等,两者中细菌菌群种类和相对丰度均差异较大。对于两者的真菌菌群,酒曲中优势真菌主要为根霉属、丝孢酵母属、假丝酵母属等,而酒糟中优势真菌主要为丝孢酵母属、伊萨酵母属、Cutaneotrichosporon等,且两者中真菌菌群种类和丰度也差异较大。此外,酒糟中检测出部分未得到分类学注释的微生物。
根据各省炮制工艺操作,酒曲与酒糟均可作为五倍子发酵生成百药煎的主要辅料(占全处方量的19.05%),然而同一酒厂的酒曲与酒糟中微生物物种存在较大差异。本实验结果发现酒糟的微生物物种较酒曲丰富,主要由于其微生物多样性反映的是白酒酿造全过程的微生物菌群结构,特别是与窖泥中丰富的微生物有关。高通量测序技术是对DNA 分子进行序列测定,与样品中微生物是否为活菌无关。酒糟,别名红糟、酒醅糟、粕等,实为酿酒后剩余的残渣,在酒醅形成酒糟的过程中有个高温蒸馏环节,多数不耐高温的细菌和真菌则可能会被杀死,相反酒曲则可能带有更多活菌参与发酵过程。加之酒曲与酒糟因来源不同而提供给微生物生长所需的营养物质及类型也存在差异,但两者均可参与五倍子发酵形成百药煎,其科学依据及两者在参与五倍子的发酵过程中,其“异中有同” 的关键均是进一步研究关注的重点。另外,本次测序分析发现酒曲中有相对丰度值较大的葡萄球菌属和克雷伯菌属细菌,它们为食源性致病微生物,可能因酒曲在生产、运输及储存过程中污染所致。
目前,虽已有五倍子发酵百药煎的发酵工艺优化研究,但是不同文献报道酵曲的选择不一,然而选择何种酵曲才能使发酵效果更好并确保临床用药安全有效仍有待于深入研究。本研究采用高通量测序技术对酒曲与酒糟中的菌群结构进行分析,该技术能较全面反映样品中微生物多样性,与传统分离培养方法相比具有一定优势,以期为继续深入研究酒曲与酒糟对五倍子发酵百药煎的影响,特别是对发酵过程中微生物菌群结构多样性、演替规律及发酵功能等影响提供参考,同时也为后续结合化学成分和药理作用的变化研究,建立五倍子发酵百药煎的微生物体系指标(功能微生物群) 及进一步优化其制备工艺奠定基础。

