牡蛎多肽对运动疲劳大鼠骨骼肌线粒体功能的影响
王建永
(郑州师范学院 体育学院,河南 郑州 450044)
运动性疲劳是源于肌肉疲劳和能量衰竭而引发的机体在特定水平上不能持续维持预定运动强度的一种自然生理现象,根据具体表现形式的不同又可分为躯体性疲劳和精神层面的疲劳[1-3].运动性疲劳对人体造成的负面影响较大,长期处于运动性疲劳的人群易引发过度训练症候群,如训练动机不足、认知加工能力低下、情绪低落或出现异常消极症状[4].因此,如何延缓疲劳的发生和促进运动后身体的恢复是目前体育康复及医疗保健领域研究的热点之一.牡蛎是一种珍贵的且营养价值极高的贝类动物,从中提取的多肽具有抗氧化、抗衰老、缓解疲劳等多种生物学作用[5-6].笔者主要从线粒体功能角度考察牡蛎多肽对线粒体氧化应激、线粒体结构及功能的影响,探讨牡蛎多肽对运动性疲劳的保护机制,以期为进一步开发利用牡蛎多肽的保健功能提供依据.
1 材料与方法
1.1 实验材料
清洁级健康雄性SD大鼠,体质量(200±10)g,由郑州大学实验动物中心提供,许可证号:SCXK(豫)2013-0009.牡蛎多肽,纯度>99%(HPLC法测定),陕西亿康龙生物技术有限公司,4 ℃干燥保存.
1.2 试剂与仪器
试剂:谷胱甘肽过氧化物酶(GSH-Px)、锰-超氧化物歧化酶(Mn-SOD)、丙二醛(MDA)检测试剂盒、ELC发光试剂盒、BCA蛋白浓度测定试剂盒,南京建成生物工程研究所;线粒体呼吸链复合体Ⅰ~Ⅳ试剂盒,上海杰美基因医药科技有限公司;血乳酸(BLA)检测试剂盒、尿素氮(BUN)检测试剂盒、ATP含量检测试剂盒,碧云天生物技术研究所;PGC-1α、TFAM抗体及羊抗兔二抗,Abcam公司;β-actin抗体,Santa Cruz公司;其他试剂均为分析纯.
仪器:JA2003A型电子天平,上海精密仪器厂; G1115A型紫外分光光度计,安捷伦(中国)有限公司;FSH-2型高速电动匀浆机,北京瑞丽分析仪器公司;Allegra 64R型高速冷冻离心机,贝克曼库尔特(中国)有限公司;DNM-9602型酶标仪,北京普朗新技术有限公司;Universal Hood Ⅱ凝胶成像系统,美国Bio-Rad公司.
1.3 实验方法
(1) 动物分组及给药:取50只雄性SD大鼠,适应性喂养3 d后随机分为正常对照组,模型组,牡蛎多肽低剂量组、中剂量组和高剂量组,每组各10只.对正常对照组和模型组灌服生理盐水,对牡蛎多肽组灌服低剂量(100 mg·kg-1·d-1)、中剂量(200 mg·kg-1·d-1)、高剂量(400 mg·kg-1·d-1)的牡蛎多肽溶液,连续灌服28 d.
(2) 训练方案建立:参照黄燕峰等[7]的方法建立大鼠运动性疲劳模型,除正常对照组外,其他组大鼠进行为期4周的负重游泳训练.具体方法为:每日对大鼠灌服药物1 h后,将体重5%的铅块固定在其尾部,一切就绪后,放置大鼠于水深30 cm、水温为(25±2) ℃的游泳池中进行游泳训练.第一周设置每日训练5 min,此后每递增一周增加5 min.第4周末灌服药物1 h后,对大鼠进行一次性力竭运动,力竭标准为大鼠运动、旋转协调性明显下降,身体下沉,鼻尖没入水中超过10 s且不能再次浮出水面[8].
(3) 大鼠疲劳相关生化指标检测:大鼠末次游泳力竭后,采用2%异戊巴比妥钠溶液麻醉,腹主动脉采血,3 500 r·min-1离心10 min,取上清液按试剂盒操作说明测定血清BLA、BUN含量.同时小心摘取大鼠股四头肌组织,并置于液氮中保存备用.
(4) 骨骼肌线粒体的提取:将分离后的肌肉组织剪碎,按重量体积比1∶9加入介质I(3 mmol·L-1Hepes,0.25 mol·L-1蔗糖,0.5 mmol·L-1EDTA,pH 7.4),充分匀浆后于800×g离心10 min,上清液于10 000×g离心10 min,沉淀加入介质Ⅱ(2 mmol·L-1Hepes,0.5 mmol·L-1EDTA,0.3 mmol·L-1蔗糖,pH 7.4),10 000×g离心10 min,再次的沉淀加入介质Ⅱ配制成悬液,于4 ℃冰箱中保存备用,线粒体蛋白含量采用BCA法进行检测.
(5) 骨骼肌线粒体自由基相关指标测定:取500 μL线粒体悬液,冰上研磨5 min破膜,10 000×g离心10 min,取上清液严格按照试剂盒说明书测定骨骼肌线粒体锰-超氧化物歧化酶(Mn-SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性及丙二醛(MDA)含量.
(6) 骨骼肌线粒体ATP合成能力及呼吸链复合体活性测定:线粒体ATP合成酶活性采用荧光素-荧光素酶发光法[9].向反应介质(0.5 μmol·L-1EDTA,3.0 μmol·L-1Hepes,0.25 mol·L-1蔗糖,0.1 mmol·L-1苹果酸,1.0 mmol·L-1谷氨酸)中加入0.05 mg的线粒体和20 μmol·L-1的荧光素酶,多功能酶标仪读取本底发光强度,然后再加入4 μmol·L-1ADP启动反应,再次读取发光强度,记录前后两次发光强度变化.线粒体呼吸链复合体(RCC)Ⅰ~Ⅳ的活性检测参考王增喜等[10]的方法,取10 μL线粒体蛋白加入RCC Ⅰ~Ⅳ反应缓冲液2 mL中,以蒸馏水作空白对照,校正吸光度为0,3 min内连续测定340,605,550,550 nm处吸光度值,以此表示骨骼肌线粒体呼吸链复合体酶RCC Ⅰ~Ⅳ的活性.
(7) 线粒体膜通透性转换孔(MPTP)活性测定:采用线粒体肿胀试验检测MPTP的开放程度[11].取0.3 mg· mL-1的线粒体溶液100 μL,加入2 mL反应缓冲液,孵育2 min后,加入200 μmol·L-1CaCl2诱导线粒体肿胀,采用分光光度计分别检测加入CaCl2即刻和反应10 min后540 nm处的两项吸光度值A0和A1,MPTP活性可用二者吸光度的差值(△A540=A0-A1)表示,数值越大,说明MPTP开放程度越大,线粒体肿胀程度越大.
(8) 骨骼肌PGC-1α、TFAM蛋白检测:常规方法提取大鼠骨骼肌蛋白后,采用BCA法测定蛋白含量.取20 μL蛋白缓冲液进行SDS-PAGE电泳,湿转法将其转至PVDF膜,5%的脱脂奶粉溶液封闭2 h,加入经过5% BSA-TBST稀释的PGC-1α、TFAM一抗(1∶1 000),4 ℃孵育过夜,次日洗膜后加入羊抗兔二抗(1∶2 500),室温孵育1 h,洗膜后ECL显影,采用Imagine J软件读取蛋白条带的灰度值,以β-actin为内参,实验所得灰度值除以内参灰度值为蛋白相对灰度值.
1.4 数据分析
实验数据采用SPSS 22.0统计学软件分析处理,组间差异比较行单因素方差分析,p<0.05及p<0.01分别表示结果有显著性差异和极显著性差异.
2 结 果
2.1 牡蛎多肽对各组大鼠BUN、BLA含量的影响
BUN及BLA是评价机体运动性疲劳的两个重要生化指标.笔者的实验结果列于表1.
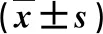
表1 牡蛎多肽对各组大鼠BUN、BLA含量的影响 mmol·L-1
表1中的结果显示:与正常对照组比较,模型组大鼠血清BUN、BLA含量显著升高,表明机体在较强运动中其抵抗疲劳的能力显著下降,但采用一定剂量的牡蛎多肽灌胃后,大鼠血清BUN、BLA含量有所降低,其中,低剂量组大鼠BUN、BLA含量较模型组显著降低(p<0.05),中、高剂量组大鼠BUN、BLA含量较模型组出现极显著降低(p<0.01).
2.2 牡蛎多肽对大鼠骨骼肌线粒体自由基代谢相关指标的比较
分别采用血乳酸(BLA)、尿素氮(BUN)检测试剂盒对大鼠骨骼肌线粒体进行检测,结果列于表2.
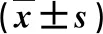
表2 牡蛎多肽对大鼠骨骼肌线粒体自由基代谢相关指标的影响
由表2可知:与正常对照组比较,模型组大鼠骨骼肌线粒体中Mn-SOD及GSH-Px水平显著降低,MDA含量显著升高(p<0.01);与模型组比较,牡蛎多肽低剂量组Mn-SOD及GSH-Px水平有所上升,MDA含量相对降低,而中、高剂量组骨骼肌线粒体中SOD及GSH-Px水平显著升高,MDA含量显著降低(p<0.01).
2.3 牡蛎多肽对大鼠骨骼肌线粒体呼吸链复合体活性及ATP合成能力的影响
各组大鼠骨骼肌线粒体RCC Ⅰ~Ⅳ的活性及ATP合成能力如表3所示.
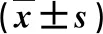
表3 牡蛎多肽对大鼠骨骼肌线粒体呼吸链复合体活性及ATP合成能力的影响
由表3可知:与正常对照组比较,模型组RCC Ⅰ~Ⅳ活性及ATP合成能力显著降低(p<0.01);与模型组比较,牡蛎多肽低剂量组RCC Ⅰ~Ⅳ活性有所上升,ATP合成能力显著上升,中、高剂量组RCC Ⅰ~Ⅳ活性和ATP合成能力均显著升高,中、高剂量组与模型组比较,差异具统计学意义(p<0.01).
2.4 牡蛎多肽对大鼠骨骼肌线粒体 MPTP开放状况的影响
MPTP作为线粒体内外信息交流的中心枢纽,其开放状态是否正常是维持线粒体稳定性和细胞功能的重要因素[12].牡蛎多肽对大鼠骨骼肌线粒体 MPTP开放状况的影响结果列于表4.
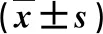
表4 牡蛎多肽对大鼠骨骼肌线粒体MPTP开放状况的影响
表4显示:与正常对照组比较,模型组大鼠骨骼肌线粒体的MPTP开放情况显著升高(p<0.01),与模型组比较,牡蛎多肽低、中、高剂量组大鼠骨骼肌线粒体的MPTP开放有所下降,组间比较差异具有统计学意义(p<0.01或p<0.05).
2.5 牡蛎多肽对大鼠骨骼肌PGC-1α、TFAM蛋白表达的影响
采用Western blot法检测大鼠骨骼肌线粒体相关蛋白PGC-1α和TFAM的表达,其结果如图1和表5所示.

(a)列为正常对照组;(b)列为模型组;(c)列为牡蛎多肽低剂量组;(d)列为牡蛎多肽中剂量组;(e)列为牡蛎多肽高剂量组.图1 牡蛎多肽对力竭运动大鼠PGC-1α和TFAM蛋白表达的影响
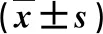
表5 各组大鼠骨骼肌PGC-1α和TFAM蛋白表达情况比较
图1和表5显示:与正常对照组比较,模型组PGC-1α和TFAM显著降低(p<0.01);与模型组比较,牡蛎多肽中、高剂量组的PGC-1α和TFAM蛋白表达显著升高(p<0.01或p<0.05),且蛋白表达量与牡蛎多肽含量呈现出一定的剂量依赖性.
3 讨 论
运动性疲劳主要表现为运动耐力下降、能量缺失、躯体性疲劳以及机体恢复时间延长,在生化水平上通常采用血乳酸、尿素氮的含量来对其进行评价.乳酸作为糖酵解产物,是引起机体疲劳的主要因素,乳酸积聚越多,表明机体疲劳程度越严重.此外,血尿素氮作为机体承受体力负荷能力的重要指标,也常用于机体疲劳模型的评定中.笔者对运动后大鼠的血乳酸及尿素氮的检测结果显示模型组大鼠血乳酸、尿素氮含量较正常对照组大鼠显著升高,说明高强度力竭运动可导致大鼠机体出现运动性疲劳,而运动过程中采用一定剂量牡蛎多肽进行灌胃后,各组大鼠血乳酸、尿素氮含量较模型组有所下降,表明牡蛎多肽可能具有一定的抗疲劳作用.
运动性疲劳多由肌肉过度运动引起,大量的氧自由基等有害物质在大强度运动下不断累积,骨骼肌出现氧化应激损伤,同时,运动性疲劳还可导致机体能量代谢出现紊乱,最终引发机体供能不足而产生身体疲劳感.大量研究表明,线粒体作为ATP合成的重要场所,在细胞能量中扮演着重要角色,线粒体结构异常和功能障碍是引发机体疲劳的潜在因素,因此维持线粒体的结构及功能正常对缓解机体运动性疲劳具有十分重要的意义[13-14].在高强度运动下,体内氧化应激不断增强,氧自由基不断攻击组织细胞或线粒体等生物膜,使之出现损伤或细胞凋亡[15].MDA作为重要的脂质过氧化产物,其值的高低反映了线粒体膜脂质受氧自由基攻击的严重程度.Mn-SOD和GSH-Px作为细胞线粒体中清除自由基的两个重要活性酶,对线粒体的氧化应激损伤起到十分重要的保护作用.在笔者的实验中,模型组大鼠线粒体Mn-SOD和GSH-Px水平出现下降,MDA含量有所上升,表明运动型疲劳引起机体氧化应激反应,补充牡蛎多肽后,大鼠线粒体Mn-SOD和GSH-Px水平上升,MDA含量有所下降,进一步说明牡蛎多肽可提高机体抗氧化能力,清除过多的氧自由基.
线粒体呼吸链体(RCC)是线粒体进行能量代谢的重要组成部件,其活性变化直接反映了ATP合成能力的强弱.常见的呼吸链复合体有RCC Ⅰ,Ⅱ,Ⅲ,Ⅳ4种,共同作用于氧化磷酸化过程,并生成能量分子ATP.其中RCC Ⅱ是琥珀酸-泛醌氧化还原酶,其活性反映了细胞内ATP的合成水平,RCC Ⅳ是细胞色素C氧化酶,作为呼吸链中末端氧化酶,主要负责电子传递,促使ADP磷酸化形成ATP.大量研究表明,大剂量高强度训练或急性离心运动可导致RCC活性下降,骨骼肌工作效率及运动能力降低[16-17].笔者的研究结果显示,与正常对照组比较,力竭运动后的模型组大鼠RCC Ⅰ~Ⅳ活性及ATP合成能力显著下降,每日补充一定剂量的牡蛎多肽可一定程度上提高RCC Ⅰ~Ⅳ活性及ATP合成,以此提供更多的能量,缓解过度运动造成的生理性疲劳.
MPTP是由位于线粒体内膜和外膜上的多种蛋白组成的蛋白复合体,对于维持细胞能量代谢和线粒体的正常功能起着重要作用.正常生理情况下,MPTP处于一种短暂的、间歇性的低通透性开放状态,线粒体内膜只对某些代谢底物和离子进行选择性通透,以保持ADP/ATP的转运,维持线粒体的正常功能.当MPTP受外界过强刺激会呈现出一种不可逆的高通透性开放状态,膜外大量小分子物质会非选择性地进入线粒体内,造成线粒体渗透压增大,线粒体肿胀,引起外膜破裂.尚画雨等[18]报道疲劳引起的氧化应激可导致MPTP过度开放,通过对骨骼肌线粒体超微结构进行观察,发现肌纤维内线粒体成空泡化,线粒体结构表现出严重的异常.笔者的研究结果显示,过度运动后的模型组大鼠MPTP活性显著增加,牡蛎多肽各剂量组MPTP活性相对降低,进一步证实了牡蛎多肽可通过降低MPTP活性,调控线粒体开放状态,从而发挥机体抗疲劳的作用.
已有大量研究表明,PGC-1α在调控细胞线粒体生物合成和功能维持中发挥着重要作用[19-20].PGC-1α作为一个重要的调控蛋白通过与核呼吸因子NRF-1,NRF-2结合,共同刺激下游通路线粒体转录因子(TFAM)的表达,以此维持线粒体的正常复制与转录,为细胞代谢提供能量.此外,研究发现,PGC-1α在维持线粒体呼吸功能的同时还可增加SOD和GSH-Px酶的表达,以此帮助细胞在氧化能力改变的同时仍然保持正常的氧化还原状态.笔者的实验通过Western blot结果显示,模型组大鼠在高强度运动后,线粒体PGC-1α和TFAM的表达显著下降,相比较于模型组,牡蛎多肽组大鼠骨骼肌PGC-1α和TFAM的水平显著升高,提示牡蛎多肽可能通过上调PGC-1α和TFAM的水平,提高细胞能量供给,维持肌肉组织线粒体功能的正常.
综上所述,牡蛎多肽可对抗运动型疲劳,其机制可能与改善线粒体氧化应激状态、降低线粒体膜的通透性、强化呼吸功能、上调PGC-1α和TFAM的表达相关.

