沉水植物狐尾藻对污水厂尾水的生理响应
陈 洁,张松贺,龚利雪,裘 筝
(河海大学 环境学院,江苏 南京 210098)
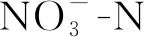
近年来,随着水污染治理的增强,城镇污水处理厂在处理城镇污水方面发挥了重要的功能.当前,《城镇污水处理厂污染物排放标准》(GB18918-2002)根据污染物浓度指标(c(COD) 50~120 mg·L-1,c(NH3-N)≥5 mg·L-1,c(TN)≥15 mg·L-1,c(TP) 0.5~5 mg·L-1)将城镇污水处理厂尾水分为一级标准、二级标准和三级标准,其中一级标准分为A标准和B标准. 这些营养物质的浓度显著高于地表水水质标准,且显著高于文献报道的部分沉水植物的耐受浓度[2-4].然而目前研究多为某种营养物质(氮或磷等无机物)对沉水植物生长及生理代谢活动的影响,关于城镇污水厂尾水(一级A、一级B和二级)对沉水植物直接胁迫效应的研究鲜有报道. 因此,阐明不同浓度污水厂尾水对沉水植物生理活动的影响,以了解沉水植物被用于处理污水厂尾水的人工湿地中的衰退机制.
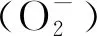
1 材料与方法
1.1 实验材料与设计
实验所用沉水植物狐尾藻为从南京高淳水生植物繁育研发基地购买;实验所用沉积物取自南京乌龙潭表层沉积物,搅拌均匀后静置备用. 实验地点为河海大学浅水湖泊综合治理与资源开发教育部重点实验室的温室(温室顶部带有遮阳网,透光率约60%),温室依靠自然光,通风条件良好,以模拟自然条件下不同浓度污水厂尾水排放对狐尾藻的生理影响. 将购回的植物均匀地种植于水箱中,并按1∶100的比例加MS培养液与自来水,观察植物长势,及时清理死亡的植株.
在温室内同一区域放置9个等体积的白色塑料水箱(670 mm×480 mm×390 mm,120 L),每个水箱底部铺设10 cm底泥,并加入90 L自来水. 待沉积物沉降均匀后,在各实验桶中分别种植60株生长状况良好且植株高度、重量等较均一的狐尾藻(生物量约200 g),并稳定一周. 实验水质设置3种浓度梯度:一级A、一级B和二级出水标准(参照《城镇污水处理厂污染物排放标准》(GB18918-2002)),每组水质设定3个平行. 实验时间为2016年8月,实验周期21 d,采集样品后及时加水,保持水位恒定. 供试尾水水质如表1所示,其中一级A、一级B和二级尾水分别定义为STPEA、STPEB和STPEC.

表1 供试模拟尾水水质浓度 mg·L-1
实验初始水质根据城镇污水处理厂尾水排放标准,在自来水中加入氯化铵、硝酸钾、磷酸二氢钾和蔗糖调至3种污水厂尾水水质浓度(见表1). 试验期间,每6 d采集各实验桶中的水样,于24 h内完成氨氮、总氮、总磷和高锰酸盐指数的检测并添加NH4Cl、KNO3、KH2PO4和蔗糖用于维持水体氨氮、总氮、总磷和高锰酸盐指数的设定值. 实验开始后分别采集处理0,7,21 d的不同水质的植物样品. 预留10 g新鲜植物样品用于叶绿素的测定,剩余样品用液氮冷冻后放入超低温冰箱 (-65 ℃) ,以便后续其他指标的测定.
1.2 狐尾藻生理指标测定方法
1.2.1 叶绿素的测定
叶绿素含量测定采用95%乙醇-丙酮提取法[5],分别于645,663 nm波长下测定吸光度值,叶绿素a、叶绿素b和叶绿素的总含量计算公式分别为
Chl=Chla+Chlb,
其中:A645和A663分别为645 nm 和663 nm下的吸光度值;V为提取液的体积,W为叶片的鲜重[6].
1.2.2 其余生理指标的测定
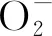
1.3 数据处理
数据的处理和作图使用 Excel 2013 及 Origin 8.5.利用 SPSS 19.0 软件进行单因素方差分析和 Fisher’s 显著性检验(LSD). 利用 Canoco 5.0 软件绘制 RDA 图.
2 结果与分析
2.1 尾水胁迫对狐尾藻叶片的叶绿素含量影响
在试验初期(0 d),3种水质条件下的狐尾藻叶片内叶绿素a、叶绿素b和总叶绿素含量间无显著差异(图1),狐尾藻叶绿素a、叶绿素b和总叶绿素含量随时间均呈现先上升后下降的趋势(图1). 在尾水胁迫7 d时,STPEB处理下的叶片内叶绿素a、叶绿素b和总叶绿素含量达到峰值,分别比初始值增加了1.32,1.53和1.38倍;在21 d时,STPEA处理下的叶绿素a、叶绿素b、总叶绿素含量达到最低值. 整体上,STPEB处理下的狐尾藻叶片内叶绿素a、叶绿素b、总叶绿素含量始终高于STPEA和STPEC.
2.2 尾水胁迫对狐尾藻叶片内可溶性蛋白、可溶性糖和淀粉含量的影响
在3种处理中,狐尾藻叶片内的可溶性蛋白和可溶性糖含量均在前7 d升高,后期逐渐下降(图2),而淀粉含量的变化趋势有所不同. 其中,STPEC处理下的可溶性蛋白含量显著高于STPEA和STPEB的(p<0.05); 而STPEB处理下的可溶性糖含量显著高于STPEA和STPEC的(p<0.05),实验结束时3种处理中的可溶性蛋白和可溶性糖含量均显著高于初始值(p<0.05). 叶片内的淀粉含量在STPEA和STPEB处理下均随时间逐渐增加,而在STPEC处理下随时间逐渐下降,实验结束时,STPEA处理下的淀粉含量分别是STPEB和STPEC处理下的1.40和1.89倍,三者差异显著(p<0.05).
2.3 尾水胁迫对狐尾藻叶片内丙二醛(MDA)和超氧阴离子含量的影响
2.4 尾水胁迫对狐尾藻叶片内抗氧化物质(SOD,CAT,GSH)的影响
3种处理中,狐尾藻叶片内SOD活性和GSH含量随胁迫时间的延长而增加,而CAT活性随时间延长逐渐下降,如图4所示. 胁迫7 d时,STPEA处理下的SOD活性分别是STPEB和STPEC的1.28和1.49倍;胁迫21 d时,STPEA和STPEC处理下的SOD活性无显著差异(p>0.05),但均显著高于STPEB的(p<0.05). CAT活性在STPEA处理下始终高于STPEB和STPEC的,且胁迫7d时三者间差异显著(p<0.05),3种尾水处理下的CAT最终活性为STPEA>STPEB>STPEC. 狐尾藻叶片内GSH活性在前7 d增长较快,7~21 d增长速度减慢;21 d时,GSH含量较第0 d明显增加,且STPEA和STPEC处理下的GSH含量显著高于STPEB的(p<0.05).
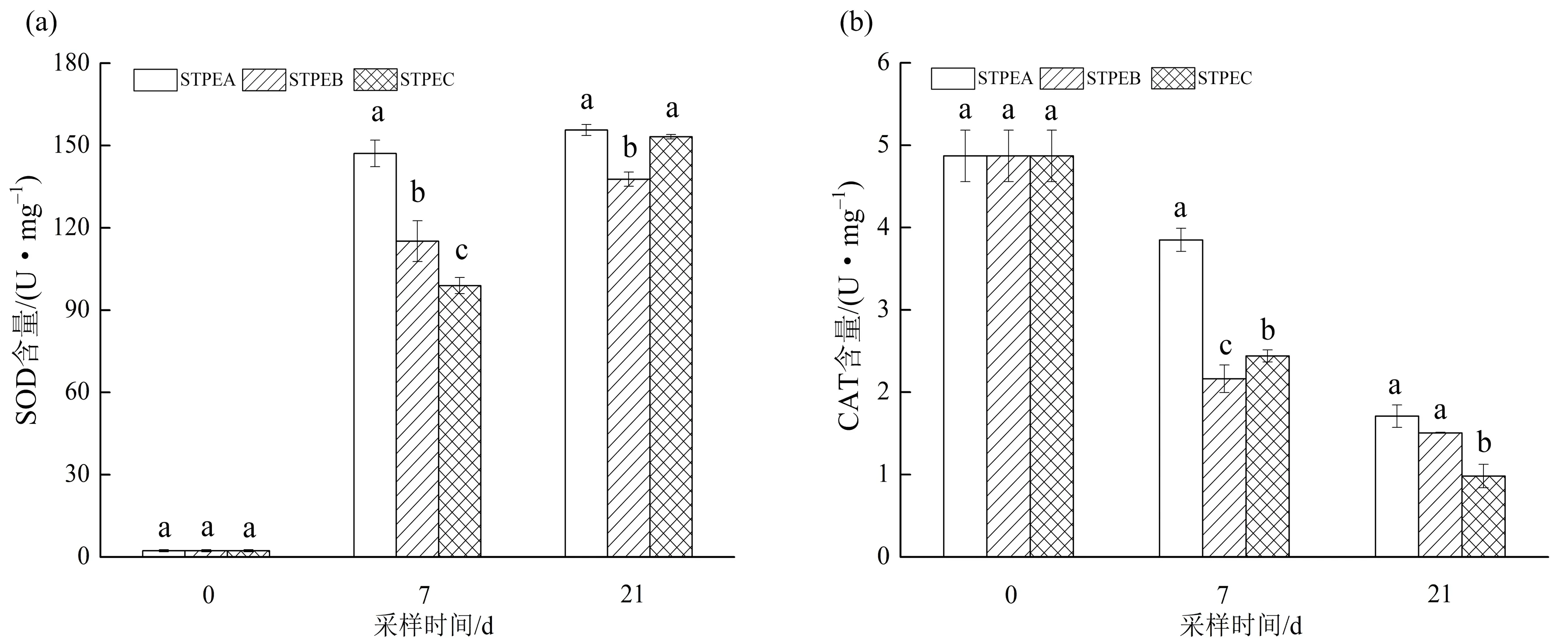
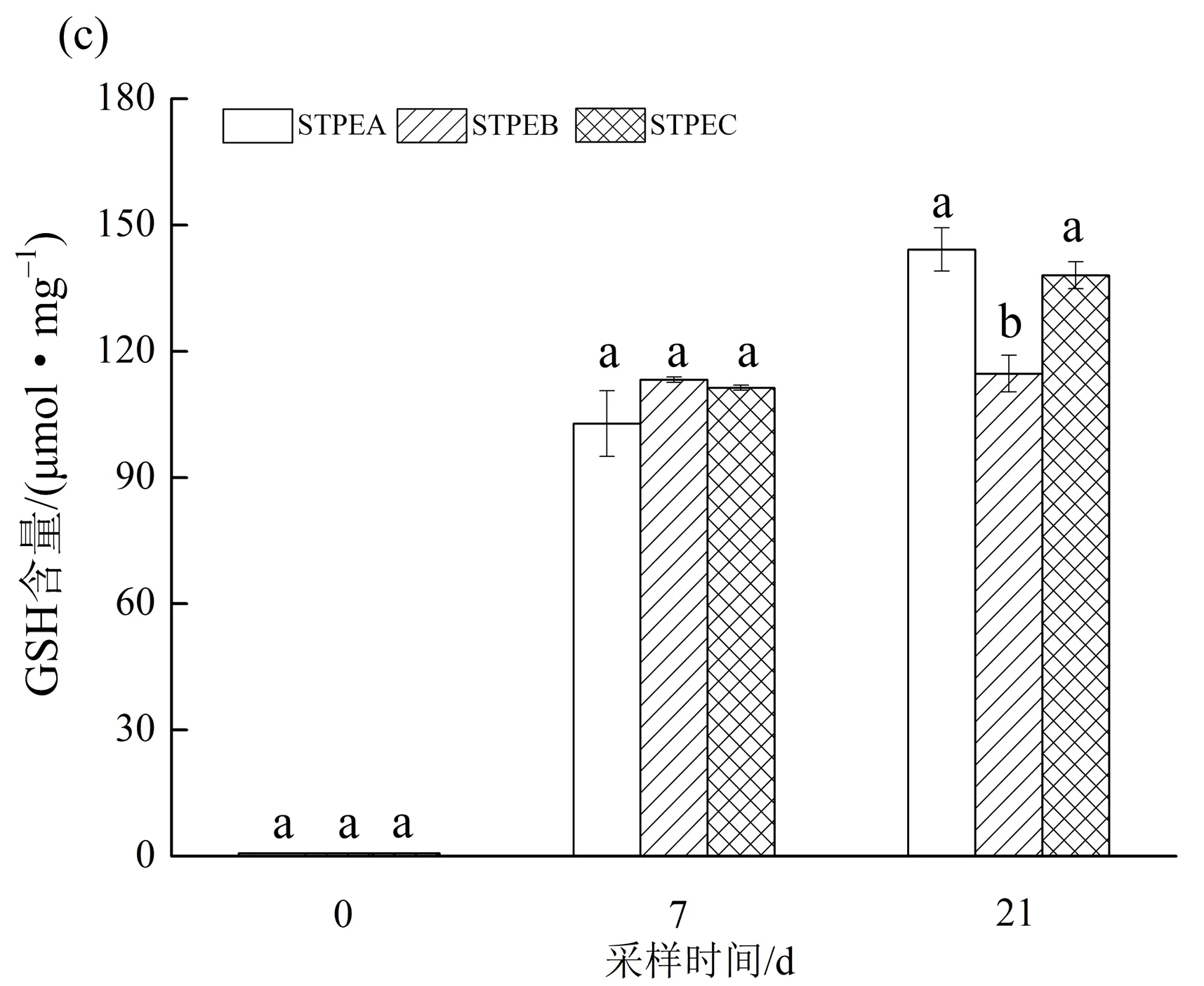
不同小写字母(a,b,c)表示同一取样时间不同处理组间存在显著性差异,p<0.05;STPEA,STPEB,STPEC分别代表城镇污水处理厂一级A、一级B和二级尾水.图4 不同尾水条件下狐尾藻 SOD、CAT 和 GSH 的活性变化
2.5 水质指标与狐尾藻叶片内生理指标的潜在关系分析
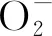
图5 不同尾水条件下狐尾藻叶片内的生理指标冗余分析
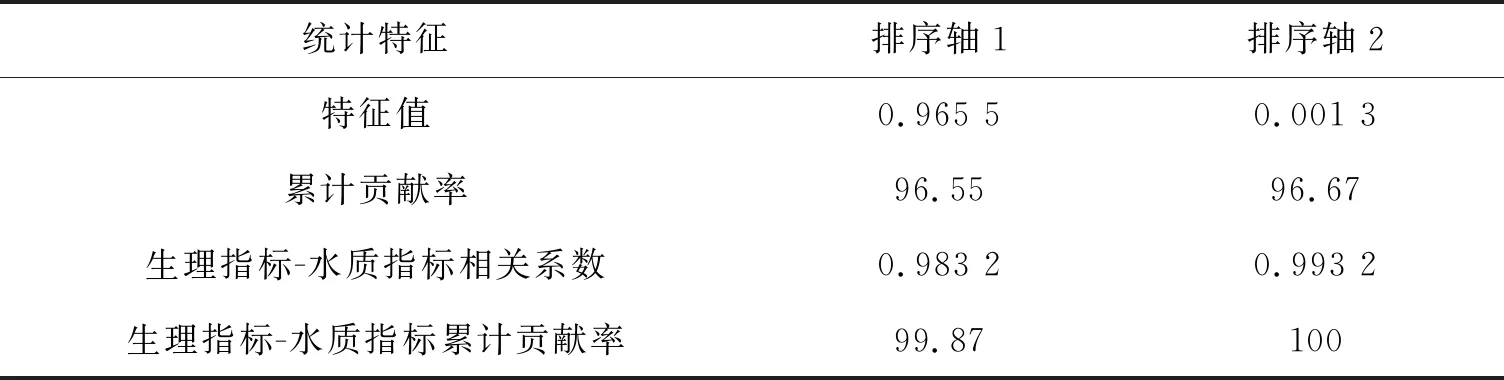
表2 尾水水质与植物叶片生理指标冗余分析(RDA)前两轴的统计特征
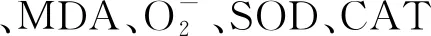
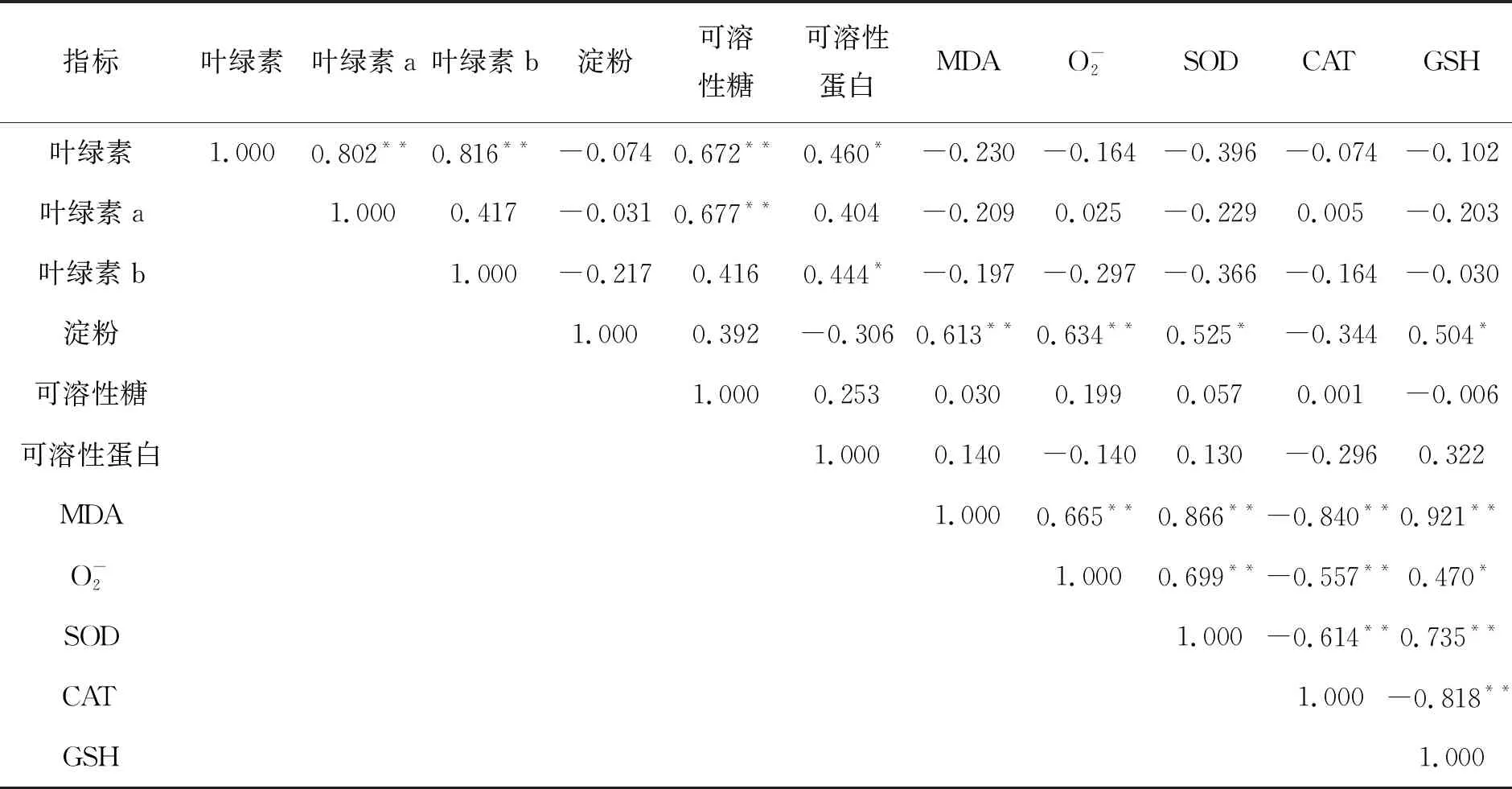
表3 狐尾藻各项生理指标的Spearman秩相关系数
3 讨 论
叶绿素是植物进行光合作用必不可少的物质,是植物对环境胁迫反应敏感性的生理指标[6,8]. 实验中,3种尾水处理中的狐尾藻叶片内叶绿素a、叶绿素b和总叶绿素含量均在第7 d明显升高,第21 d显著下降(图1). 这与颜昌宙等[9]对氨氮胁迫下轮叶黑藻叶片的叶绿素含量变化及刘燕等[10]对狐尾藻叶片在富营养水平下叶绿素含量的研究结果一致. 这表明尾水中的高营养盐在短时间内可以促进狐尾藻的光合作用,但持续胁迫会使狐尾藻的光合作用系统受到损伤.
植物在遭受各种逆境胁迫时,会迅速产生并积累可溶性糖、可溶性蛋白等渗透调节物质,以抵抗外界各种胁迫的伤害[5]. 可溶性糖在参与渗透调节的同时可为植物生长和对抗不利环境因素提供能量;可溶性蛋白不仅参与植物体内大部分的代谢活动,还具有较强的亲水性,可缓解因渗透胁迫所造成的细胞失水[11]. 笔者的研究中,狐尾藻叶片中可溶性糖、可溶性蛋白均在3种尾水处理7 d时激增,处理21 d时下降(图2(a)~(b)). 说明狐尾藻通过提高可溶性糖和可溶性蛋白含量以适应高营养盐环境,但随着胁迫时间的延长,渗透调节物质含量减少,平衡机制受到破坏,抗逆性降低.
淀粉是植物主要的能量贮存物质,其氧化后为植物生长提供能量,当淀粉合成速率大于分解速率,会使淀粉积累,对光合作用造成反馈抑制,促进叶片老化[12]. 笔者的研究结果表明,淀粉含量在一级A和一级B尾水中随时间的延长呈现出增加的趋势(图2(c)),这可能是尾水的持续胁迫导致狐尾藻呼吸代谢紊乱,产生的ATP减少,遏制了水解淀粉的能力,使植物体叶片中的淀粉含量升高,这与周勇辉等[13]的研究结果相似. 而二级尾水中淀粉含量随时间呈现下降趋势,原因可能是高营养盐尾水使狐尾藻的光合作用减弱,叶片内的淀粉逐渐被消耗或合成储存量减少.
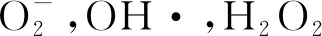
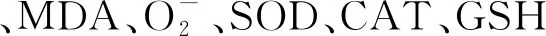
——以武汉东湖为例
——以武汉紫阳湖为例

