细胞器靶向光敏剂的研究进展
李西鹏,张 涛
(华南师范大学生物光子学研究院,激光生命科学研究所教育部重点实验室,广州510631)
光动力治疗(photodynamic therapy)是一种光激活的在临床上非常有前景的癌症治疗方式[1-3]。在光动力治疗过程中,光敏剂在特定波长的激光照射下被激活,生成活性很强的活性氧物种(reactive oxygen species,ROS),如单线态氧,其能与附近生物大分子发生氧化反应产生细胞毒性,进而杀伤肿瘤细胞[4-7]。然而,ROS 的半衰期很短(<40 ns),并且只能在生成部位附近起作用(<20 nm),这比整个细胞的尺寸小得多[8-11]。因此,将光敏剂递送至对ROS敏感的细胞器将有望改善光动力治疗的效果。
细胞是生物体的基本功能单元,而细胞器则是细胞功能正常运行不可缺失的部分。真核细胞的细胞器主要包括细胞核、线粒体、溶酶体、内质网等。只有每种细胞器各司其职,协助细胞完成正常的生理功能,生命才能得以存在和延续。因此,细胞器被认为是光动力治疗的重要靶标。设计不同细胞器的靶向光敏剂能增强光敏剂在细胞器的聚集,有助于提高光动力治疗的疗效,减少毒副作用。本文主要聚焦细胞器靶向光敏剂的实现策略的研究现状,并希望为以后构建新的靶向型光敏剂提供参考。
1 细胞核靶向光敏剂
众所周知,细胞核是细胞内遗传物质储存、复制、转录的场所,在细胞的代谢、生长和分化中起着重要的作用[12-13]。细胞核是高度分化的细胞器,具有双层磷脂膜,核膜上的核孔复合体(nuclear pore complexes,NPCs)是物质进入细胞核的唯一通道。现阶段细胞核靶向主要利用穿膜肽(transcriptional activator protein,TAT)和核定位序列(nuclear localization sequence,NLS)来实现。
1.1 TAT
Yu等[14]合成了1种基于上转换纳米粒子(upconversion nanoparticles,UCNPs)的细胞核靶向双光敏剂 NaFY4:Yb,Er,Tm@TiO2-Chlorin e6-TAT(UCNPs@TiO2-Ce6-TAT)。UCNPs的激发光为980 nm,发射光为362 nm和655 nm,这2种波长的发射光分别被 TiO2和二氢卟吩 e6(chlorin e6,Ce6)吸收并产生多种ROS。利用TAT将纳米颗粒转移至细胞核,使ROS在核内积累。细胞核中大量ROS的积累会破坏DNA双链导致细胞死亡(图1)。

图1 核靶向双光敏剂UCNPs@TiO2-Ce6-TAT在980 nm近红外激光激发下产生多种ROS并诱导DNA双链断裂的示意图[14]Fig.1 Schematic illustration of the synthetic process of the nuclear targeted dual-photosensitizer UCNPs@TiO2-Ce6-TAT,multiple ROS generation under a single 980 nm NIR laser excitation and inducing DNA double strand breaks[14]
1.2 NLS
Cheng等[15]制备了自传递嵌合肽纳米棒(self-delivery chimeric peptide nanorods,pnPNP),用于质膜和核靶向的光敏剂传递。嵌合的肽[C16K(PpIX)PKK KRKVPEG8]由用于质膜靶向的疏水烷基链(C16)、光敏剂原卟啉(protoporphyrin IX,PpIX)、核定位序列PKKKRKV和一个亲水的聚乙二醇(polyethylene glycol,PEG)链组成。质膜靶向pnPNP可直接诱导细胞坏死,增强细胞膜的通透性,从而改善细胞摄取。随后,光诱导的内源/溶酶体破坏,促进了pnPNP的溶酶体逃逸。在NLS肽的参与下,具有正表面电荷自组装的纳米棒pnPNP能够定位于细胞核。细胞核内产生的ROS将对DNA链造成显著的氧化损伤(图 2)。

图2 pnPNP用于质膜和核靶向光动力治疗的原理图[15]Fig.2 Schematic illustration of pnPNP for plasma membrane and nucleus targeted photodynamic therapy[15]
2 线粒体靶向光敏剂
线粒体作为至关重要的细胞器在细胞能量的产生和细胞的程序性死亡过程中起着关键的作用[16-17]。因此,线粒体被认为是光动力治疗肿瘤的重要靶标,增强光敏剂在线粒体部位的聚集将有助于提高光动力治疗的疗效。
目前,实现光敏剂靶向线粒体的策略主要有3种:一是离域亲脂性阳离子(delocalized lipophilic cation,DLC)靶向;二是线粒体靶向肽策略;三是构建纳米载体。其中三苯基膦(triphenylphosphine,TPP)是最典型的、应用最广泛的线粒体靶向配体,主要是因为其结构简单,能与光敏剂末端连接且不破坏光敏剂。这里主要介绍基于TPP的2种纳米载体负载光敏剂的策略。
2.1 有机线粒体靶向纳米载体负载光敏剂
有机纳米载体具有载运效率高、体内循环周期短、生物毒性小和载药种类多等独特的优势,已在线粒体靶向光动力治疗中被广泛应用。
Yue等[18]将TPP连在热敏脂质体上,并在脂质体内部装载光敏剂IR-780和抗癌药洛尼达明,构建成线粒体靶向的热敏型脂质体(IR-780 and Lonidamine encapsulated mitochondria-targeting thermosensitive liposomes,IL-TTSL),用于靶向肿瘤线粒体光热触发的光热-光动力-化学治疗。在近红外(near infrared,NIR)激光的照射下,IR-780引起局部温度升高从而诱导洛尼达明的释放,可用于化学治疗,且局部的高温还可用于光热治疗。同时IR-780在肿瘤线粒体中产生大量的ROS,实现了最大化的光动力治疗(图3)。

图3 808 nm激光触发线粒体靶向热敏脂质体IL-TTSL化疗-光动力和光热联合疗法的示意图[18]Fig.3 Schematic illustration of the mitochondria-targeting thermosensitive liposomes IL-TTSL for chemo-,photodynamic and photothermal combined therapy triggered by 808 nm laser[18]
Guan等[17]将TPP与聚集诱导发光(aggregation-induced emission,AIE)聚合物相连,同时将上转换纳米粒子负载在其内部,构建成UCNP@PAIE-TPP NPs,解决了AIE光敏剂只能被紫外或可见光激活的问题(图4)。在NIR激光的照射下,上转换纳米粒子发出上转换荧光,并激活AIE聚合物在线粒体部位产生高水平的ROS。
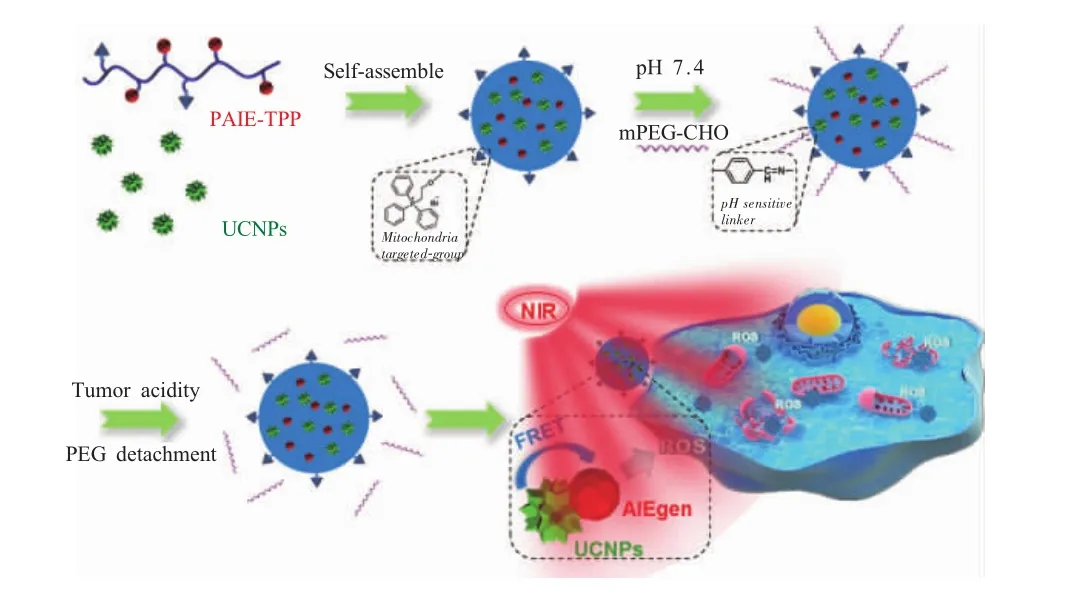
图4 pH响应的UCNP@PAIE-TPP-PEG NP作为近红外光触发线粒体靶向光敏剂产生ROS用于光动力治疗的示意图[19]Fig.4 Schematic diagram of pH responsive UCNP@PAIETPP-PEG NPs as the NIR triggered mitochondria targeting photosensitizer to generate ROS for photodynamic therapy[19]
Yang等[20]设计合成了一种多步响应性智能纳米粒子(CAT@S/Ce6-CTPP/DPEG),该纳米粒子具有如下优势:1)对pH敏感,并且响应pH后会变成带正电的颗粒,能够增强肿瘤的内吞作用,增加纳米粒子在肿瘤部位的滞留时间;2)在肿瘤微酸环境的作用下,TPP暴露出来,从而使得纳米粒子靶向线粒体;3)过氧化氢酶催化过氧化氢产生氧气,克服了肿瘤缺氧问题,进一步增强了光动力治疗的疗效;4)其与程序性死亡配体 1(programmed deathligand 1,PD-L1)抗体结合,还能抑制肿瘤的转移(图5)。

图5 智能纳米反应器用于pH响应性肿瘤归巢、线粒体靶向和增强型光动力免疫疗法的示意图[20]Fig.5 Schematic diagram of smart nanoreactors for pH-responsive tumor homing,mitochondria-targeting,and enhanced photodynamic-immunotherapy of cancer[20]
2.2 无机线粒体靶向纳米载体负载光敏剂
无机纳米载体通常具有适用于细胞递送的通用特性,包括广泛的可用性、丰富的功能、良好的生物相容性、靶向递送的潜在能力和可控释药,表面还可进行修饰扩展其功能性。基于上述优势,无机纳米载体在线粒体靶向光动力治疗领域受到了广泛的关注。
Yu等[21]将TPP修饰到负载TiO2的上转换纳米粒子UCNPs表面,用以靶向线粒体,在NIR激光照射下进行光动力治疗。在光动力治疗的研究中,UCNPs@TiO2-NH2组在光照条件下仅能杀死30%的癌细胞,而修饰了TPP的UCNPs@TiO2-NH2组的肿瘤细胞抑制率达到90%,光动力治疗效果显著提升(图 6)。
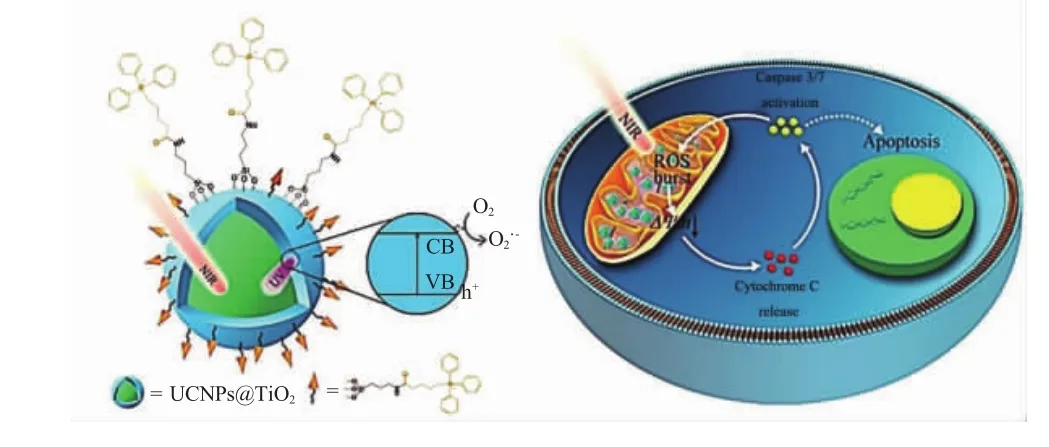
图6 纳米光敏剂(TPP锚定的UCNPs@TiO2纳米颗粒)的结构和ROS生成的示意图[21]Fig.6 Schematic illustration of the structure of the nanophotosensitizer(TPP anchored UCNPs@TiO2nanoparticles)and ROS generation[21]
Yang 等[22]首先将聚多巴胺(polydopamine,PDA)负载到黑磷(black phosphorus,BP)上形成BP@PDA,然后将TPP和Ce6与BP@PDA相连,构建成光疗剂BP@PDA-Ce6&TPP NSs,用于线粒体靶向的光热-光动力治疗(图7)。

图7 BP@PDA-Ce6&TPP NS的制备和治疗功能的示意图[22]Fig.7 Schematic illustration of the preparation and therapeutic functions of BP@PDA-Ce6&TPP NSs[22]
3 溶酶体靶向光敏剂
溶酶体是一种动态的、多态的、含水解酶的细胞器,具有接受和降解来自分泌、内吞、自噬和吞噬膜转运途径的大分子的能力。溶酶体的功能取决于膜的完整性。溶酶体膜的受损(例如碱化或易位)会导致质子和水解酶泄漏,从而引起细胞器功能障碍,最终诱导细胞凋亡[23-25]。因此,设计靶向溶酶体的光敏剂,可以迅速引起溶酶体功能障碍。Li等[26]设计了一个双碘取代的氟硼二吡咯(diiodo-substituted BODIPY,MBDP)(图 8)作为光敏剂。试验表明,在激光照射下,溶酶体特异性靶向的MBDP会破坏溶酶体的完整性,最终引起癌细胞凋亡。

图8 溶酶体靶向光敏剂MBDP的结构和光动力治疗示意图[26]Fig.8 Schematic diagram of the structure and photodynamic therapy of lysosomal targeting photosensitizer MBDP[26]
Niu等[27]设计了一种阳离子二萘嵌苯探针(cationic perylene probe,PC4)(图 9)。该探针具有极好的水溶解性、高化学稳定性、光稳定性以及高效的单线氧产生能力。PC4能特异性靶向溶酶体,3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]试验证明,PC4具有可忽略不计的暗毒性(IC50>500 mmol/L),并且在光照下,低剂量的PC4显示出优异的光毒性(IC50=2.8 mmol/L,4.2 J/cm2)。更重要的是,PC4在死细胞中从溶酶体向细胞核的移动为监测和评估治疗效果提供了一个有效的方法。
Zhou等[28]制备了Ru-Pt双金属双光子超分子配位化合物(supramolecular coordination complexes,SCCs)(图10)。由6个基于Ru(II)的光敏剂和4个基于Pt(II)的受体构建成1个单分子超集合体中的嵌段,通过协调驱动自组装形成八面体Ru-Pt,其具有深红色发射、较大范围的双光子吸收和高效的ROS产生效率。形成的纳米颗粒能选择性在溶酶体中积累。在体试验证明,使用Ru-Pt双金属的双光子光动力治疗具有显著的抗肿瘤功效。
4 内质网靶向光敏剂
内质网(endoplasmic reticulum,ER)是真核细胞中最大的细胞器,在多种细胞内代谢功能中起着复杂而关键的作用,包括生物合成、传感和信号转导,特别是在蛋白质折叠和翻译后修饰中。许多刺激物可引起内质网应激,通过未折叠蛋白反应以及Ca2+信号机制导致细胞凋亡[29-31]。

图9 溶酶体靶向光敏剂PC4的结构、光动力治疗和成像过程的示意图[27]Fig.9 Schematic diagram of the structure of lysosomal targeting photosensitizer PC4,photodynamic therapy and imaging process[27]

图10 溶酶体靶向光敏剂SCCs的结构[28]Fig.10 Structure of lysosomal targeting photosensitizer SCCs[28]
Zhou等[32]报道了一种基于氟硼二吡咯的内质网靶向光敏剂(boron dipyrromethene,BODIPY)(图 11)。在中间氢原子处引入2个卤素原子,通过重原子效应BODIPY可以产生单线态氧。在BODIPY核心的部分引入格列本脲能使光敏剂特异性靶向内质网,激光照射下能明显引发肿瘤细胞凋亡。

图11 内质网靶向光敏剂BODIPY的结构和光动力治疗过程的示意图[32]Fig.11 Schematic diagram of the structure and photodynamic therapy process of endoplasmic reticulum targeted photosensitizer BODIPY[32]
Zhao等[33]将ER靶向部分甲基磺酰胺、小分子共轭分子靶向药物厄洛替尼(erlotinib,EB)以及硅酞菁[silicon(IV)phthalocyanine dichloride,Pc]共价连接,合成目标化合物EB-ER-Pc(图12)。该化合物可以选择性地在表皮生长因子受体(epidermal growth factor receptor,EGFR)过表达的肿瘤细胞内质网内进行光动力治疗。体外试验证明,EB-ER-Pc具有优良的肿瘤靶向特异性以及出色的光动力抗癌活性。
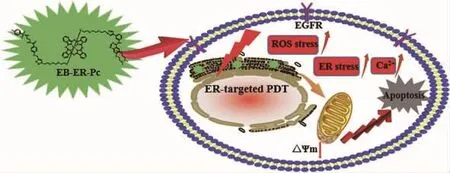
图12 内质网靶向光敏剂EB-ER-Pc的结构和光动力治疗过程的示意图[33]Fig.12 Schematic diagram of the structure and photodynamic therapy process of endoplasmic reticulum targeted photosensitizer EB-ER-Pc[33]
Deng等[34]开发了还原敏感性聚合物聚乙二醇-ss-1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-N-[氨基-(聚乙二醇)-2000]纳米粒子。该纳米离子负载了可以在内质网中累积的光敏剂,形成Ds-sP/TCPPTER NPs,在激光照射下原位产生ROS,引起内质网应激激活免疫细胞并放大免疫原性死亡(immunogenic cancer cell death,ICD),同时进行光动力 -免疫治疗(图 13)。

图13 Ds-sP/TCPP-TER可以在ER中积累并在NIR激光照射下产生ROS,导致内质网应激放大免疫原性死亡的示意图[34]Fig.13 Ds-sP/TCPP-TER can accumulate in the ER and generate ROS under NIR laser irradiation,resulting in ER stress that amplifies ICD[34]
5 总结与展望
将光敏剂直接运送到细胞器是一种具有前景的肿瘤光动力治疗策略,可最大限度地发挥以肿瘤细胞的细胞器为靶点的抗癌光动力治疗的疗效。基于纳米载体细胞器靶向的光敏剂由于具有相对游离光敏剂更高的抗癌效果、更长的血液循环时间和在指定部位释药等优点,已受到研究人员广泛关注。通过在细胞层面的MTT和细胞增殖试剂盒(cell counting kit-8,CCK-8)试验以及组织层面的苏木精-伊红(hematoxylin-eosin,H&E)染色证明这些纳米载体细胞器靶向光敏剂具有良好的生物安全性。目前大多数细胞器靶向光敏剂都是利用纳米载体进行递送的,一些研究还构建了诊疗一体的多功能纳米平台,有利于肿瘤的精准个性化治疗。纳米载体的出现为理想给药系统带来了新的希望。然而,从基础研究到临床转化的过程中,细胞器靶向纳米载体的研究仍面临以下问题和挑战:1)开发更安全、生物相容性更好、可被机体代谢排泄的细胞器靶向纳米光敏剂载体是今后光敏剂载体研究的重要方向,也是肿瘤细胞器靶向光动力治疗能够进入临床应用的前提;2)构建模块化的智能型纳米载体,能够在特定条件刺激下释放药物,从而减少药物进入细胞器之前的泄漏,同时提升药物在细胞器内释放的效率;3)在载体表面修饰各种靶向基团是目前实现纳米载体细胞器靶向功能的重要策略,但还需进一步研究携带靶向基团的纳米载体与细胞器之间的相互作用机制,这有利于提升纳米载体的细胞器靶向的效率以及光动力治疗的效果;4)有些细胞器靶向纳米载体具有很好的细胞器靶向性,但药物在细胞器中的释放不够高效,因此需要建立并完善纳米载体细胞器靶向效率及药物释放效率的评价机制。综上所述,发展和优化细胞器靶向纳米光敏剂递送系统以提高肿瘤光动力治疗效果仍是今后纳米光敏剂载体研究的重要方向。
——可作为磷酸盐库再利用!

