雨生红球藻己糖激酶基因的克隆和生物信息学分析
石 颖,宋亚楠,张宏江,季春丽,张春辉,李润植,崔红利
(山西农业大学分子农业与生物能源研究所,太谷030801)
雨生红球藻(Haematococcus pluvialis)是一种单细胞绿藻,属于团藻目(Volvocales),红球藻科(Haematococceae)[1]。因其多生长在淡水环境中,故又被叫做湖生红球藻或湖生血球藻[2]。雨生红球藻的整个生活史大致可以分为营养生长和虾青素积累两个阶段[3]。适宜条件下,雨生红球藻呈绿色游动营养细胞,是生物量高密度增长阶段,虾青素含量较低;胁迫条件下,雨生红球藻由绿变红,呈红色不动细胞,此阶段虾青素在细胞内大量积累[4-6]。虾青素(astaxanthin)是一种脂溶性色素,颜色艳红,可以强力清除细胞内的氧自由基,是一种高效的天然抗氧化剂,具有延缓皮肤衰老、增强免疫力等功效,广泛应用于化妆品、食品保健品、饲料添加剂及医药制剂等领域[7-8]。目前,雨生红球藻被公认为是自然界中最为理想的天然虾青素来源[9]。但是雨生红球藻中虾青素的合成与积累总是发生在不利于藻细胞生物量积累的诱导胁迫条件下,这两者之间的矛盾是限制雨生红球藻中天然虾青素产量的主要因素[3,10]。因此,如何提高雨生红球藻的生物量成为解决虾青素产量低这一问题的关键。相关文献表明,充分利用光合微生物的异养能力是提高细胞生物量的有效方式,培养过程中添加外源糖类对于提高微藻生物量的作用更为显著[11],但是在实际培养过程中,我们发现雨生红球藻不能有效利用外源糖类,同时有关其体内糖代谢的分子机制也并不清晰。
己糖激酶(hexokinase,HK)能催化己糖磷酸化,是植物呼吸代谢中的一个关键酶,是糖分解代谢的重要控制点,具有催化和调节的双重作用[12]。HK不仅能够调控植物体内游离糖和贮存糖的比率,在糖酵解和戊糖磷酸途径中具有重要作用[13],而且还能感知葡萄糖信号,参与细胞的信号传导过程,是植物体内糖与激素相联系的一个关键元件[14-16]。自1992年Minet等[17]从拟南芥中分离出第一个植物HK基因起,至今已从数十个高等植物(如水稻[18]、木薯[19]、梨[20]、桃[21]、苹果[22-23]等)中成功分离出了HK基因,并公布了相关序列,且对于模式植物HK基因结构和功能的研究越发成熟。相关文献报道,植物的HK基因多以基因家族的形式存在[24]。拟南芥(Arabidopsis thaliana)[25]HK基因家族由6种HK基因组成(At-HK1~AtHK6),水稻(Oryza sativaL.)[18]HK基因家族由 10种HK基因组成(OsHK1~OsHK10)。梨(Pyrusspp)果实中的HK基因在葡萄糖和果糖的积累过程中发挥着重要的负调控作用[20]。在拟南芥中,AtHK1的过度表达可以提高其幼苗对外源葡萄糖的敏感度,抑制表达则降低敏感度[25]。此外,抑制水稻Os-HK10的表达后,其植株传粉受到干扰,花粉萌发率明显下降[18]。
有关低等植物藻类HK基因的克隆分析虽鲜有报道,但Chen等[26]通过同源比对发现编码HK的基因序列广泛存在于微藻中,且首次从凯氏拟小球藻(Chlorella kessleri)中克隆获得了CkeHK基因。目前,有关雨生红球藻中HK基因尚未见相关报道。开展HaeHK功能的研究是探讨雨生红球藻己糖代谢分子机制的理想途径,因此获得基因序列并进行生物信息学分析是这个过程中必不可少的一部分。
本文以雨生红球藻为研究对象,利用同源克隆和cDNA末端快速扩增技术(rapid-amplification of cDNA ends,RACE)结合的方法克隆获得了HaeHK基因的cDNA全长序列,并通过生物信息学技术对其理化性质、结构功能及系统起源进化等方面进行了分析和预测,为进一步研究HaeHK的功能及雨生红球藻己糖代谢分子机制奠定了基础,同时为通过基因编辑手段实现添加外源糖类进行雨生红球藻异养培养提供了线索,对于构建性状优良藻株具有重要意义。
1 材料与方法
1.1 试验材料及培养条件
本研究所用雨生红球藻保存于山西农业大学分子农业与生物能源研究所藻种库。将雨生红球藻接种于MCM(modofoed Chalmers medium)培养基上,于(22±1)℃、光照条件下静置培养,光照强度为25μmol/(m2·s),光/暗周期为12 h/12 h,且每8 h震荡摇匀1次。所用大肠杆菌菌种为本实验室所保存的Top 10。MCM培养基配方见表1。
1.2 方法
1.2.1 总RNA的提取
取处于对数生长期的雨生红球藻细胞,用TRI-zol试剂盒提取总RNA(具体过程参考产品说明书),使用1%的琼脂糖凝胶电泳进行检测,并利用超微量分光光度计测定RNA的浓度和纯度(A260/A280)[27]。

表1 MCM培养基配方Tab.1 MCM medium formula
1.2.2 模板的制备
参照TaKaRa公司的试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser)合成雨生红球藻cDNA模板;参照Clontech公司的试剂盒(SMARTer TM RACE cDNA Amplication Kit)进行 RACE模板的制备[10]。
1.2.3HaeHK基因克隆
利用 GenBank下载团藻(Volvox carteri)、莱茵衣藻(Chlamydomonas reinhardtii)、盘藻(Gonium pectoral)、胶球藻 C-169(Coccomyxa subellipsoideaC-169)等编码HK基因的cDNA序列进行比对分析,通过CODEHOP软件设计兼并引物,根据同源克隆片段设计RACE引物[10],引物由上海生工生物工程有限公司合成。表2所示即为所设计引物信息。
以之前制备的雨生红球藻cDNA为模板,用合成的兼并引物RT-PCR扩增HaeHK基因的cDNA同源片段。PCR反应程序为:94℃预变性5 min;94℃变性 45 s,55 ℃退火 30 s,72 ℃延伸 130 s,30 个循环;72℃延伸10 min,4℃终止。循环结束后,PCR反应产物经1%的琼脂糖凝胶电泳进行检测。在获得同源克隆片段的基础上设计两端RACE引物(表2),以之前制备的RACE cDNA为模板,按照试剂盒说明书进行5'端和3'端片段的PCR。所得产物进行琼脂糖凝胶电泳检测、连接、转化及挑选阳性克隆测序。
1.3 HaeHK基因的生物信息学分析
利用软件(SeqMan software of DNAStar 7.1)对中间同源克隆片段和两端RACE片段拼接获得HaeHK基因cDNA全长序列。
通过序列处理在线工具包(the sequence manipulation suite,SMS)将获得的HaeHK的cDNA全长序列翻译成氨基酸序列,并通过ORF finder软件查找到目的基因的开放阅读框;理化性质分析通过软件ProtParam完成;HaeHK蛋白的二级结构及三级结构分别利用在线软件SOPMA和SWISS-MDEL进行预测;亚细胞定位通过PSORT软件进行预测;信号肽通过SignalP-5.0软件进行预测;跨膜结构域利用TMHMM软件进行预测分析;磷酸化位点通过软件NetPhos-3.1进行预测;HaeHK蛋白的保守结构域通过NCBI的CCD在线软件进行预测;通过在线BLAST程序对目的基因进行鉴定并下载同源相似序列,利用BioEdit及Clustal W软件对多序列进行比对分析,再通过软件MEGA绘制进化树[28-31]。
2 结果与分析
2.1 HaeHK全长cDNA克隆
本研究以雨生红球藻总RNA反转录所得到的cDNA作为模板,设计特异性引物(HK-F/HK-R),经PCR扩增获得cDNA中间片段。根据中间片段分别设计特异性引物(HaeHK51/HaeHK52和HaeHK31/HaeHK32),并通过RACE扩增获得该序列的5'端和3'端(图1)。拼接所获得的5'端、中间片段和3'端序列即可获得HK基因的cDNA全长序列。

表2 本文所用的引物信息Tab.2 Primer information used in this article

表3 生物信息学分析所用的网络资源Tab.3 Network resources of bioinformatics analysis
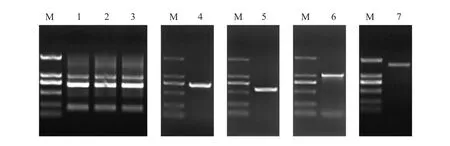
图1 雨生红球藻总RNA的提取及HaeHK基因克隆Fig.1 Total RNA of Haematococcus pluvialis and clonging of HaeHK
该基因cDNA全长为2 047 bp(NCBI注册号:MN082392),编码区从 101 ~ 1 816共 1 716 bp,编码571个氨基酸,5'非编码区(5'UTR)序列长100 bp,3'非编码区(3'UTR)序列长231 bp,并带有poly(A)尾巴(图2)。利用BLAST程序对所获得的HaeHK蛋白氨基酸序列与团藻和莱茵衣藻的HKs序列进行比对,发现其与团藻的HK同源性为50%,与莱茵衣藻HK的同源性为46%。
2.2 HaeHK蛋白的基本理化性质分析
ProtParam软件分析结果显示,HaeHK蛋白分子式为C2664H4224N762O797S29,该蛋白的预测分子量为60.61 kD,等电点(pI)为6.49。编码该蛋白的氨基酸共有20种,其中含量较高的氨基酸为丙氨酸(Ala,12.6%)和亮氨酸(Leu,11.4%),而色氨酸(Trp)、络氨酸(Tyr)、天冬酰胺(Asn)含量较低,分别为 1.6%、1.6%和1.4%。碱性(带负电荷)氨基酸残基总数(Asp+Glu)共53个,酸性(带正电荷)氨基酸残基(Arg+Lys)共48个。该蛋白的消光系数为62 420,吸光系数为1.030;蛋白质不稳定系数为40.76,脂肪酸系数为86.02,为较稳定蛋白;总平均亲水系数为0.013,为疏水性蛋白。通过PSORTⅡ软件对HaeHK蛋白的亚细胞定位进行预测,结果显示HaeHK蛋白定位于细胞质中,可判断为胞内蛋白。软件SignalP-5.0预测结果显示,编码HaeHK蛋白的氨基酸序列中没有信号肽序列。TMHMM软件结果显示,HaeHK蛋白中没有跨膜结构域,是可溶性蛋白。利用NetPhos-3.1软件预测到:HaeHK蛋白丝氨酸激酶(Ser)的磷酸化位点最多,为44个,在C端分布比较紧密;苏氨酸激酶(Thr)的磷酸化位点有34个,且分布不均;络氨酸激酶(Tyr)的磷酸化位点最少,为6个。

图2 HaeHK基因的cDNA全长核苷酸序列和氨基酸序列Fig.2 Nucleotide and deduced amino acid sequences of the full-length cDNA of HaeHK
2.3 HaeHK蛋白的二级结构分析
利用软件SOPMA对HaeHK蛋白的二级结构进行预测,结果显示:无规则卷曲占的比列最高,为44.66%;其次为α-螺旋,占比37.13%;延伸链和β-折叠分别为12.78%和5.43%。由此可说明,HaeHK蛋白的二级结构主要由无规卷曲和α-螺旋组成,为混合型蛋白。
2.4 HaeHK蛋白的高级结构预测
利用在线软件SWISS-MODEL对HaeHK蛋白的三维结构进行预测分析与同源建模。模板为水稻OsHK6蛋白(图3a),该蛋白与HaeHK蛋白的氨基酸序列相似性为39%,覆盖度为77%,保守序列范围为第49~522位氨基酸。X射线衍射发现HaeHK蛋白形成了典型“蝴蝶”型空间构象(图3b),其中包含1个大亚结构和1个小亚结构,具有典型的HK超家族特征,同时存在葡萄糖结合位点和己糖结合位点,说明HaeHK可以催化葡萄糖及其他己糖。
2.5 HaeHK蛋白的序列比对及结构域分析
利用SMART和CDD软件分析了HaeHK中的保守结构域,其中在第254~1 672位氨基酸处存在1个结构域,即PLN02914,属于HK超家族中的一员(图 4a)。
为了进一步研究HaeHK蛋白中的保守结构域,本研究对来源于7种藻类以及拟南芥的HKs氨基酸序列进行了比对分析,发现序列间的同源性较高。如图4b所示,HaeHK蛋白含有ATP结合位点(CD1:A DLGGTN RV;CD4:I GTGIN;CD7:A DGG)、HK结合位点(CD2:GF FSF)和葡萄糖激酶结合位点(ND E E)。
2.6 HaeHK的起源和系统进化分析
本文比对了来自低等植物藻类和高等植物等共17个不同物种的HKs氨基酸序列,并利用MEGA-7软件构建进化树,分析了HaeHK的进化关系(图5)。结果表明,进化树中来源于17个物种的HKs蛋白聚为低等藻类和陆生高等植物2支,其中HaeHK与真核绿藻HKs(莱茵衣藻、团藻和盘藻)聚为1类,且进化关系与物种进化过程相吻合。这些结果进一步暗示低等植物藻类和高等植物来源HKs具有共同的祖先。
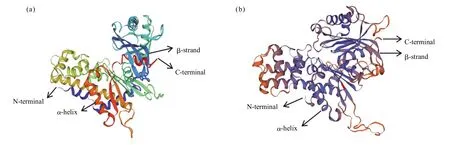
图 3 OsHK6(a)和 HaeHK(b)蛋白的高级结构Fig.3 Tertiary structure of OsHK 6(a)and HaeHK(b)

图4 HaeHK的结构域(a)及氨基酸序列比对分析(b)Fig.4 The structural domain(a),amino acid sequence alignment(b)analysis of HaeHK
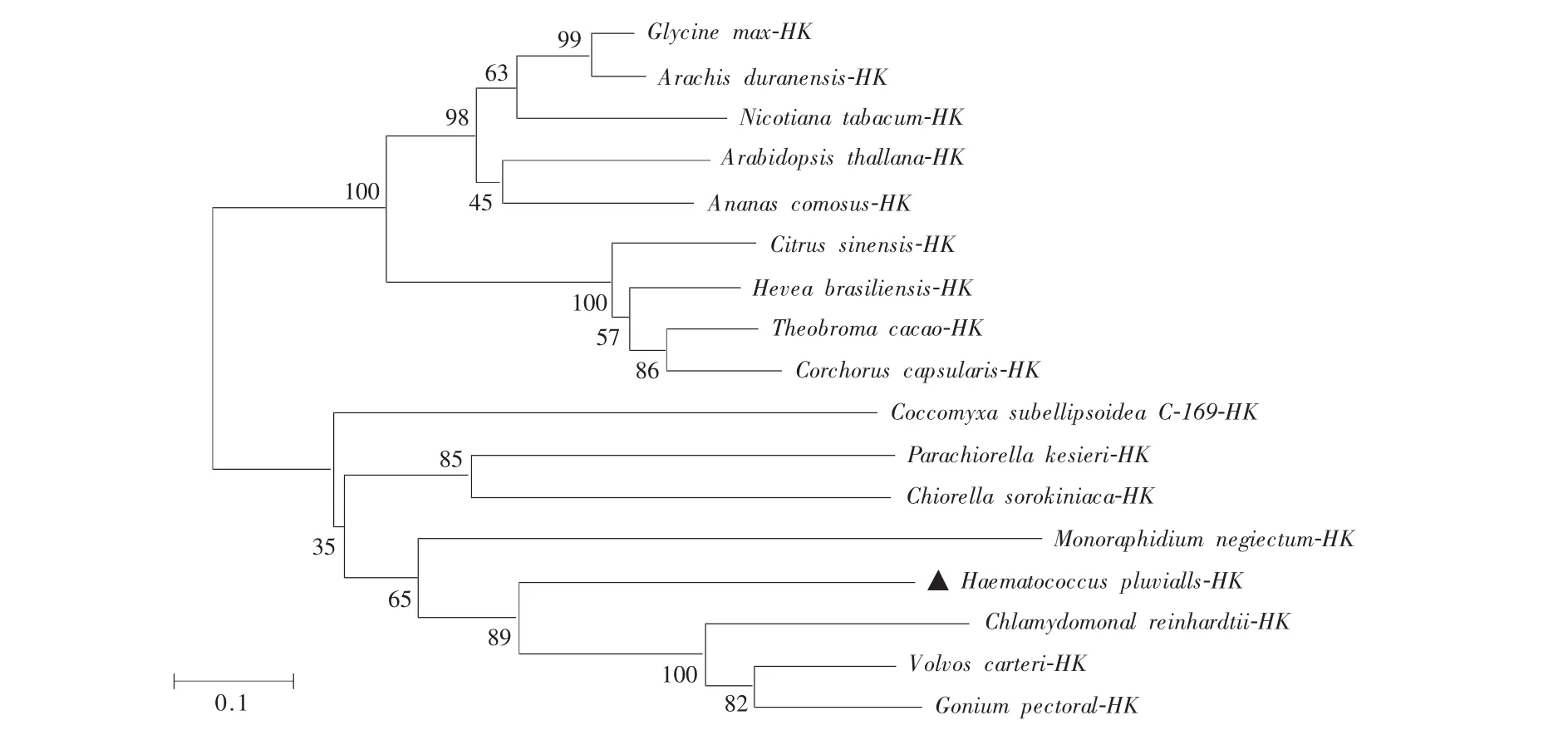
图5 HaeHK与其他物种HKs的系统进化分析Fig.5 Phylogenetic tree of HKs of Haematococcus pluvialis and other species
表4 HK基因名称及其登录号Tab.4 HK genes and their GenBank accession numbers
3 讨论
糖类又称碳水化合物,由C、H、O 3种元素构成,大致可以分为单糖、二糖和多糖等[32]。糖类对于微藻及植物是至关重要的,并且在其生长、发育和代谢中发挥着多重作用[33]。在植物的整个生命历程中,糖类作为呼吸作用的底物,为生物体提供了生长发育及代谢过程中所需的能量。作为光合作用的产物,为生物体提供养分的同时还对源库关系具有一定的调控作用。糖类的分解与合成会造成细胞渗透势的变化,这是影响植物抗逆能力的因素之一。糖代谢与核酸代谢、蛋白质代谢、脂类代谢以及次生物质代谢之间有着密不可分的关系[34-35]。此外,糖类也可以作为信号分子参与植物的糖信号转导过程,从而调节相关基因的表达[36-37]。
生物体内,己糖经过HK磷酸化作用后才可进入细胞糖酵解途径,进而为植物的各项生命活动提供能量及中间代谢产物[38]。HK在生物体内具有催化和调节的双重作用[30]。植物的HK基因多以基因家族的形式存在,且同一物种中的不同HK基因家族也存在明显的分化,表明HK基因会随着植物体的进化不断进化,从而产生拥有其他特异功能的家族成员[24]。
本研究以雨生红球藻作为研究对象,克隆获得其HaeHK基因的cDNA全长序列,同源比对分析显示其与团藻以及莱茵衣藻的序列相似程度较高,分别达到50%和46%,暗示了该基因可能是编码HaeHK的基因。高等植物的HK依据其结构特征可划分为3个亚类:Type A、B和C。其中,Type A是一类具有叶绿体转运肽的HK,定位于叶绿体中,如水稻OsHK4、烟草NtHK2和番茄LeHK4等;Type B是一类具有N端疏水膜锚定域的HK,定位于线粒体中,如拟南芥 AtHK1、AtHK2 及番茄 LeHK1、LeHK2、LeHK3等;Type C是一类N端既没有叶绿体(质体)信号肽也没有膜锚定特征结构域的HK,定位于细胞质中,如水稻 OsHK1、OsHK7、OsHK8 等[12,39-40]。定位于细胞质基质中的HaeHK蛋白,为胞内蛋白,既没有叶绿体信号肽也没有跨膜结构域,可见HaeHK蛋白的结构可能类似于水稻OsHK1,属于Type C。结构分析表明,HaeHK基因编码的蛋白具有ATP结合位点、HK结合位点以及葡萄糖糖结合域,且高级结构呈典型“蝴蝶”结构。这些都是HK家族的显著特征,且与拟南芥等植物中的发现相似,这些结果都能进一步证明该基因能编码HaeHK。HaeHK蛋白的进化分析结果显示,HaeHK与其他真核绿藻HKs聚为一支,高等植物聚为另外一支,进一步暗示低等植物藻类和高等植物来源HKs来自共同祖先。HK基因随着个体的发展不断进化,产生具有各异功能的家族成员,植物体进化程度越高,HK基因家族成员可能就越多,HK在生物体中发挥的作用更加多样。
综上所述,本研究为HaeHK基因的表达及功能研究奠定了基础,同时为解析雨生红球藻己糖利用及代谢的分子机制提供了线索,并有助于推进异养微藻代谢的相关研究。雨生红球藻是光合自养型微生物,在自然条件下生长缓慢,且不能有效地利用外源糖类进行异养。那么,雨生红球藻中的己糖代谢途径与小球藻等真核绿藻中的糖代谢途径有何不同?雨生红球藻中的HaeHK基因如何表达,它在整个糖代谢过程中扮演什么角色?随着基因编辑手段的发展应用,实现添加外源糖类进行雨生红球藻的异养培养对其整个己糖代谢过程有何影响?其中HK的表达进程是否改变?光对雨生红球藻中虾青素的积累具有明显的调控作用,同时光照在藻细胞糖积累过程中也起着至关重要的作用,那光和糖在雨生红球藻的生长过程中是否具有协同作用?这些问题都有待深入研究,也将是我们今后工作的重点。

