外源趋化剂对气单胞菌134的趋化性及其在水稻根际定殖的影响
王玉双,李一路,程 伟,张 敏*,郭照辉,雷 平,单世平,付祖姣,易红伟,杨 迪
(1.湖南省微生物研究院,长沙 410009;2.湖南双红农科生态工程有限公司,长沙410205;3.益阳欣博农业发展有限公司,益阳 413002)
根际有益微生物因可促进植物生长,降低植物对病虫害的感染,已经在农业等领域得到了广泛的应用。其能够成功应用并发挥作用的重要前提在于能成功存活和定殖,该过程受复杂的生态环境影响[1-3]。趋化性是指微生物对多种化学物质的浓度梯度产生趋向或离避响应的行为,是微生物为适应环境而自我保护的一种基本属性[4]。已有大量研究表明,趋化作用有助于根际微生物在根际的定殖[5-7]。趋化作用的产生与植物根系在生长发育过程中产生的根系分泌物密切相关。根系分泌物中的糖类、氨基酸、小分子有机酸等都可作为特定的信号物质诱导根际微生物的趋化,进而促进其在植物根际的定殖[8-11]。Tan等[12]研究表明,番茄根系分泌的有机酸,尤其是苹果酸,可显著诱导枯草芽孢杆菌T-5(Bacillus subtilisT-5)的趋化作用。Ankati等[13]发现,花生根系分泌物中的肉豆蔻酸、硬脂酸和棕榈酸对假单胞菌RP2(Pseudomons adaceaeRP2)在花生根际的定殖有正向影响。沈怡雯等[14]研究表明,西瓜根系分泌物中氨基酸组分能明显促进多黏类芽孢杆菌SQR-21(Paenibacillus polymyxaSQR-21)在西瓜根际的定殖。
水稻是我国主要的粮食作物,极易富集镉,稻米中吸收的镉可以通过食物链进入人体,危害人体健康[15-16]。如何降低水稻对土壤中镉的吸收已成为一个长期的研究热点。目前鲜有报道通过微生物的趋化性来达到促进水稻生长及降低水稻镉污染的研究。本研究拟开展相关工作,已从水稻根际土壤中分离出一株耐镉菌株134,初步鉴定为气单胞菌(Aeromonassp.),其对镉的耐受性可达75 mg/L。以水稻根系分泌物中的常见氨基酸组分和糖类为趋化剂,考察菌株134对不同组分的趋化性,最后通过水培试验考察外源添加趋化剂对菌株134在水稻根际定殖的影响,以期获得可高效诱导菌株134在水稻根际定殖的趋化剂,为开发利用有效的微生物肥料提供理论支撑,为水稻镉污染治理提供技术参考。
1 材料与方法
1.1 材料
1.1.1 供试植株
水稻品种为湘晚籼13号(Xiangwanxian 13),其种子购于湖南省水稻研究所。
1.1.2 培养基与主要试剂
BHIS(brain heart infusion supplemented)液体培养基、Hoagland营养液、趋化缓冲液都根据文献[14]来配置。趋化剂标准品(组氨酸、亮氨酸、丙氨酸、苏氨酸、甘氨酸、葡萄糖、果糖、蔗糖、麦芽糖)和牛心脑浸液培养基均购于长沙鼎国生物技术有限公司。
1.2 试验方法
1.2.1 水稻苗培育
水稻种子用70%乙醇消毒15 min,用去离子水清洗3遍,均匀铺至带孔盆内,然后用湿纱布覆盖,置于温度为30℃、湿度为50%的人工气候培养箱中培育,待种子发芽长至1 cm左右,移栽至水培盒内继续生长。
1.2.2 耐镉菌株的分离纯化
从湘潭镉污染水稻田中取水稻根际土制成土壤悬液,用无菌水进行梯度稀释,取0.1 mL涂布在预先已加入CdCl2的细菌平板上,30℃下恒温培养1~2 d,挑取单菌落,经多次划线、分离纯化获得纯菌株。
1.2.3 菌株的鉴定
1.2.3.1 形态学鉴定
将纯化后的菌株在细菌培养基上培养,观察细菌菌落生长特征,注意其形状、大小、颜色等,并作记录。
1.2.3.2 生理生化鉴定
按照东秀珠等[17]编著的《常见细菌系统鉴定手册》进行生理生化试验。
1.2.3.3 16S rDNA序列分析
取纯菌株134对数生长期的新鲜菌液1 mL,离心并收集菌体,用Ezup柱式细菌基因组DNA抽提试剂盒(上海生工)提取总DNA,采用细菌通用引物(27F和1492R)进行PCR扩增,将扩增产物测序,利用BLAST软件将所测得的序列与GenBank数据库中已登录的序列进行同源性比较,并采用MEGA6构建系统发育树[18]。
1.2.4 菌株134对外源趋化剂的趋化研究
1.2.4.1 试验设计
参考郝文雅等[19]的研究,选取水稻根系分泌物中存在的氨基酸(苏氨酸、甘氨酸、丙氨酸、亮氨酸、组氨酸)和糖类(果糖、葡萄糖、蔗糖、麦芽糖)进行趋化试验分析。试验前配置浓度分别为0、40、60、80和100 μmol/L的各趋化剂标准液,过滤除菌后备用。
1.2.4.2 趋化作用定性分析
参照Grimm等[20]的滴定分析法,并作适当修改。将活化好的菌株134种子液按1%的接种量接入BHIS液体培养基中,摇床(30℃、170 r/min)振荡培养至对数生长期(OD600nm=0.8)。取50 mL发酵液于室温5 000 r/min离心,收集菌体并重悬于12 mL趋化缓冲液中,再加入4 mL 1%的羟丙基甲基纤维素制成菌悬液,充分混匀后倒入直径为6 cm的细胞培养皿中,每皿约4 mL。然后向培养皿正中央分别滴入10 μL各趋化剂标准液并在室温条件下静置30 min,观察培养皿中央趋化圈的变化情况。以添加趋化缓冲液作为对照组。
1.2.4.3 趋化作用定量分析
本文采用类毛细管试验法[21],在BHIS液体培养基中接种过夜活化好的菌株134种子液,30℃、170 r/min振荡培养至对数期(OD600nm=0.8),将发酵液于室温5 000 r/min离心后重悬于等体积趋化缓冲液中制成菌悬液,用移液枪吸取100 μL菌株134菌悬液置于无菌操作台中备用。用1 mL注射器作为试验用毛细管,分别吸取100 μL不同浓度(0、40、60、80 和 100 μmol/L)的趋化剂标准液,将注射器针头插入上述移液枪头的细口端,使趋化剂标准液与菌悬液充分接触并静置2 h。小心取出注射器针头,对注射器中的趋化剂标准溶液采用平板稀释涂布法进行细菌计数。每个处理设置3次重复,以趋化缓冲液作为对照,计算3个重复平板菌落数的平均值。趋化性指数(relative chemotaxis indix,RCI)值为处理组菌落形成单位(colony forming units,CFU)的平均值与相应对照组CFU的比值,有研究表明,当RCI大于2.00时即可认为处理的趋化性与对照相比差异显著[14]。
1.2.5 外源添加趋化剂对菌株134在水稻定殖的影响
本试验中水稻采取水培的模式进行培养。将培养至对数期的菌株134离心重悬于水培盒营养液中,使其终浓度约为106CFU/mL,并充分混匀。将培养至4片叶的水稻幼苗根系在趋化剂标准溶液中浸泡后移栽至水培盒,对照以趋化缓冲液代替,每个处理设置3组重复。将水培盒置于28℃人工气候培养箱(光照16 h/黑暗8 h)中培育3 d,然后收集水稻根系并对根际定殖的菌株134进行平板涂布计数。
1.3 数据分析
该试验所有数据处理及绘图采用Microsoft Excel(2003)软件完成,各处理间的方差分析和差异显著性检验采用SPSS 13.0统计软件完成。
2 结果与分析
2.1 菌株的分离及鉴定
经浓度梯度培养分离,筛选出一株在液体细菌培养基中耐镉质量浓度为75 mg/L的菌株134,该菌株菌落形态为圆形,直径为1~3 mm,菌体呈短杆状,革兰氏染色为阴性(图1)。
对分离菌134进行生化鉴定,结果见表1。该菌株接触酶和氧化酶试验呈阳性,且甘露醇、葡萄糖、水杨素、N-乙酰葡萄糖胺、D-核糖、麦芽糖、葵酸盐、戊酸盐、乙酸盐、组氨酸、L-丙氨酸、糖原、L-脯氨酸和L-丝氨酸试验反应也均为阳性。对该菌进行溶血试验观察,结果为阴性。
以菌株134的总DNA为模板,通过PCR扩增并经测序和Blast比对,选取与其同源性高的16S rDNA序列,利用MEGA 6构建系统进化树(图2)。由结果可以看出,气单胞菌属(Aeromonas)与菌株134序列同源性最高,再接合形态特征及生理生化鉴定结果,可初步鉴定此分离菌株134为气单胞菌。
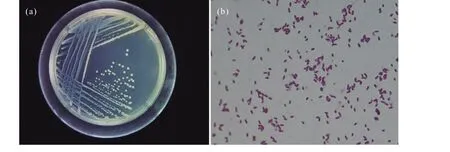
图1 菌株 134的菌落(a)及形态表征(b)Fig.1 Colony(a)and morphology(b)characterization of strain 134
2.2 菌株134对不同氨基酸组分的趋化性研究
滴定分析法定性试验结果通过测量试验过程中培养皿中形成的透明圈的大小来表示。有透明圈的产生就说明菌株134在试验过程中向培养皿中心的趋化剂标准液游动,即产生了趋化作用。结果如表2所示,菌株134对这5种氨基酸均表现出趋化性,其中对组氨酸的趋化性最强,亮氨酸和丙氨酸次之。
选择效果明显的3类氨基酸进行不同浓度的类毛细管定量试验,结果表明(图3),菌株134对各个浓度的组氨酸均表现出明显的趋化性,RCI均大于 2.00,当其浓度为 40 μmol/L 时,RCI值达到 7.20,趋化作用最强。当亮氨酸浓度为80 μmol/L及以上时,菌株134表现出明显的趋化性,尤其是浓度为80 μmol/L时,其 RCI值达到 4.90,低浓度时菌株134的趋化性较弱。当丙氨酸的浓度为中等浓度(40~60 μmol/L)时可以诱导菌株 134 一定的趋化性,RCI值为 2.25~2.57。
2.3 菌株134对不同糖类的趋化性研究
滴定分析法定性试验结果表明(表2),除蔗糖外,菌株134对葡萄糖、麦芽糖及果糖均表现出明显的趋化性。菌株134对葡萄糖和果糖的趋化性较强,其次为麦芽糖。选择这3种糖类进行不同浓度的类毛细管定量试验,结果如图4所示,菌株134对各个浓度的葡萄糖和果糖均表现出明显的趋化性,RCI均大于2.00。不同的是,菌株134对葡萄糖的趋化强度随葡萄糖浓度的升高呈先上升后下降的趋势,浓度为 60~80 μmol/L 时,RCI值达到 7.00 以上。而菌株134对果糖的趋化强度随浓度升高几乎都呈上升趋势。当果糖浓度为100 μmol/L时,RCI值达到5.00。当麦芽糖的浓度为40 μmol/L时可以诱导菌株134一定的趋化性,RCI值为2.47,当其浓度继续上升时,菌株134表现出的趋化性很弱,RCI值都小于2.00。
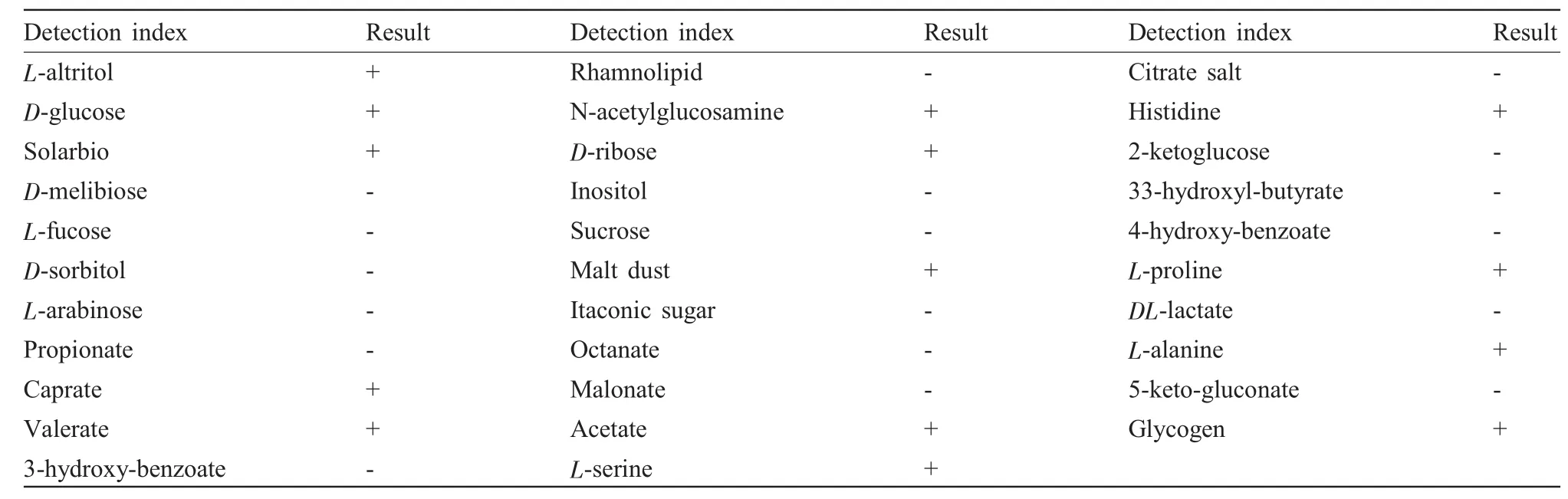
表1 分离菌株134主要生化特征检测结果Tab.1 Main biochemical characteristics test results of the isolate 134
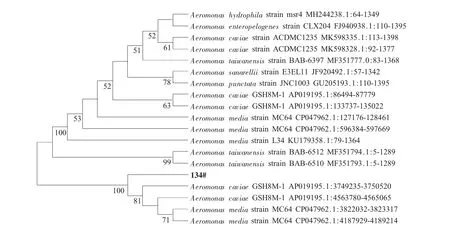
图2 分离菌株134的系统进化树Fig.2 Phylogenetic analysis of the isolate 134

表2 菌株134对氨基酸和糖类的趋化性Tab.2 Chemotaxis of strain 134 to amino acids and sugars
2.4 外源趋化剂对菌株134在水稻根际定殖的影响
由前面的趋化性试验结果可以看出,菌株134对组氨酸、亮氨酸、葡萄糖及D-果糖具有较强的趋化性,选择这4种趋化组分及其趋化效果最强的浓度(分别为 40、80、60 及 100 μmol/L)设计水培试验,进一步验证外源趋化剂对菌株134在水稻根际定殖的影响。计数结果如图5所示,这4种趋化组分均能促进菌株134在水稻根际的定殖,除组氨酸外,其他3组处理与对照均存在显著差异(P<0.05),尤其是葡萄糖和果糖的处理,与对照相比差异极显著(P<0.01)。亮氨酸、组氨酸、葡萄糖及D-果糖这4种 趋化组分处理的根际定殖细菌数量分别为对照的2.29、1.32、3.48及 3.87倍。

图3 菌株134对不同浓度氨基酸的趋化反应Fig.3 Chemotactic response of strain 134 toward different cocentrations of amino acids

图4 菌株134对不同浓度糖类的趋化反应Fig.4 Chemotactic response of strain 134 toward different cocentrations of sugars
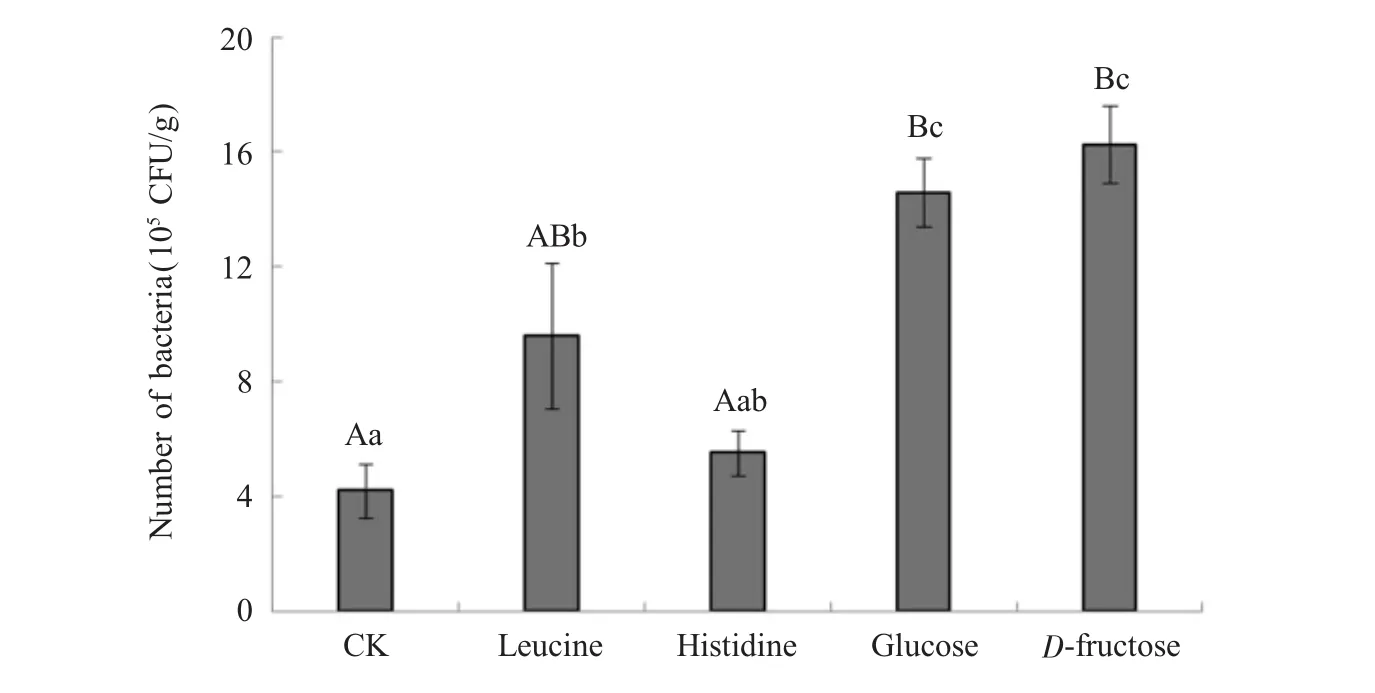
图5 根系浸润不同趋化剂后菌株134在水稻根际的定殖数量Fig.5 The population levels of strain 134 recruited by rice roots after adding different chemotacticum to the rhizosphere
3 讨论
根际有益微生物在农业应用中拥有极大的潜能,其发挥作用的前提是能够在植物根际中成功定殖。根际微生物的定殖能力不仅与自身特性相关,更是受植物根系分泌物的影响[22]。植物根系分泌物含有丰富的有机物质,如氨基酸、糖类、有机酸、蛋白质及次级代谢产物。这些有机物质不仅能为土壤微生物的生长和寄生提供丰富的养分,同时还可以作为信号分子调控土壤微生物之间或者微生物与寄主之间的互作[3,7]。已有大量研究表明,根系分泌物在根际微生物定殖过程中发挥着重要的作用。如Susana 等[23]发现,假单胞菌 SR1(Pseudomons adaceaeSR1)在小麦和玉米的根系定植可以促进植物生长、增产并且可降低施肥量。Cao等[24]研究发现,枯草芽孢杆菌SQR9(Bacillus subtilisSQR9)在黄瓜根际定殖中可以抑制黄瓜根际尖孢镰刀菌(Fusarium oxysporum)的生长,保护寄主免受病原菌的侵害。而目前关于水稻根系分泌物-根际有益微生物-水稻重金属抗性的研究报道很少。本文基于此开展系统的研究工作,目前从水稻根际中分离出一株高耐镉气单孢菌134,在模拟添加水稻根系常见分泌物后,可成功定殖于水稻根际。
根系分泌物与根际微生物相互作用的一个重要的研究方向即为两者之间的趋化性。趋化性是一种重要的运动特性,允许细菌向根表面移动,对根系分泌物的正趋化是细菌定殖的一个基本特性[4,8]。本试验中,除苏氨酸与蔗糖外的其他趋化剂均能使菌株134产生趋化圈,其中组氨酸、亮氨酸、葡萄糖及D-果糖对气单胞菌134具有较强的趋化性。Jin等[7]研究表明,韦氏杆菌 S3-1(Bacillus velezensisS3-1)对玉米根系分泌物中的葡萄糖和苹果酸有强趋化作用;杨姗姗等[25]研究表明,葡萄糖、组氨酸、亮氨酸和精氨酸等均能诱导西瓜嗜酸菌(Acidophilus)向其正趋化。本研究结果与前人研究结果基本一致。
趋化剂的浓度对细菌的正趋化作用有直接影响。Thimmaraju 等[26]研究表明,在 0~30 μmol/L 的浓度范围内,苹果酸对枯草芽孢杆菌FB17(Bacillus subtilisFB17)的趋化作用随着浓度的升高而增强。Yuan等[6]研究发现,芽孢杆菌 NJN-6(Bacillus amyloliquefaciensNJN-6)对于有机酸的趋化作用随浓度的升高而呈先增强后减弱的趋势,其对于中等浓度(25~50 μmol/L)的有机酸的趋化作用最强。本研究结果发现,不同浓度趋化底物对气单胞菌134的趋化作用也各不相同,当组氨酸、葡萄糖和果糖浓度在40~100 μmol/L时,均可诱导菌株134产生较强的趋化性,其CRI值都在2.00以上。尤其是当组氨酸浓度为 40 μmol/L,葡萄糖浓度为 60 μmol/L 时,趋化作用最强,RCI值高达7.00以上。
为了进一步证实这些趋化剂对于气单胞菌134在根际定殖中的影响,本研究采取水培试验来考察菌株134在水稻根际的定殖情况。结果表明,滴定分析法定性试验中现象最明显的4种趋化剂组氨酸、亮氨酸、葡萄糖及D-果糖均能促进菌株134在水稻根际的定殖,尤其是葡萄糖和D-果糖的处理与对照组的差异极为显著,但在实际农田应用中,其促进菌株134在水稻根系定殖的情况还有待进一步研究验证。
植物根际是一个复杂的生态环境,其根系和根际微生物的共同作用可以改变根际环境,影响根际土壤中的各种生物有效性。采用人工施加根际有益微生物,可以改变根际生态环境的群落结构,利于植物的生长及抵抗逆境,在微生物肥料的研发上具有很大的潜力。本研究小组前面报道过,在水稻根际接种高耐镉柠檬酸杆菌XT1-2-2(Citrobactersp.XT1-2-2)可以明显地促进水稻的生长,提高水稻的生物量并降低稻米对镉的吸收[27]。本研究中的气单胞菌134分离自镉污染水稻的根际土壤,对镉耐受性较强。但关于菌株134在水稻根际定殖后对水稻的生长及降镉的影响还未开展试验。接下来将重点研究在趋化剂的诱导下菌株134在土培水稻根际的定殖情况,以及定殖成功的菌株134对水稻的生长及降镉效果的影响,以期为研究菌株134与水稻根系的互作机制、目标菌株的实际农业应用提供参考。

