非洲猪瘟病毒微滴式数字PCR检测方法的建立与应用
严 礼,宋 晟,张继红,唐小兰,张海韵,郭焜鹏
(食品安全监测与预警湖南省重点实验室,湖南省食品质量监督检验研究院,长沙410117)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的一种猪的急性、出血性传染病,因其严重危害养猪业,且无有效的疫苗防治,世界动物卫生组织(Office Inter-national des Epizooties,OIE)将其列为法定上报传染病。我国将其列为一类传染病,在国务院办公厅印发的《国家中长期动物疫病防治规划(2012-2020年)》中,非洲猪瘟是作为13种重点防范的外来动物疫病之一[1-4]。非洲猪瘟于2007年4月在格鲁吉亚爆发,同年11月,俄罗斯发生首例非洲猪瘟,并逐渐蔓延至俄罗斯远东地区。2018年非洲猪瘟在我国蔓延,严重威胁我国养猪业的发展,个别省份发生大规模的生猪减产,并存在非洲猪瘟病死猪肉流入市场的风险。因此,建立一种特异性强、灵敏度高、重复性好的病毒检验方法迫在眉睫[5-9]。
微滴数字 PCR(droplet digital PCR,ddPCR)是近几年出现的新一代聚合酶链式反应(polymerase chain reaction,PCR)技术。利用油包水技术将反应液分割为数万个纳米级大小的微滴,每一个微滴都是一个独立的PCR反应体系,当PCR扩增完成后,利用微滴分析仪逐个对每个微滴进行检测,再根据统计学中的泊松分布原理分析阳性微滴的个数与比例,即可得出靶分子的起始拷贝数或浓度,从而实现对低至单个拷贝核酸分子的绝对定量。与传统实时荧光定量 PCR(quantitative real-time PCR,qPCR)方法相比,它不依赖于标准曲线,因而定量结果更为精确,同时也使体系受反应抑制因子的影响大大降低[10-17]。
本研究根据非洲猪瘟病毒核酸的2段保守序列(VP72和K205基因),合成3对引物和探针,通过反应条件摸索,方法优化,比较不同引物、探针之间线性、特异性、灵敏性和重复性的优劣,并建立非洲猪瘟病毒的ddPCR检测方法。这有利于了解和控制非洲猪瘟疫情,也有利于严控非洲猪瘟病死猪肉及猪肉制品在市场上的销售,切实保障人民群众的身心健康。
1 材料与方法
1.1 材料
质粒小量抽提试剂盒[生工生物工程(上海)股份有限公司上海],磁珠法病毒DNA/RNA提取试剂盒(天根生化科技有限公司北京),非洲猪瘟检测试剂盒(迪澳生物科技有限公司广州),猪瘟病毒检测试剂盒(莱普生信息科技有限公司洛阳),猪蓝耳病病毒检测试剂盒(莱普生信息科技有限公司洛阳),微滴数字PCR Supermix for Probes及微滴数字PCR相关试剂(Bio-Rad公司美国)。
1.2 仪器
QX200微滴式数字PCR仪(Bio-Rad公司美国),CFX96 Touch荧光定量PCR仪(Bio-Rad公司美国)。
1.3 引物、探针与重组质粒的设计与合成
第一组引物、探针与重组质粒:参照《OIE陆生动物诊断与疫苗手册》[18]非洲猪瘟qPCR检测方法中的引物和TaqMan荧光探针序列,送至生工生物工程(上海)股份有限公司进行合成。上游引物序列F为:5'-CTGCTCATGGTATCAATCTTATCGA-3';下游引物序列R为:5'-GATACCACAAGATCRGCCGT-3';探针(Probe)为:CCACGGGAGGAATACCAACCCAGTG。探针的5'端标记荧光报告基团羧基荧光素(5-carboxyfluorescein,FAM),3'端标记荧光淬灭基团黑洞猝灭基团(black hole quencher-1,BHQ1)。VP72序列为:CTGCTCATGGTATCAATCTTATCGATAAATTTCCATCAAAGTTCTGCAGCTCTTACATACCCTTCCACTACGGAGGCAATGCGATTAAAACCCCCGATGATCCGGGTGCGATGATGATTACCTTTGCTTTGAAGCCACGGGAGGAATACCAACCCAGTGGTCATATTAACGTATCCAGAGCAAGAGAATTTTATATTAGTTGGGACACGGATTACGTGGGGTCTATCACTACGGCTGATCTTGTGGTATC。质粒载体为pUC57。
第二组引物、探针与重组质粒:参照T/CVMA5-2018《非洲猪瘟病毒实时荧光PCR检测方法》[19]非洲猪瘟qPCR检测方法中的引物和TaqMan荧光探针序列,送至生工生物工程(上海)股份有限公司进行合成。上游引物序列F为:5'-ATAGAGATACAGCTCTTCCAG-3';下游引物序列R为:5'-GTATGTAAGAGCTGCAGAAC-3';探针(Probe)为:TATCGATAAGATTGAT。探针的5'端标记荧光报告基团FAM,3'端标记荧光淬灭基团BHQ1。VP72序列为:ATAGAGATACAGCTCTTCCAGACGCATGTTCATCTATATCTGATATTAGCCCCGTTACGTATCCGATCACATTACCTATTATTAAAAACATTTCCGTAACTGCTCATGGTATCAATCTTATCGATAAATTTCCATCAAAGTTCTGCAGCTCTTAC。质粒载体为pUC57。
第三组引物、探针与重组质粒:参照邬旭龙等[11]的《非洲猪瘟病毒微滴数字PCR(ddPCR)方法的建立及应用》非洲猪瘟qPCR检测方法中的引物和TaqMan荧光探针序列,送至生工生物工程(上海)股份有限公司进行合成。上游引物序列F为:5'-CAGGCAAAACAAGTGAAACA-3';下游引物序列R为:5'-GCAAACTGCTCATCCAATAT-3';探针(Probe)为:TGTTCTTCACGCGTAGCGAATGGGC。探针的5'端标记荧光报告基团FAM,3'端标记荧光淬灭基团BHQ1。K205序列为:CAGGCAAAACAAGTGAAAC-ACCTAAAAAAAATCCCACGAATGCAATGTTCTTCACGCGTAGCGAATGGGCATCCTCGAAAACTTTTCGAGAAAAGTTTTTAACACCAGAAATTCAGGCCATATTGGATGAGCAGTTTGC。质粒载体为pUC57。
1.4 微滴数字PCR反应体系及条件
微滴数字PCR设置上、下游引物各1 μL(浓度为 500 nmol/L),探针 0.5 μL(浓度为 250 nmol/L),ddPCR Super mix for Probes 10 μL,DNA 模板 5 μL,加 ddH2O至20 μL。利用 Bio-Rad QX100数字 PCR微滴生成仪将20 μL体系混合物合成微滴,再利用Bio-Rad T100 PCR仪进行扩增。ddPCR反应条件为:95 ℃预变性 10 min,94 ℃变性 30 s,50~60 ℃退火1 min,40个循环,98℃微滴固化10 min,4℃保存。PCR反应结束后,利用Bio-Rad QX200微滴分析仪读取DNA拷贝数。
1.5 特异性试验
以猪瘟病毒(classical swine fever virus,CFSV)和猪蓝耳病病毒(porcine reproductive and respiratory syndrome,PRRSV)的保守序列重组质粒为模板,用非洲猪瘟病毒微滴数字PCR试验方法进行检测,评估该方法的特异性。
1.6 方法检出限、线性范围与重复性试验
将重组质粒以10倍的梯度进行稀释,取5 μL作为模板DNA进行ddPCR和qPCR检测,每个梯度质粒含量分别为 0.1、1.0、10.0、100.0、500.0 fg,每个梯度做3次平行检测。评估方法的检出限、线性及重复性。
2 结果与分析
2.1 非洲猪瘟病毒微滴数字PCR方法的优化
设置 60、59、58、56、54、52、51、50 ℃梯度的退火温度,从左至右,蓝色微滴显示为阳性微滴。引物探针1的退火温度越低阳性微滴荧光信号越强;引物探针2的阳性微滴荧光信受退火温度影响不明显;引物探针3的退火温度越低,阳性微滴荧光信号越低。综合这3组引物探针的扩增效果,本研究最终选择了58℃作为退火温度。
在以此确定的反应条件下,引物探针1的阴阳性微滴划分阈值划定在荧光强度为1 000的位置,引物探针2和引物探针3的阴阳性微滴划分阈值均划定在荧光强度为2 000的位置(图1)。
2.2 ddPCR检测方法特异性
3对引物、探针均采用CFSV重组质粒、PRRSV重组质粒及蒸馏水对ddPCR检测方法的特异性进行验证,均无显著非特异性扩增,表明非洲猪瘟ddPCR检测方法具有良好的特异性(图2)。引物探针1的假阳性率为每反应0.4个阳性微滴;引物探针2的假阳性率为每反应0.0个阳性微滴;引物探针3的假阳性率为每反应0.6个阳性微滴。由于假阳性为小概率事件,所以根据泊松分布建立模型,以假阳性率估计得到的引物探针1的空白限(limit of blank,LoB)为1拷贝ASFV基因,引物探针2的空白限为0拷贝ASFV基因,引物探针3的空白限为2拷贝ASFV基因。单个反应体系中待测样本浓度低于空白限以下为检测灰区,无法判定阴阳性,且各引物探针的检出限必须高于空白限且存在显著差异。
2.3 ddPCR检测方法灵敏度与线性范围
将重组质粒以10倍的梯度进行稀释,并配置PCR反应体系,得到终质量浓度分别为0.1~500 fg/反应的样品,而后进行ddPCR检测。所有ddPCR反应生成的微滴数目均大于10 000滴,表明所有反应微滴均正常生成,保证了后续定量分析的准确性。试验表明,ddPCR的检测范围是101~106拷贝数/反应,所有检出限均高于空白限,结果可靠,其中引物探针3的检测线最低,为2.73拷贝数/反应(表1)。从根据检测结果绘制的标准曲线中可发现,样品DNA浓度在101~106拷贝数/反应之间时,ddPCR检测结果呈良好的线性关系,3组引物探针的R2都大于0.990 0,适合定量检测的需要(图3)。
2.4 ddPCR检测方法重复性
重复性试验结果显示,3组引物探针在0.1 fg/反应质量浓度下检测变异系数较高(36.09~117.22),而在质粒的质量浓度为1~500 fg/反应范围内,3组引物探针检测变异系数均低于15,具有良好重复性,因此定量质粒的质量浓度范围为1~500 fg/反应(表2)。

表1 非洲猪瘟ddPCR和qPCR检测检出限比较Tab.1 Comparative detection limit of the ASFV ddPCR and qPCR assays

图1 非洲猪瘟病毒微滴数字PCR退火温度条件Fig.1 Temperature conditions of African swine fever virus droplet digital PCR
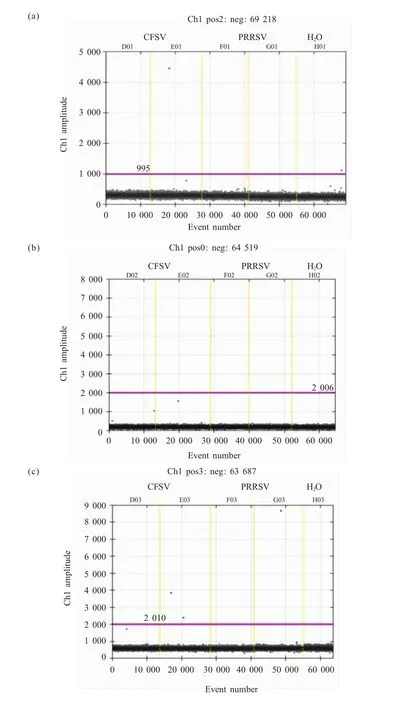
图2 ddPCR非洲猪瘟病毒方法特异性试验Fig.2 Specificity of African swine fever virus ddPCR method
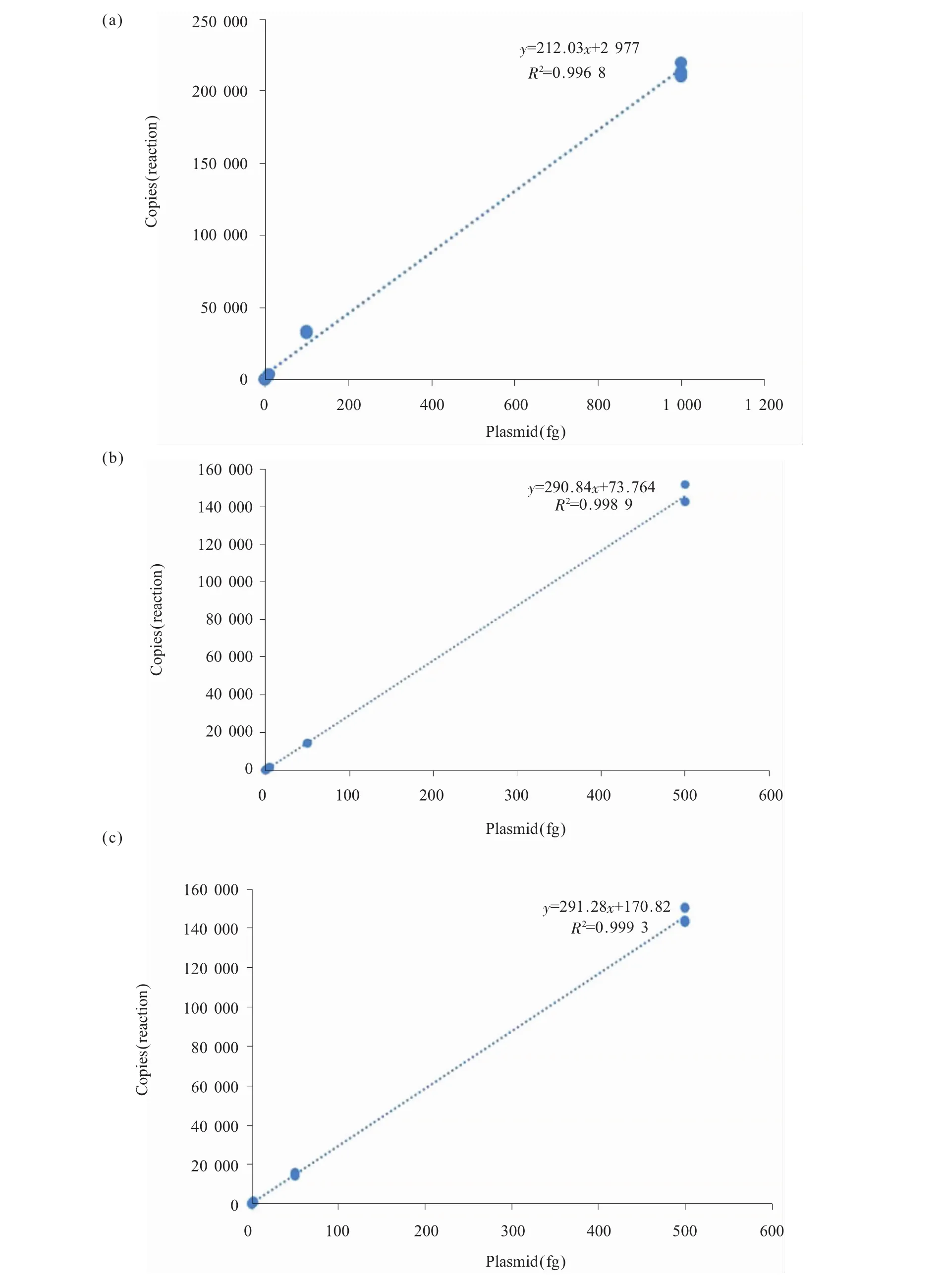
图3 ddPCR非洲猪瘟病毒方法标准曲线Fig.3 Standard curve of African swine fever virus ddPCR method

表2 非洲猪瘟ddPCR重复性试验Tab.2 Repeatability of ASFV ddPCR
3 讨论
随着非洲猪瘟于2018年在我国被发现,至今已在全国形成了一定的污染面。养猪场户的防疫意识普遍薄弱,防疫水平整体低下,清洗消毒措施难以完全落实到位,养殖环节疫情传播风险持续存在,同时还存在带非洲猪瘟病毒的猪肉流入食品生产加工领域的风险。而建立一种灵敏度更好、准确性更高、抗干扰能力更强并且能避免假阴性与假阳性的非洲猪瘟病毒检测方法能更及时地发现潜在风险,既有利于非洲猪瘟疫情“早发现、早报告、早处置”,也有利于降低运输、屠宰、生产加工等下游环节疫情传播风险,更有利于有效防范非洲猪瘟猪肉进入食品加工环节。目前运用最广的ASFV检测技术是世界动物卫生组织(World Organization for Animal Health,OIE)和联合国粮食及农业组织(Food and Agriculture Organization of the United Nations,FAO)推荐的红细胞吸附试验(用于病毒分离)、直接免疫荧光试验、免疫酶组化试验、夹心酶联免疫吸附试验(用于检测病毒抗原)、聚合酶链式反应、qPCR以及环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)(用于检测病毒核酸)。我国针对ASF的实验室诊断技术分别制定了一个国家标准《非洲猪瘟诊断技术》GB/T 18648-2002[20]、一个商检行业标准《非洲猪瘟检疫技术规范》SN/T 1559-2010[21]和一个团体标准《非洲猪瘟病毒实时荧光PCR检测方法》T/CVMA 5-2018[19]。其中最为常用的检测技术是qPCR,但该技术无法实现精准定量,在实际工作中可能出现假阴性与假阳性结果,给非洲猪瘟疫情的防疫工作带来极大的不便。而ddPCR作为一种新的定量检测技术已广泛运用到分子生物学检测中,具有较好的特异性与准确性,理论上可以精确到单个病毒核酸的检测,能有效避免qPCR检测所遇到的假阴性、假阳性问题,极大地提高检测的准确性。原霖等[10]、邬旭龙等[11]开展了非洲猪瘟病毒的ddPCR相关研究工作,但尚未广泛推广应用到ASFV的检测中,尤其是预包装食品领域仍未见相关报道。本文根据非洲猪瘟病毒核酸的2段保守序列(VP72和K205基因),合成3对引物和探针,摸索条件,优化方法,并比较方法的线性、特异性、灵敏性和重复性。结果表明,这3种方法的检出限均小于6拷贝数/反应,在10~106拷贝数/反应之间呈良好的线性关系,定量范围内的检测变异系数均低于15%,重复性好,特异性强,能满足快速定量检测的要求。在后续工作中,这3种方法将进一步推广应用到生鲜肉、冷却肉、腌腊肉、酱卤肉、油炸肉、火腿、肉干、肉铺等猪肉制品中,争取在源头、食品加工、食品销售等各个环节中加强生鲜猪肉及各类猪肉制品中非洲猪瘟病毒的检测,切实降低潜在风险。

